前蛋白转化酶枯草溶菌素9在肾脏疾病的研究
张志宏 综述 王金泉 审校
前蛋白转化酶枯草溶菌素9(PCSK9),又称为神经细胞凋亡调节转化酶1(NARC1),是前蛋白转化酶家族的第9大成员,主要来源于肝脏细胞,在小肠、肾间质细胞及神经元也有表达。PCSK9是一种低密度脂蛋白(LDL)调节靶向物质,通过调节肝脏LDL受体(LDL-R)的表达和分泌活性发挥调脂作用(图1)[1]。肾脏疾病患者常合并脂质代谢紊乱,且心血管事件风险显著升高。PCSK9与肾脏疾病的蛋白尿、脂质代谢紊乱、肾纤维化及预后存在显著相关性,靶向PCSK9的药物也在肾脏疾病领域得到应用。

图1 PCSK9调节LDL-C机制及单抗拮抗作用[1]LDL-R:低密度脂蛋白受体;LDL-C:低密度脂蛋白胆固醇;PCSK9:前蛋白转化酶枯草溶菌素9;a、b:游离PCSK9与肝细胞表面LDL-R及胞外LDL-C形成复合物被肝细胞内吞,转运至溶酶体降解,LDL-R不再循环回肝细胞表面,肝细胞表面LDL-R的数量减少;c、d:PCSK9单克隆抗体与游离PCSK9特异性结合,阻止其与肝细胞表面LDL-R结合,LDL-R将LDL-C转运到溶酶体后被循环到肝细胞表面,肝细胞表面LDL-R的数量得以恢复
肾脏疾病时PCSK9的变化及意义
肾病综合征(NS)高胆固醇血症与高三酰甘油血症是NS重要的临床特征,在NS时发生率分别为90%与78%。一项横断面研究在15例NS患者发现,血浆PCSK9浓度较年龄、性别和血清肌酐水平匹配的健康对照组显著升高(15.13±4.99 ng/mLvs9.19±0.60 ng/mL);血浆PCSK9浓度与血清总胆固醇(TC)和低密度脂蛋白胆固醇(LDL-C)水平升高呈显著正相关,而与血清白蛋白水平呈显著负相关[2]。另一项回顾性研究纳入50例NS患者,依据尿蛋白/肌酐比值>1 mg/mg与<0.5 mg/mg分别定义为NS活动期与缓解期,发现NS活动期血浆PCSK9浓度显著高于缓解期(348.0±139.5 ng/mLvs300.5±130.3 ng/mL),缓解期较活动期PCSK9浓度下降率与同期TC、LDL-C浓度下降率呈显著正相关[3]。
糖尿病肾脏疾病(DKD)血糖是影响血浆PCSK9浓度的独立相关因素。对2型糖尿病患者的横断面研究发现,血糖控制较差者血浆PCSK9浓度显著高于血糖控制理想者;校正年龄、性别、血压、吸烟、体质量指数(BMI)、冠心病、LDL-C等因素后,血浆PCSK9浓度与糖化血红蛋白(HbA1c)水平呈显著正相关[4]。PCSK9基因型是否与糖尿病患者进展至DKD的风险相关?国内一项研究共纳入1 228例2型糖尿病患者,其中575例确诊DKD。DKD与非DKD患者间糖尿病病程、LDL-C和HbA1c水平接近。研究者将PCSK9基因3个单核苷酸多态性(SNP)的等位基因分别与临床表型进行关联分析、单位点分析和单倍型表型分析后均未发现PCSK9基因型与DKD的风险存在显著相关性[5]。对134例不同肾功能和尿蛋白水平的DKD患者横断面研究发现,血浆PCSK9浓度与血浆肾素水平、总铁结合力、维生素E水平、尿磷水平均存在相关性,但与估算的肾小球滤过率(eGFR)、尿白蛋白/肌酐比值的相关关系均无统计学意义[6]。
肾功能下降非透析人群国内一项单中心研究纳入未进行调脂治疗的成人体检者2 089例,其中884例体检者eGFR<90 mL/(min·1.73 m2)。该部分人群的血浆PCSK9浓度与eGFR均≥90 mL/(min·1.73 m2)的人员比较无明显差异,校正各项血脂因素后的线性回归也提示血浆PCSK9浓度与eGFR水平无显著相关性[7]。另一项纳入92例慢性肾脏病(CKD)2~4期患者的横断面研究发现,血浆PCSK9浓度与血清三酰甘油、LP[a]、可溶性细胞间黏附分子1水平呈显著正相关,与eGFR水平无相关性[8]。但有研究提示,CKD患者血浆PCSK9浓度与尿蛋白水平之间存在显著相关性[9]。该研究纳入39例CKD患者,基线eGFR为61±29 mL/(min·1.73 m2),尿蛋白定量为1.9(0.9,3.3) g/d,其中19例已服用他汀类药物。患者在接受强化方案(血管紧张素转化酶抑制剂+血管紧张素Ⅱ受体阻滞剂+限盐)治疗6周后,尿蛋白定量降至0.5(0.3,1.1) g/d,eGFR为48±20 mL/(min·1.73 m2)。研究者发现,CKD患者治疗前基线血浆PCSK9浓度较年龄、性别匹配健康者显著升高,血浆PCSK9浓度与尿蛋白/肌酐比值间存在显著相关性,但与eGFR水平无相关性。不过,也有报道认为CKD患者循环PCSK9水平与肾功能存在相关性。如波兰一项横断面研究纳入44例CKD患者,eGFR平均值 20.2±13.1 mL/(min·1.73m2),该研究发现患者血清PCSK9浓度与血清肌酐水平呈显著正相关,而与eGFR呈显著负相关[10]。西班牙肾脏疾病动脉粥样硬化研究(NEFRONA)纳入CKD 3~5D患者209例,发现血清PCSK9浓度也与CKD分期进展呈显著负相关[11]。循环PCSK9水平与肾功能的研究结论的差异推测可能原因为研究对象、干预血脂措施及检测手段等不同。
PCSK9与CKD患者心肾结局的关系是临床关注的问题。新近发表的意大利人群颈动脉内膜病变进展研究(PLIC)显示,不伴颈动脉钙化的CKD患者血浆PCSK9浓度显著高于年龄、性别匹配健康者(306.9±8.8 ng/mLvs214.1±6.6 ng/mL),伴颈动脉钙化的CKD患者血浆PCSK9浓度(339.4±11.9 ng/mL)进一步升高;在尿毒症大鼠模型中证明上调PCSK9能加速动脉血管中层钙化[12]。丹麦一项研究发现,晚期CKD患者血浆PCSK9浓度与随访3.7年期间心血管事件无相关性[13]。罗马尼亚一项随访12月的前瞻性研究纳入CKD 2~4期伴高脂血症患者110例[高脂]血症定义为血清LDL-C>9.88 mmol/L(未治疗)或>5.2 mmol/L(最大剂量他汀治疗)],肾脏结局定义为血清肌酐倍增、eGFR降幅≥30%或肾脏替代治疗。该作者发现,随访期间新发心血管事件或出现肾脏结局患者的血清PCSK9浓度显著高于无心肾事件患者;多因素回归分析提示血清PCSK9浓度>220 ng/mL是新发心血管事件独立预测因子,而PCSK9浓度>220 ng/mL伴高敏C反应蛋白水平>3 mg/L预示心血管事件或肾脏结局时间显著提前[14]。
大样本的前瞻性研究来自德国的两项报道。其一为汉堡CKD患者心-肾结局研究(CARE FOR HOMe)与路德维希港心血管健康风险研究(LURIC);前者纳入443例患者,中位年龄67.7岁,男性占60%,中位eGFR为46.1 mL/(min·1.73 m2),后者纳入1450例患者,中位年龄67.0岁,男性占60%,中位eGFR为74.7 mL/(min·1.73 m2),两组人群均合并一定比例的吸烟、高血压、糖尿病、心血管病史、超重、血脂异常等风险因素暴露,约半数患者接受他汀治疗。该研究发现两个队列患者血浆PCSK9浓度与eGFR水平均无显著相关性;中位分别随访3年与10年,PCSK9浓度差异与心血管事件相关分析均无统计学意义[15]。德国高加索慢性肾脏病研究(GCKD)[16]纳入5 136例患者,平均年龄60岁,男性占60%,平均eGFR为49 mL/(min·1.73m2),合并高血压、糖尿病、心血管病史分别占96%、36%、26%,48%患者接受他汀治疗。该研究发现,血清PCSK9浓度与基线eGFR、尿蛋白定量均无相关性;基线期既往至少有1次心血管病事件患者共1 289例,多因素回归分析提示血清PCSK9浓度每升高100 ng/mL,心血管病事件发作次数越高(OR=1.56, 95%CI 1.44~1.69),且该关联性在未接受他汀治疗患者中更显著。该项目中位随访6.5年,474例患者新发心血管事件。根据血清PCSK9水平将患者进行四分位分组,以PCSK9水平最低四分位患者为参考,第2~4分位患者在校正各项心血管危险因素后新发心血管事件风险分别升高32%~47%不等。亚组分析显示血清PCSK9水平预测新发心血管事件风险的价值仅限于基线期有心血管病患者。PCSK9加入原有模型后对心血管事件发作次数与新发心血管事件风险预测均有不同程度改善,净重新分类指数(NRI)分别为0.27(95%CI 0.20~0.33)与0.10(95%CI 0.008~0.21)。上述两项大型研究对PCSK9与终点事件关系的结论并不一致,分析可能原因包括纳入患者疾病背景存在差异、检测样本分别使用血浆与血清、PCSK9试剂盒分别来自不同国家(美国R&D Systems公司与日本CycLex公司)[17]。
维持性透析患者透析人群循环PCSK9分布特点及相关因素报道不一。丹麦的一项观察性研究纳入151例终末期肾病(ESRD)患者,其中43.7%患者接受维持性透析[腹膜透析(PD)/血液透析(HD)],发现所有ESRD患者血浆PCSK9浓度中位水平为258±16 ng/mL,与性别、年龄匹配非CKD对照组差异无统计学意义[13]。波兰一项横断面研究纳入HD患者29例,发现透析前血清PCSK9浓度显著高于透析后(278.1±66.4 ng/mLvs214.3±59.7 ng/mL),而透析后血清PCSK9浓度与非CKD对照组之间差异无统计学意义[10]。加拿大一项观察性研究纳入66例HD患者,其中接受他汀治疗34例,发现未接受他汀治疗的HD患者血浆PCSK9浓度显著低于非CKD对照组(230.9±101.5 ng/mLvs327.5±131.3 ng/mL),而接受他汀治疗HD患者血浆PCSK9浓度与非CKD对照组差异无统计学意义;未接受他汀治疗HD患者血浆PCSK9浓度与血清TC及LDL-C水平呈显著正相关,但在接受他汀治疗HD患者二者之间无相关性[18]。有关PD患者循环PCSK9浓度的研究报道仍较少。Jin等研究纳入PD患者15例,与年龄、性别匹配的15例健康对照者相比,前者血浆PCSK9浓度显著高于后者(13.30±1.40 ng/mLvs9.19±0.60 ng/mL)。值得注意的是,该研究还发现NS患者与PD患者间、HD患者与健康对照者间血浆PCSK9浓度差异均无统计学意义,但NS患者与PD患者血浆PCSK9浓度显著高于HD患者与健康对照者[2]。
心血管事件是透析患者首要死亡原因。Kajingulu等[19]最新发表的研究显示,循环PCSK9水平是HD患者心血管事件及全因死亡的独立预测因子。该研究纳入207例HD患者,均为非裔,维持性透析至少3月,既往无心血管事件。患者平均年龄55.4岁,男性占73.9%,合并高血压、糖尿病、痛风、吸烟比例分别为87.7%、28.0%、7.7%、15.5%。基线相关性分析显示,血浆PCSK9浓度与血清TC、LDL-C、三酰甘油水平均显著正相关。多因素线性回归提示尿素清除指数(Kt/V)、血清白蛋白、TC、LDL-C、三酰甘油水平均与血浆PCSK9浓度相关,回归方程权重达52%。中位随访4年,47.3%患者发作心血管事件,43.3%患者死亡。死亡患者血浆PCSK9浓度显著高于生存患者,均值分别为28 ng/mL与9.6 ng/mL;以PCSK9水平进行三分位分组,随着PCSK9水平升高,心血管事件发生率由18.8%升至68.1%,统计学显著性分析提示具体事件主要归因为扩张性心肌病,发生率由4.3%升至18.8%。在死亡风险预测上,COX回归模型与竞争风险模型均一致显示PCSK9水平升高、血清白蛋白<35g/L和卒中事件是患者死亡独立风险因素,其中PCSK9水平第三分位患者是第一分位患者全因死亡风险(HR)的5.72倍。
肾脏疾病中PCSK9变化的机制
肾脏疾病状态下PCSK9上调机制尚未完全阐明,现有研究指出可能的环节包括合成增加、活性增强与清除下降[3,20-21]。生理状态下肝脏是循环PCSK9主要来源。早期在嘌呤霉素NS小鼠模型中发现,模型鼠肝脏组织PCSK9 mRNA表达丰度是对照小鼠的1.67倍,且肝脏组织PCSK9丰度值与血清LDL-C水平存在非常显著的正相关(r=0.937,P<0.01)[22]。新近的研究指出,病变肾组织也可能是循环PCSK9重要来源。该研究首先利用共聚焦成像技术显示PCSK9在肾皮质集合管(CCD)与水通道蛋白2共定位;然后,在局灶节段性肾小球硬化(FSGS)患者CCD中发现,PCSK9 mRNA表达丰度较健康移植肾升高近1倍。为证明肾组织PCSK9 mRNA表达上调的意义,作者制作两种FSGS动物模型即Buffalo/Mna小鼠与Rrm2b敲除大鼠,造模成功后均出现血浆PCSK9浓度显著升高,同期肾组织PCSK9 mRNA表达上调而肝组织PCSK9 mRNA表达下调;进一步选择性敲除模型鼠CCD的PCSK9基因后发现模型鼠未再出现高胆固醇血症,而予模型鼠灌胃阿米洛利(与PCSK9在肾小管ENaC位点存在竞争作用)后,模型鼠血浆PCSK9浓度及血清胆固醇水平均持续升高[23]。在另一项动物实验中,选择性敲除小鼠肝脏PCSK9基因后注射异种血清制作NS模型,造模成功后模型鼠血浆PCSK9浓度与肾小管上皮细胞PCSK9 mRNA表达均同步上调3倍,而小肠与脑组织的PCSK9表达均无变化[3]。上述实验有力地证明病变肾组织中PCSK9 mRNA表达上调至少在NS循环PCSK9水平升高及高胆固醇血症方面发挥着重要影响。在肾功能不全模型如单侧肾切除小鼠中发现,肾功能减退不伴循环PCSK9水平升高,但肝脏组织硫酸乙酰肝素-PCSK9间交互作用明显延长,从而影响肝脏摄取和清除脂蛋白能力[24]。
值得注意的是,PCSK9不仅参与调控脂质代谢,也与肾纤维化进程相关。LDLR+/-小鼠喂养高胆固醇饲料后分别予单侧输尿管结扎(UUO模型)或N-硝基-L-精氨酸甲酯(L-NAME)灌胃处理,造模小鼠血清TC、LDL-C和三酰甘油水平以及肾脏脂质含量和间质纤维化程度均较对照小鼠明显升高;但在小鼠造模同时皮下注射抗PCSK9疫苗,上述血清学和肾脏异常改变均能获得显著改善,且证明该作用是通过脂肪酸β-氧化相关因子实现[25]。
调控PCSK9的药物及其在肾脏疾病应用
调控脂质代谢药物,特别是他汀可影响循环PCSK9水平。一项单中心、随机、开放标签临床试验纳入3组健康成年男性,分别给予辛伐他汀(40 mg/d)、依折麦布(10 mg/d)、辛伐他汀+依折麦布(40 mg/d+10 mg/d)连续口服14 d。结果显示,基线3组人群血浆PCSK9浓度接近,14 d后辛伐他汀组、依折麦布组、辛伐他汀+依折麦布组血浆PCSK9浓度较前分别升高68%±85%、10%±38%、67%±91%;多元回归提示他汀治疗是血浆PCSK9浓度改变的独立相关因素[26]。其他药物,如咖啡因、内皮素受体拮抗剂(西他生坦)等也在应用过程中发现具有改善肝脏表达PCSK9或降低循环PCSK9水平的有益作用[27-28]。
以PCSK9为直接靶点的靶向药主要有单抗、siRNA药物、合成抑制剂、环肽和反义寡核苷酸(ASO),其中单抗如依洛尤单抗、阿利西尤单抗已获批进入国内临床应用(表1)。根据美国、欧盟及加拿大等地区血脂管理指南建议,3类人群可考虑PCSK9抑制剂治疗:(1)有明确心血管疾病且血清LDL-C≥100 mg/dL成人患者;糖尿病患者伴心血管疾病或伴CKD或伴靶器官损害且血清LDL-C≥100 mg/dL;(2)不伴心血管疾病的家族性高胆固醇血症,血清LDL-C≥130 mg/dL;(3)具有心血管高危风险成人患者不能耐受他汀且血清LDL-C≥100 mg/dL,或以其他降脂药物治疗血清LDL-C仍持续≥130 mg/dL。上述患者拟行PCSK9抑制剂治疗前应已接受生活方式调整及最大耐受剂量他汀+依折麦布方案。PCSK9单抗在包括CKD患者在内的心血管高危患者中的疗效与安全性已得到国内外众多研究证实[29-33]。但如同他汀,PCSK9单抗长期使用仍需注意对血糖潜在不利影响[34]。新近发表的一项在难治性NS患者中的应用研究引人注目。该研究纳入FSGS患者7例、MN患者5例,年龄59~76岁,尿蛋白定量8.4~12.8 g/d,血清肌酐0.7~1.6 mg/dL。患者均合并缺血性心脑血管病,前期均接受大剂量他汀或联合依折麦布至少6月治疗。基线血浆PCSK9浓度与血清LDL-C水平呈显著正相关。加用PCSK9单抗治疗4周后,患者血清TC(9.5±1 mmol/Lvs6.3±0.6 mmol/L)和LDL-C(6.4±0.5 mmol/Lvs4.3±0.5 mmol/L)较前均显著下降。6月后随访,血浆PCSK9浓度较基线水平下降42.3%±12.6%,上述血脂状态仍保持稳定,所有患者治疗过程中均无不良反应[35]。
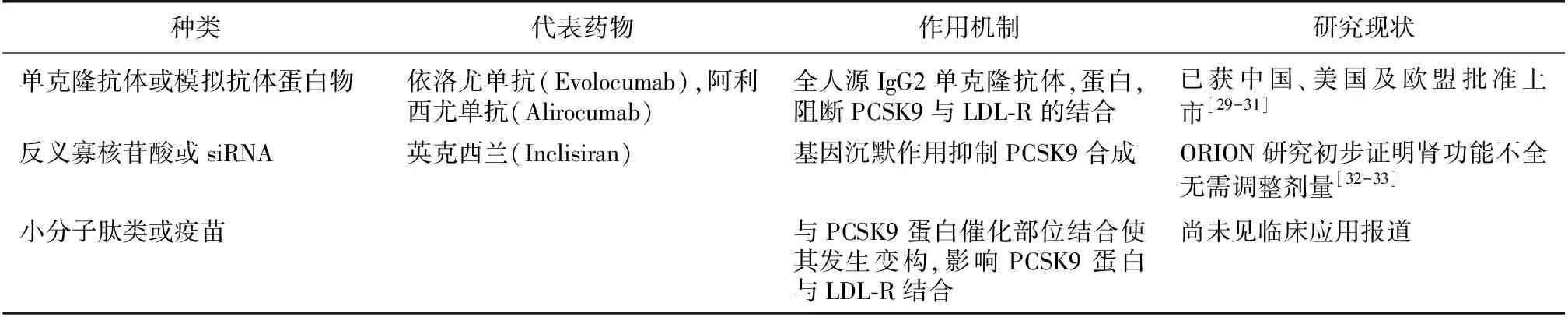
表1 靶向PCSK9抑制剂研究现状
小结:PCSK9是调节脂质代谢关键分子。在多种肾脏疾病包括NS、DKD、非透析CKD和透析患者的临床研究中发现,PCSK9与患者血脂水平、心血管事件风险、肾功能进展有不同程度联系。未来在他汀等一线药物治疗基础上,对伴选择性的CKD患者应用PCSK9抑制剂有望改善预后。

