两种培养条件下重组杆状病毒表达蓝舌病病毒VP7 蛋白的丰度研究
陈朝林,韩佃刚,杨云庆,张 冲,李 静,罗倩敏,尹尚莲,董仙兰,李凌枫,师亚玲,艾 军,信吉阁
(1.云南农业大学动物医学院,昆明 650201;2.中华人民共和国昆明海关,昆明 650228)
蓝舌病(Bluetongue,BT)是由呼肠孤科(Reoviridae)环状病毒属(Obivirus)蓝舌病病毒(Bluetongue virus,BTV)引起的[1],经由库朦属吸血昆虫叮咬传播反刍动物、骆驼科动物的病毒性疫病,是世界动物卫生组织(OIE)规定的必须通报的动物疫病[2]。BTV 基因组由10 个双链RNA 组成,包括大片段(L1-L3)、中片段(M4-M6)和小片段(S7-S10),共编码7 个结构蛋白(VP1-VP7)和4 种非结构蛋白(NS1、NS2、NS3、NS3a 和NS4)[3]。VP7 是由S7 基因编码的主要结构蛋白,由349 个氨基酸组成,位于病毒核衣壳的表面,呈三聚体结构,约占核心蛋白总量的36%,是BTV 群特异性抗原蛋白之一,不同血清型之间的VP7 蛋白的同源性高达94%,通过对不同血清型VP7 蛋白的氨基酸序列比对得出,30~48 位氨基酸残基的序列同源性为100%,证明VP7 蛋白为高度保守的蛋白,具有群特异性,是BTV 抗体检测的理想抗原[4-7]。VP7 蛋白是血清群特异性的主要决定因素,大多数检测BTV 的血清学检测方法都是基于检测抗VP7 抗体[8]。
昆虫细胞表达系统是将外源目的基因插入杆状病毒载体中,转染入昆虫细胞中对单个蛋白或者蛋白复合体进行高量表达的真核表达系统[9]。昆虫杆状病毒表达系统表达出的重组蛋白具有完整的生物学活性,适合生产和研发治疗性抗体。目前已经利用High Five 细胞、Sf9 细胞成功表达出商业化的人抗gp41 抗体3D6[10]。
课题组前期开发出基于昆虫重组杆状病毒表达BTV VP7 蛋白的蓝舌病ELISA 抗体检测试剂盒。为了优化试剂盒生产工艺,进一步获得高表达量的BTV VP7 蛋白,本研究开展了贴壁培养和摇瓶悬浮培养对昆虫细胞中BTV VP7 蛋白表达量影响的研究。
1 材料与方法
1.1 试验材料
Sf9 昆虫细胞、表达BTV VP7 蛋白的重组杆状病毒Vbacmin-BTV-VP7、蓝舌病B-ELISA 抗体检测试剂盒(内含HRP 标记的BTV VP7 单克隆抗体、ELISA板、pH 9.6 碳 酸 盐 包 被 液、TMB 显 色 液、1 mol/L H2SO4终止液、PBST 洗液)由昆明海关技术中心动物检测实验室提供;胎牛血清购自Biological Industries(BI)公司;Grace’s培养基购自Gibco 公司。
1.2 细胞培养
Sf9 细胞用含10%胎牛血清的Grace’s 培养基在27 ℃的培养箱中培养。
1.3 细胞感染重组杆状病毒Vbacmin-BTV-VP7
1)待细胞长满75 cm2细胞培养瓶后,将2 瓶细胞换液,每瓶加入20 mL Grace’s 培养基,将细胞吹打下来,混合到一起,细胞计数得7.7×105CFU/mL。
2)将40 mL 含细胞的培养液平均分到1 个175 cm2细胞培养瓶和1 个500 mL 摇瓶中,各加入8 mL含有重组杆状病毒Vbacmin-BTV-VP7 的种子病毒贮存液,然后用含有2%胎牛血清的Grace’s 培养基调节总体积至每瓶80 mL。175 cm2细胞培养瓶放入27 ℃培养箱贴壁培养,摇瓶放入27 ℃摇床中悬浮培养,转速为60 r/min。培养5 d。
1.4 Sf9 细胞形态观察及BTV VP7 蛋白表达量测定
培养第一至第五天,每天分别用显微镜观察并拍照记录两种培养条件下Sf9 细胞的形态变化,无菌条件下分别从细胞培养瓶和摇瓶中吸取500 μL细胞培养基,装于1.5 mL 的离心管中,用间接ELISA方法检测BTV VP7 蛋白表达量。简述如下:取不同方式培养的病毒液,用pH 9.6 碳酸盐包被液1∶10 稀释,每孔100 μL 包被ELISA 板,37 ℃作用1 h,洗板3次,将洗涤液拍干。每孔加100 μL 固定浓度HRP 标记的BTV VP7 单克隆抗体,37 ℃作用1 h,洗板3 次,将洗涤液拍干,TMB 显色,1 mol/L H2SO4终止显色,读取450 nm 吸光度值(OD450nm)。根据OD450nm判定表达蛋白的含量,OD450nm大小与表达蛋白含量成正比,OD450nm越高间接反映蛋白表达量越高。
1.5 数据分析
试验数据用SPSS 软件进行统计分析,结果以平均数±标准差(x±s)表示。用Excel软件制作折线图。
2 结果与分析
2.1 细胞形态变化
由图1 和图2 可见,昆虫细胞在转染病毒的第一天,细胞形态为大小均匀的圆形,细胞透亮,折光性好,细胞数量较多。贴壁培养和摇瓶悬浮培养的细胞随着BTV VP7 蛋白在细胞内的增殖,细胞形态开始逐渐变化,一些细胞变大,出现细胞大小不均匀、细胞折光性变差的现象。第四天,细胞数量开始明显减少,显微镜下可见具有完整细胞形态的细胞数量变少,出现很多细胞碎片。第五天,贴壁培养和摇瓶培养的瓶内只存在极少数的圆形细胞,其他均为非细胞形态的碎片。
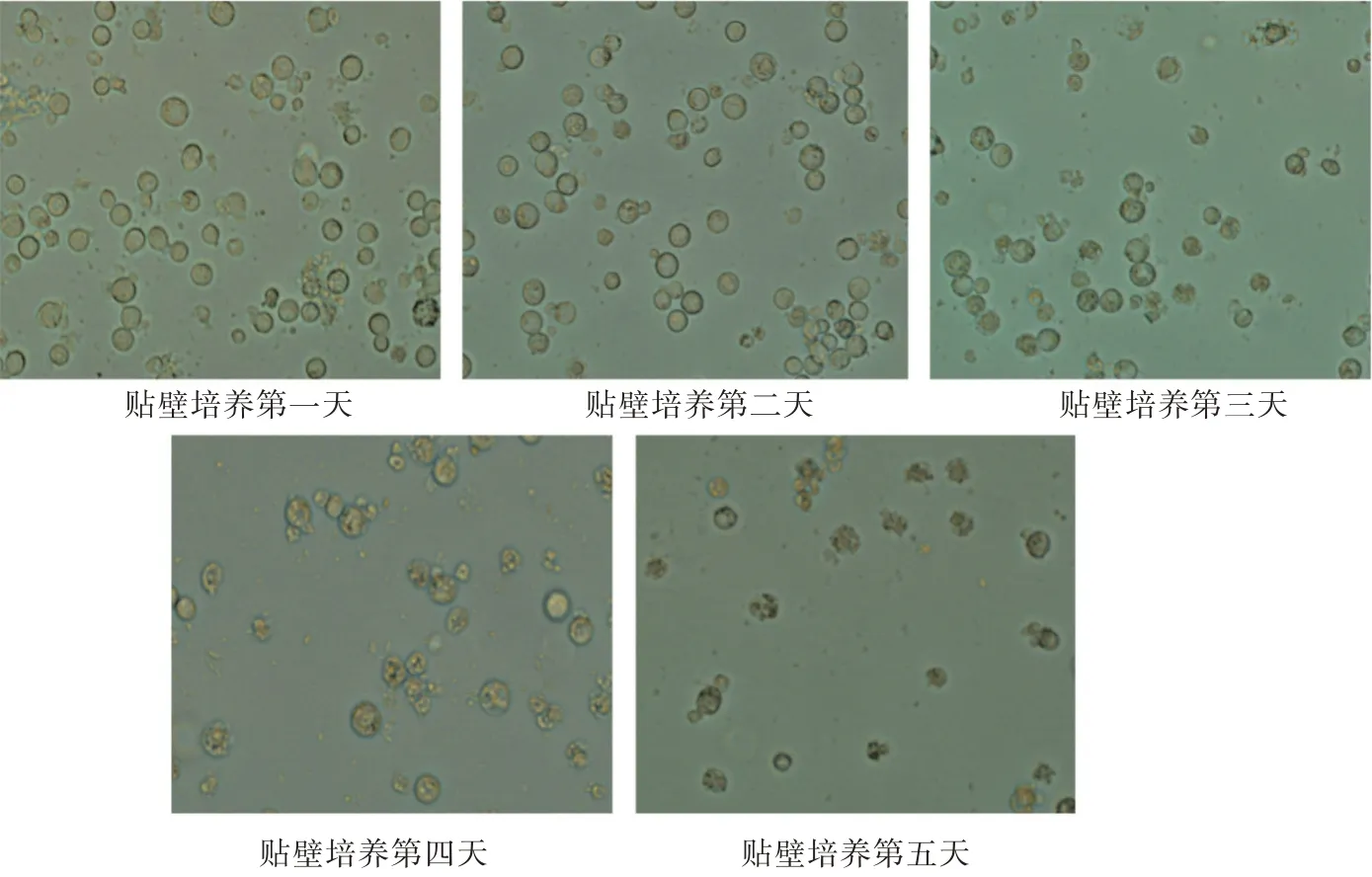
图2 贴壁培养第一至第五天昆虫细胞形态对比(显微镜倍数20 倍)
2.2 BTV VP7 蛋白表达量测定
表1 为记录第一天到第五天从细胞摇瓶中吸取的样品测得的吸光度值。运用SPSS 软件进行数据分析可知,初始浓度与第一、二天相比,差异显著(P<0.05);第三天与第一、二、四、五天相比,差异显著(P<0.05);第二、四、五天之间相比,差异不显著(P>0.05)。
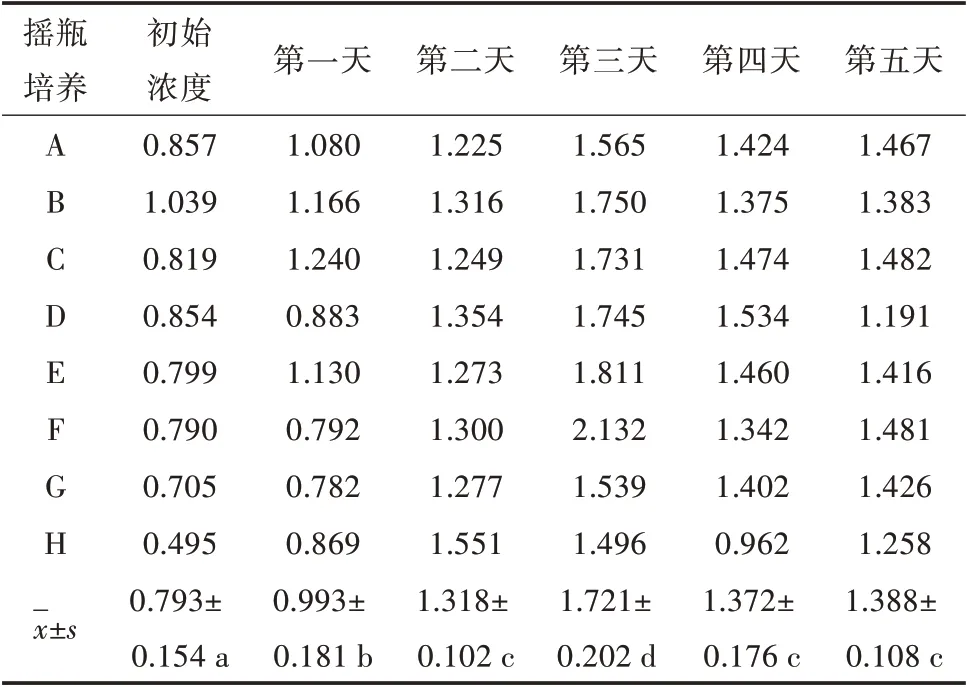
表1 摇瓶培养重组杆状病毒不同时间点BTV VP7蛋白含量(OD450 nm)
表2 为记录第一天到第五天从贴壁培养瓶中吸取的样品测得的吸光度值。第一、二、四、五天与初始浓度相比差异显著(P<0.05),第一、二、四、五天之间差异不显著(P>0.05),第三天和其他天数相比差异均显著(P<0.05)。

表2 贴壁培养重组杆状病毒不同时间点BTV VP7蛋白含量(OD450 nm)
BTV VP7 蛋白表达量动态折线图见图3。由图3 可知,BTV VP7 蛋白表达量从第一天到第三天处于增长期,从第二天到第三天BTV VP7 蛋白表达量显著上升,从第三天到第四天BTV VP7 蛋白表达量下降迅速,第四天到第五天蛋白表达量变化微小。培养至第三天时贴壁培养的昆虫细胞中BTV VP7蛋白表达量明显高于摇瓶培养的蛋白表达量。

图3 BTV VP7 蛋白表达量动态
3 小结与讨论
BTV VP7 蛋白在贴壁培养的昆虫细胞中的表达量高于摇瓶培养,且培养到第三天时BTV VP7 蛋白表达量最高。
蓝舌病是一种严重危害绵羊养殖业健康可持续发展的疫病。绵羊不分品种、性别和年龄都对蓝舌病毒易感。病毒感染对羔羊的影响尤为明显,如生长发育迟滞,甚至引起死亡;母羊感染会导致胎儿畸形等严重后果[11]。2019 年,有学者从污染疫苗批次中分离出一株新BTV 毒株,经鉴定为血清28 型蓝舌病病毒[12]。同年在很多国家和地区发生血清3 型蓝舌病、血清4 型蓝舌病、血清8 型蓝舌病,总受影响动物14 万只,感染动物2 800 只,死亡300 只。蓝舌病病毒抵抗力较强,具有多个血清型,且各型之间交叉免疫性差,故只有制成多价疫苗,才能获得可靠的保护作用[13]。为了控制BTV 的传播,将经济损失降到最低,开展蓝舌病疫苗研究、血清抗体监测是一项非常重要的工作。
ELISA 是最常用的血清学检测方法,20 世纪80年代国外已先后报道了BTV间接ELISA、阻断ELISA、竞争性ELISA 检测方法的建立[14]。本研究将重组杆状病毒在昆虫细胞上产生的BTV VP7 蛋白包被到ELISA 板上,利用固定浓度HRP 标记BTV VP7 单抗,采用间接ELISA 法评估BTV VP7 蛋白的表达量。结果表明,昆虫细胞在贴壁培养和摇瓶培养两种培养条件下均在第三天时BTV VP7 蛋白表达量最高。从细胞形态变化可以看出第四到五天细胞数量明显减少,细胞碎片增加。BTV VP7 在第一天到第二天侵染细胞、增殖、分泌蛋白,第三天细胞破碎,释放出大量蛋白,因此第三天的蛋白表达量明显增多,而第四天和第五天,由于大部分细胞已破碎,BTV VP7 蛋白表达量不再继续升高。此外,BTV VP7 蛋白表达量下降,可能是由于某些原因导致BTV VP7 蛋白降解所致,具体降解原因有待进一步研究。贴壁培养的昆虫细胞中BTV VP7 蛋白表达量更高,可能是由于贴壁培养单位体积提供细胞生长的表面积大,细胞密度更高,而摇瓶培养单位体积提供细胞生长的表面积小,细胞生长密度低。本试验结果可为优化昆虫细胞中表达BTV VP7 蛋白的培养条件提供参考。

