自然增温对南亚热带森林土壤微生物群落与有机碳代谢功能基因的影响
胡明慧,赵建琪,王 玄,熊 鑫,张慧玲,褚国伟,孟 泽,张德强,*
1 中国科学院华南植物园, 广州 510650 2 普洱学院, 普洱 665000 3 中国科学院大学, 北京 100049
自工业革命以来,大气二氧化碳(CO2)浓度不断攀升,随之引起的全球变暖也已经成为不争的事实[1]。IPCC报告指出,目前全球气温较工业革命前已经增加了1℃,预计在2030—2052年间全球气温将升高1.5℃[2]。反过来,气温上升又加速了土壤碳的排放[3]。土壤作为陆地生态系统最大的碳库,其碳储量超过了植被和大气碳库的总和,土壤碳库的细微变化足以引起大气中温室气体浓度的巨大波动[4]。因此,准确理解土壤碳循环过程对增温的响应与适应机制,对合理预测未来全球变化背景下全球碳平衡格局的动态变化具有重要意义。
大量的研究表明,模拟增温往往能提高土壤的呼吸速率,但其增加幅度因生态系统类型、增温方式和幅度、增温季节以及持续时间的不同而存在巨大差异[5]。也有研究指出,虽然增温可以在短期内刺激土壤碳的排放,但随着时间的延长这种促进作用会慢慢减弱,表现出一定的适应性[6];但对这种适应性的解释,目前尚未达成共识[7]。根据热动力学原理,化学结构不同的土壤有机碳各组分对温度的敏感性也不同[8]。一般认为惰性组分较活性组分更难分解,对增温的响应也更敏感[9—10]。然而,越来越多的证据显示,土壤有机碳对增温的敏感性不仅仅取决于其化学组成,矿物颗粒的物理化学保护、微生物的生理特性和群落组成可能发挥着更为重要的作用[11—12]。Allison等[13]认为土壤碳循环过程对增温的响应主要依赖于土壤微生物的组成和活性,并提出在对气候变化过程进行预测时必须考虑土壤微生物的反馈作用。
土壤微生物以土壤有机碳为主要碳源进行物质代谢,并通过分泌酶参与土壤有机碳的解吸附、解聚、溶解等分解过程[11]。增温可以通过影响土壤微生物的生理功能,甚至改变微生物群落组成,从而刺激或抑制土壤碳的排放[14]。目前,关于增温背景下土壤微生物在土壤碳循环过程中的作用已有大量研究。Zhang等[15]研究发现,增温3年后土壤微生物生物量并没有显著变化,但真菌在群落中所占的比例较细菌有明显提高,降低了土壤碳的排放(真菌的碳同化率较细菌更高)。但Frey等[16]在美国哈佛森林的增温实验结果表明,长期增温(12年)后土壤微生物中真菌的丰度降低了。也有研究发现气温上升提高了真菌的活性,增强了微生物对土壤有机碳的分解代谢[17]。Bokhorst等[18]则发现增温导致的土壤湿度降低抑制了土壤微生物的活性,从而减弱了微生物对土壤有机碳的代谢作用。另外,其他的一些研究指出,增温对土壤微生物群落几乎没有影响[19—20]。显然,因气候条件、植被类型、土壤性质等的不同,不同研究中土壤微生物对增温的响应与适应机制存在着差异。
受实验条件的限制,目前大部分的模拟增温实验都是在室内开展的,其研究结果能否适用于野外自然状况还难以定论。为数不多的野外研究也多集中于温带地区。与温带相比,热带和亚热带地区温度的变化幅度较小,适合生物生存的阈值区间也相对较窄,其生态系统的结构和功能可能更容易受到气候变化(特别是温度变化)的影响[21]。因此,我们选择在南亚热带地区的鼎湖山森林,将模拟的生态系统(含植物和土壤)从高海拔整体移位至低海拔地区形成自然增温的效果。借助磷脂脂肪酸法(PLFAs)和宏基因组测序等手段,探究土壤微生物对增温的响应与适应机制,研究结果将有助于合理预测全球变暖背景下南亚热带森林土壤碳库的动态变化。
1 材料与方法
1.1 试验地概况
研究样地位于鼎湖山国家级自然保护区。保护区地属广东省肇庆市鼎湖区(23°09′N—23°11′N, 112°30′E—112°33′E),面积约1133 hm2。全年平均气温为20.9℃,最高气温达到38℃,最低气温为-0.2℃,年降雨量1927 mm,4—9月为主要降雨季节,降雨量约占全年的80%,干季(10—次年3月)降雨量占全年降雨量的20%。年平均蒸发量1115 mm,年平均相对湿度80.3%。鼎湖山自然保护区属于低山丘陵地貌,构造线呈西南—东北走向,最高峰“鸡笼山”海拔达到1000.3 m,坡度平均为30°—45°[22]。
不同海拔引起小气候的变化,使得不同海拔梯度上的森林类型不同。海拔梯度自下而上分布主要森林类型分别有季风常绿阔叶林、针阔叶混交林和山地常绿阔叶林。季风常绿阔叶林优势物种为木荷(Schimasuperba)、红枝蒲桃(Syzygiumrehderianum)、短序润楠(Machilusbreviflora)、红锥(Castanopsishystrix)、海南红豆(Ormosiapinnata)、九节(Psychotriaasiatica); 针阔叶混交林优势物种为木荷(Schimasuperba)、红枝蒲桃(Syzygiumrehderianum)、短序润楠(Machilusbreviflora)、马尾松(Pinusmassoniana)、红锥(Castanopsishystrix)、山血丹(Ardisialindleyana);山地常绿阔叶林优势物种为木荷(Schimasuperba)、红枝蒲桃(Syzygiumrehderianum)、短序润楠(Machilusbreviflora)、鼠刺(Iteachinensis)、密花树(Myrsineseguinii)、山血丹(Ardisialindleyana)等[23]。
1.2 实验设计
1.2.1样地设置
增温样地建于2013年,在海拔600 m的山地常绿阔叶林和海拔30 m的季风常绿阔叶林,选择空旷地带,分别建造3个开顶箱(open-top chamber, OTC)。每个OTC方形坑长3 m、宽3 m、内径深0.8 m,地下部分周围用砖头砌墙,墙高于地面0.2 m,以防止水和周围土壤元素的横向和垂直移动。OTC的顶部和底部各有一个出水孔,用来收集地表径流的土壤渗透水。待修建完成,往OTC方形坑内填入土壤。土壤按照对应的层次(0—20、20—40、40—70 cm)收集,每个OTC方形坑内土壤量为6.3 m3。6个OTC内土壤均采自于山地常绿阔叶林的山地黄壤,所有土壤均按照对应的层次填埋于坑内。在海拔600 m的山地常绿阔叶林内选取年龄、基茎和树高一致的优势树种苗木,在林内统一位置进行驯化后,移植到6个OTC内[22]。
本实验通过降低海拔梯度来模拟增温。共设置两组OTC (OTC1、OTC2),每组设置3个重复。设置在海拔600 m的OTC1为对照样地,设置在海拔30 m的OTC2为增温样地(3.0±1.0)℃。每个OTC样地内种植植物包括木荷(Schimasuperba)、红枝蒲桃(Syzygiumrehderianum)、短序润楠(Machilusbreviflora)、鼠刺(Iteachinensis)、密花树(Myrsineseguinii)、山血丹(Ardisialindleyana)[23]。
1.2.2样品采集
分别于2017年12月(干季)和2018年6月(湿季)在上述OTC样地进行两次土壤样品的采集。采用五点混合取样法,每次采样时选取较为分散的5个点混合成一个样品,取样前去除表层土壤的腐殖质、凋落物等杂质,每个OTC用内径5 cm的土钻取表层土0—10 cm,每个OTC采集3个土壤样品。采集的土壤样品立即放入装有干冰的保温箱保存,尽快带回实验室进行分析处理。挑除土壤中肉眼可见的根系和石砾后过2 mm筛。随后将土壤样品分为三份,一份放置阴凉处风干用于测定土壤基本理化性质;一份放置于冰箱内4℃保存,用于土壤微生物生物量以及群落结构组成的测定;一份放置于冰箱内-80℃保存,用于后续宏基因组测定(将同一海拔梯度的3个OTC样地样品混合成一份样品用于宏基因组测序)。
1.3 样品测定
1.3.1土壤理化性质
土壤温、湿度数据来自OTC样地观测设备的温、湿度传感器(传感器每隔一小时记录一次土壤温、湿度)。采用重铬酸钾氧化-硫酸亚铁滴定法测定土壤有机碳;半微量凯氏定氮法测定土壤全氮,采用氢氟酸—高氯酸消煮—钼锑抗比色法测定土壤全磷;土壤pH值的测定采用电极电位法,水土比为2.5:1;土壤硝态氮的测定采用紫外分光光度法;土壤铵态氮的测定采用靛酚蓝比色法。上述理化性质的测定方法参照鲁如坤[24]和鲍士旦[25]。
1.3.2土壤微生物群落组成测定
采用磷脂脂肪酸法(PLFAs)测定土壤不同种群微生物量,实验步骤参照Bossio和Scow[26]的基础上稍作改进。称取8 g冻干土壤于35 mL离心管中,向离心管中加入5 mL磷酸缓冲液、6 mL三氯甲烷、12 mL甲醇震荡提取后离心,离心液加入12 mL三氯甲烷和12 mL磷酸缓冲液后静置过夜,在30—32℃水浴中N2吹干后,用SEP柱分离纯化,收集过柱的脂肪酸于试管内,在32℃水浴中N2浓缩后加入内标的正己烷溶解,最后用气相色谱仪测定、结合MIDI软件系统鉴定分析。微生物脂肪酸的浓度基于单个样品中的碳内标19:0的浓度计算。用14:0 iso、14:0 anteiso、15:0 iso、15:0 anteiso、16:0 iso、17:0 iso、17:0 anteiso、18:0 iso表征革兰氏阳性菌;用16:1 ω7c、17:1 ω8c、17:0 cyclo、17:1 ω7c 10-methyl、18:1 ω7c表征革兰氏阴性菌;革兰氏阳性菌和革兰氏阴性菌丰度之和表征细菌;16:1 ω5c、18:3 ω3c、18:2 ω6c、18:1 ω9c表征真菌;16:1 ω5c、18:2 w6c表征丛枝菌根真菌;16:0 10-methyl、17:0 10-methyl、18:0 10-methyl表征放线菌[27]。
1.3.3宏基因组测序分析
使用PowerSoil DNA Isolation Kit(MoBio Laboratories, Carlsbad, CA)试剂盒,提取土壤样品中的基因组DNA。Qubit对DNA浓度进行精确定量后,采用1%琼脂糖凝胶电泳,检测样品DNA质量。检测合格的DNA样品用Covaris S220超声波破碎仪将基因组 DNA 随机打断成300 bp左右的小片段,使用Agencourt AMPure XP试剂盒纯化打断产物。将纯化后的打断产物使用NEBNext Ultra II DNA Library Prep Kit试剂盒进行文库构建,具体步骤及试剂参考试剂盒说明书。文库构建完成后,先使用Qubit2.0进行初步定量,稀释文库至2 ng/ul。随后使用Agilent 2100对文库的插入片段进行检测,插入片段符合预期后,使用qPCR方法对文库的有效浓度进行准确定量(文库有效浓度>3 nM),以保证文库质量。质检合格的文库在Illumina HiSeq4000平台测序。
1.4 数据分析
采用配对样本t检验来分析增温对土壤温度和湿度的影响;采用单因素方差分析法,检验温度升高对干湿季土壤基本理化因子以及微生物生物量的影响。微生物群落结构响应温度升高的变化用主成分分析(PCA)检验。显著性水平设为P<0.05。运用软件Excel 2016,SPSS 21.0,Sigmaplot 14.0,R 3.6.3对上述数据进行分析及作图处理。
宏基因组数据的处理,使用fastp(v0.20.0)软件对序列(reads) 3′端和5′端的接头(adapter)序列进行质量剪切,保留高质量的双端序列(pair-end reads)和单端序列(single-end reads)。所得优化序列用拼接软件MEGAHIT(1.1.2)进行拼接组装,过滤结果中300 bp以下的片段。使用MetaGene对拼接结果中的序列重叠群(contigs)进行开放阅读框(ORF)预测,用CD-HIT(v4.6.1)对所有预测的基因序列进行聚类并构建非冗余基因集。使用SOAPaligner(v2.21)将测序数据与非冗余基因集进行比对,统计基因在对应样品中的丰度信息。使用Diamond(v0.8.35)将预测得到的非冗余基因集与KEGG数据库进行比对,采用Pathway对应的碳水化合物代谢(Carbohydrate metabolism)计算土壤有机碳代谢基因丰度;采用EC对应的基因丰度总和计算淀粉酶(Amylase)、纤维素酶(Cellulase)、半纤维素酶(Hemicellulase)、几丁质酶(Chitinase)的基因丰度。
2 结果
2.1 土壤温湿度对增温的响应
增温处理显著改变了土壤温湿度,旱季增温效果更明显。图1可见,2016—2018年间,增温处理下,土壤月平均温度在0—10 cm土层增加2.48℃,增温效果显著(P<0.01);土壤湿度在0—10 cm土层下降23.93%,增温处理对土壤湿度影响显著(P<0.01)。其中,在2017年10月至2018年3月(干季),增温处理使0—10 cm土层土壤温度上升2.81℃ (P<0.05),土壤湿度下降29.31% (P<0.01);2018年4—9月(湿季),增温处理使0—10 cm土层土壤温度上升2.24℃ (P<0.05),土壤湿度下降27.74% (P<0.01)。采样当月(12月)增温处理使0—10 cm土层土壤温度上升4.12℃ (P<0.01),湿度下降36.15% (P<0.01);6月增温处理使0—10 cm土层土壤温度上升1.47℃ (P<0.05),土壤湿度下降19.52% (P<0.05)。

图1 对照组和增温组0—10cm的月平均温度和湿度Fig.1 Monthly mean temperature and moisture of the control and the warming treatment in the dry and wet season (from January 2016 to November 2018)
2.2 土壤理化性质对增温的响应


表1 增温对干湿季土壤理化性质的影响
2.3 不同种群微生物生物量对增温的响应
图2可见,增温对干湿季土壤总PLFAs、Bacteria、Fungi、Act、AMF、G+/G-的影响不显著。干季总PLFAs、Bacteria、Act、AMF、G+/G-的绝对丰度随温度升高略有下降,Fungi的绝对丰度随温度增高略有上升,湿季土壤总PLFAs、Bacteria、Fungi、Act、AMF的绝对丰度随温度升高而上升,G+/G-随温度升高而下降。

图2 增温对干湿季微生物磷脂脂肪酸含量影响Fig.2 Effects of warming on microbial phospholipid fatty acids (PLFAs) content in the dry and wet seasons
如图3可见,在干季和湿季中,细菌相对丰度降低,真菌相对丰度上升,真菌细菌比值(Fungi/Bacteria)增加,且细菌、真菌、真菌细菌比值在湿季中变化显著。

图3 增温对干湿季微生物相对丰度影响Fig.3 Effects of warming on microbial relative abundance in the dry and wet seasons
由图4可见,在干季时,主成分轴分别解释了群落结构变异的74.2%和18.5%,总解释度为92.7%,增温和对照组差异不显著(P>0.05)。在湿季时,主成分轴分别解释了群落结构变异的68.8%和27.2%,总解释度为96%,增温和对照组差异显著(P<0.05)。
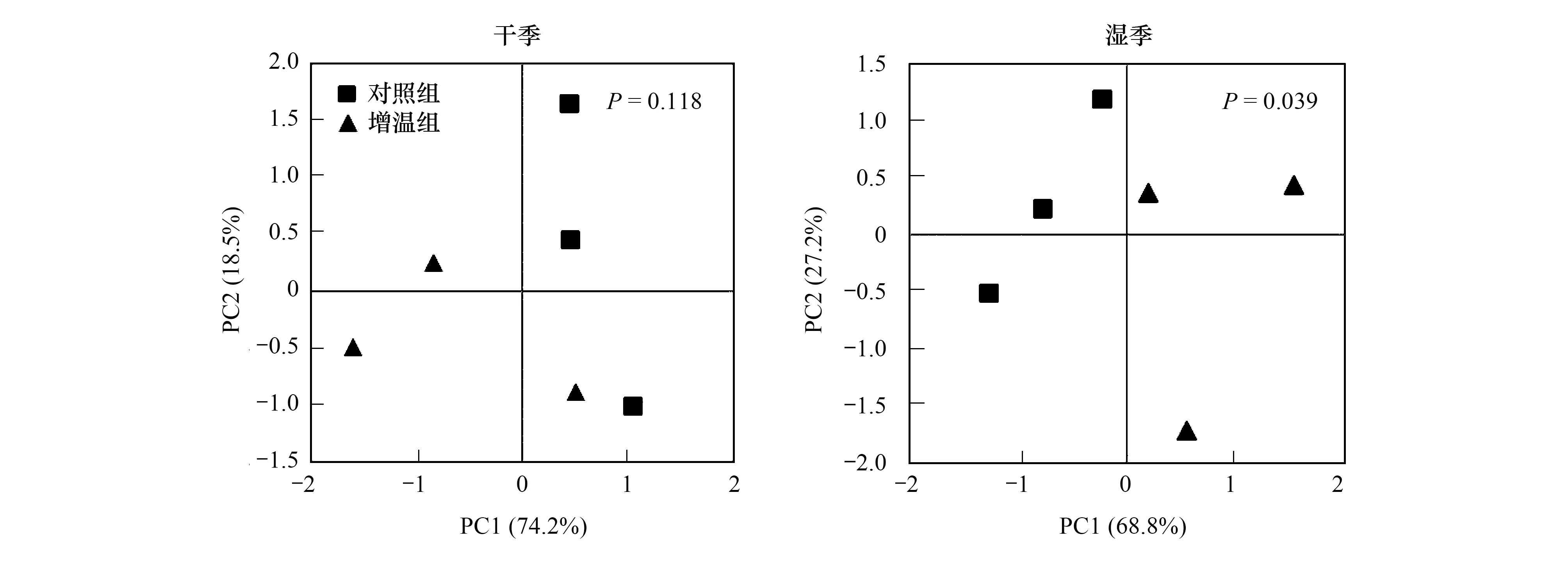
图4 干湿季土壤微生物群落结构的主成分分析Fig.4 Principal component analysis of soil microbial community structure in the dry and wet seasons
RDA分析结果表明(图5),土壤湿度为影响干季和湿季土壤微生物群落结构的主要因素。在干季中,第1轴和第2轴分别解释土壤微生物群落结构变化的91.3%和6.3%,土壤湿度能解释群落结构变异的度为50.2%(P>0.05);湿季中,第1轴和第2轴分别解释土壤微生物群落结构变化的92.5%和6.5%,土壤温度能解释群落结构变异的度为79.2%(P<0.05)。
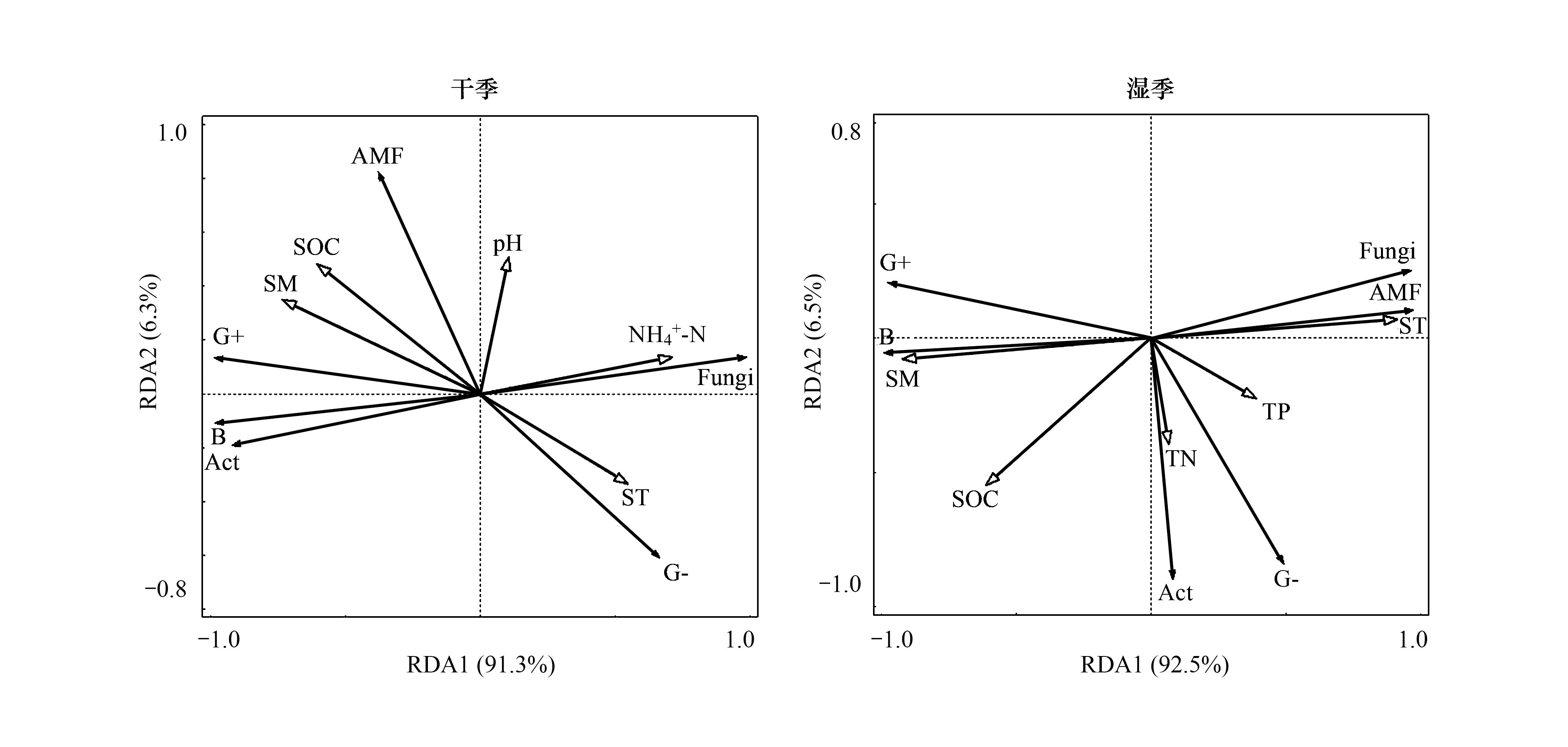
图5 干湿季微生物PLFAs数据与环境因子RDA分析Fig.5 Redundancy analysis of PLFAs of soil microbial and environmental parametersin the dry and wet seasonsB:细菌 Bacteria;Fungi:真菌;G+:革兰氏阳性菌 Gram-positive bacterial;G-:革兰氏阴性菌 Gram-negative bacterial;ACT:放线菌 Actinomycetes;AMF:丛枝菌根真菌 Arbuscular mycorrhizal fungi;ST:土壤温度 Soil temperature;SM:土壤湿度 Soil moisture;SOC:土壤有机碳 Soil organic carbon;TN:土壤全氮 Total soil nitrogen;TP:土壤全磷 Total soil 铵态氮 Ammonium 硝态氮 Nitrate nitrogen
2.4 增温对碳代谢功能基因的影响
土壤碳循环功能基因分析结果表明(图6),在干季和湿季中,增温处理下淀粉酶、纤维素酶、半纤维素酶、几丁质酶基因丰度高于对照组。干季中增温处理使土壤总有机碳代谢基因丰度略有降低,湿季中增温处理使土壤总有机碳代谢基因丰度上升。在干季中,与对照组相比,增温处理下淀粉酶、纤维素酶、半纤维素酶、几丁质酶基因丰度分别上升了3.18%、8.78%、8.99%、12.84%,总有机碳代谢基因丰度下降了0.14%。在湿季中,增温处理使土壤淀粉酶、纤维素酶、半纤维素酶、几丁质酶基因丰度增加,与对照组相比,增温处理下淀粉酶、纤维素酶、半纤维素酶、几丁质酶等基因丰度分别上升了9.64%、7.04%、3.51%、0.52%,土壤总有机碳代谢基因丰度上升了9.92%。在干季和湿季中,纤维素酶基因丰度占总有机碳代谢基因丰度比例最高,分别为1.35%和1.47%。

图6 增温对干湿季土壤有机碳代谢功能基因绝对丰度影响Fig.6 Effects of warming on absolute abundance soil carbon metabolism function genes in dry and wet seasons纵坐标表示基因注释到ko (直系同源蛋白)的数目
3 讨论
3.1 增温对土壤不同种群微生物量的影响
本实验中,干季增温抑制了细菌的生长,促进了真菌的生长,RDA分析结果显示这种变化与土壤湿度有关。本实验干季增温使土壤含水量显著下降了24.99%,采样当月(12月)更是下降了36.15% (图1),显然,干季增温加剧了土壤水分的限制,影响了细菌的生长,Sowerby等研究了横跨南北欧的四种欧石楠丛生的生态系统土壤微生物和酶活性,结果表明干旱(水分限制)和气温上升降低了土壤微生物活性[28]。与细菌相比,真菌对温度升高引起的水分胁迫有更强的抵抗力[15],而含水量的降低使土壤通透性增加,有利于更依赖氧气生长的真菌[29],由于它们的丝状性质,对较高的土壤温度更有耐受性[30],这在本实验增温条件下土壤真菌生物量增加这一结果得到验证。尽管增温提高了真菌生物量,但其在土壤微生物占比较低,最终导致干季增温降低了土壤微生物总PLFAs。
湿季增温促进了土壤几乎所有微生物的生长(图2),微生物群落内真菌/细菌比值显著增加,RDA分析结果显示这种变化与土壤温度和湿度有关。本实验湿季对照处理OTC样地土壤(10 cm)平均温度约23.62℃,平均含水量约20.50% (图1),是微生物极为适宜的生长环境,增温促进了微生物的生长,这与许多研究结果相一致[15,31]。湿季增温虽然使土壤含水量显著下降了27.74%,但仍保持有15%的含水量(图1),显然,在这样的水分含量条件,温度增加对土壤微生物的影响远大于水分含量的下降(图5)。在本实验中,无论是在增温条件下还是对照样地,土壤微生物生物量均是旱季高于湿季(图2),这与植物生长对养分的需求密切相关。有研究表明,温度升高可能通过促进作物生长而加剧根系与微生物之间的养分竞争,利于作物对养分的吸收,导致土壤中微生物生活所需的养分匮乏,进而限制微生物的生长[32]。本实验地的湿季(4—9月)正是植物生长最旺盛的季节,对养分需求更大,加剧了植物根系生长与微生物对养分需求的竞争。本实验前期研究也表明,增温显著增加了土壤自养呼吸(根呼吸)对土壤总呼吸的贡献率,而且湿季显著高于旱季[33],这一结论用本实验的结果得到了合理的解释。也有研究结果表明增温使真菌与细菌PLFAs比值降低[34],或无明显变化[35],说明土壤微生物对增温的响应规律存在不确定性,仍有待更多的实验研究加以揭示。
3.2 增温对土壤碳代谢基因影响
已有研究表明土壤胞外酶活性可由微生物相关功能基因丰度得到反映[36]。本实验结果显示干季和湿季土壤中纤维素酶基因丰度随温度升高而上升,这说明增温提升了土壤纤维素酶活性,这是因为土壤真菌丰度的增加,促进了纤维素酶分泌,加速了土壤难降解有机质的分解。Feng等[37]在美国俄克拉荷马州中部进行的12年增温实验表明,增温显著增加了土壤纤维素降解的微生物功能基因的丰度,这与我们研究结果相同。
干季增温降低了土壤微生物生物量,抑制了土壤微生物生长,土壤有机碳代谢基因丰度下降,而实验结果表明土壤有机碳含量随增温处理显著降低。这是因为增温加剧了干季土壤含水量的限制作用(干季土壤湿度显著下降24.99%),影响了分解过程中的生物化学反应以及土壤微生物群落结构,间接降低土壤微生物的分解作用[38],减少了通过微生物分解作用归还到土壤的有机碳数量。在湿季的研究中,土壤总有机碳代谢基因丰度随温度升高而增加,微生物总PLFAs量也有所上升。这是因为湿季土壤温度和含水量较高,有利于微生物的生长,增温进一步促进了微生物的活性。此外,湿季是植物的生长季节,增温促进植物的生长,植物根系更趋活跃,根系分泌物的增加有利于土壤微生物的繁殖。微生物活性的提高加速了有机质的分解,增加了土壤有机碳的淋溶和归还[39],进一步丰富了土壤微生物的碳源,使得细菌和真菌丰富度随温度升高而增加,土壤有机碳代谢能力增强。MacDonald等[40]研究结果表明,土壤温度上升会加速土壤微生物呼吸速率和溶解的有机碳淋溶,从而导致土壤中有机碳的损失。Nottingham等[41]通过对秘鲁热带森林进行5年的增温实验发现温度每升高1℃,土壤有机碳含量下降4%,土壤微生物群落结构发生变化。在土壤含水量较大时,温度对土壤有机碳分解速率的提升作用较为明显[42],加剧了土壤有机碳的流失。
4 结论
本研究依托于鼎湖山南亚热带山地常绿阔叶林,将模拟的生态系统(含植物和土壤)从高海拔整体移位至低海拔地区形成自然增温的效果。借助磷脂脂肪酸法(PLFAs)和宏基因组测序等手段,探究土壤微生物对增温的响应与适应机制。主要结论如下:增温处理显著增加了干湿季的土壤温度,显著降低了干湿季的土壤湿度,显著降低了干季土壤有机碳含量与湿季土壤硝态氮含量,对其他土壤理化因子作用不显著;增温处理改变干湿季土壤微生物生物量及其群落结构,土壤铵态氮是影响干季土壤微生物群落变化的关键因子,温度是影响湿季土壤微生物群落变化的关键因子;增温抑制了干季山地常绿阔叶林土壤有机碳代谢基因丰度,增强了湿季山地常绿阔叶林土壤有机碳代谢基因丰度。气候变暖通过改变土壤微生物群落结构及其有机碳代谢功能基因丰度,影响微生物对土壤碳库的矿化作用,最终影响南亚热带山地常绿阔叶林土壤有机碳代谢过程。

