银鲳cck和cart4基因的克隆、表达及摄食水母对其表达模式的影响
练诗雅,王亚冰,王 倩,陈 润,李云凯,周俊芳,彭士明
(1.上海海洋大学水产与生命学院,上海 201306;2.中国水产科学研究院东海水产研究所,上海 200090;3.上海海洋大学海洋科学学院,上海 201306)
银鲳(Pampusargenteus)隶属鲈形目,鲳亚目,鲳科,鲳属,因其肉质细嫩、肌间刺较少,且营养丰富,所以具有较高的市场价值与需求,是我国重要的海产经济鱼类之一[1]。20 世纪80 年代,我国已陆续开展了有关银鲳繁殖生物学方面的研究工作,至今已在银鲳的人工繁育及育苗等方面取得丰硕的研究成果[2-4]。近年的研究发现,银鲳对水母具有明显的摄食偏好,对海月水母(Aureliaaurita)的日摄食量超出其自身体质量的10余倍[5],利用碳氮稳定同位素技术分析后发现,水母对银鲳的饵料贡献率最高可达54%[6]。然而,目前关于银鲳对水母存在摄食偏好行为的内在机理尚不清楚。
cck和cart基因是涉及鱼类摄食的重要内分泌调控因子。cck基因是胃肠功能的关键调节基因,也是包括鱼类在内的脊椎动物的重要饱腹感信号,与食欲调节有关[7-10]。目前,在一些鱼类的中枢神经系统和外周组织中均发现了Cck内分泌因子,如金鱼(Carassiusauratus)[11-12]、虹鳟(Oncorhynchusmykiss)[13]、大西洋鲱(Clupeaharengus)[14]、大西洋鲑(Salmonsalar)[15]、黑青斑河鲀(Tetraodonnigroviridis)和牙鲆(Paralichthysolivaceus)[16]。Cart被认为是调节啮齿动物和人类的体重和食物摄入的重要神经递质[17-18],在大鼠(Rattusnorvegicus)中初次发现[19],其在中枢神经系统中起着至关重要的作用,能影响多种生理功能,包括摄食行为、应激反应、免疫功能、自主调节、体液平衡、代谢过程、性功能和内分泌控制[20-21]等。与Cck不同的是,它不仅具有短期效应,还具有长期效应,且其对摄食的抑制作用存在剂量依赖性[22]。
本研究以银鲳为对象,在银鲳有和无摄食水母的转录组文库分别获得了cck和cart4基因的片段,通过RACE 技术克隆了银鲳cck和cart4全长基因, 并通过Real-time PCR技术分析了cck和cart4基因在不同组织中的表达水平及摄食水母对两个基因表达模式的影响,以期为探究银鲳对水母摄食偏好的调控机制提供理论依据。
1 材料与方法
1.1 实验用鱼
200尾健康的银鲳(151.1±4.6)g饲养于2个8 m×4 m×1.8 m的水泥池中,每个水泥池100尾,保持水泥池内温度25 ℃,盐度20~22。每天分别于08∶00和17∶00投喂2次根据本课题组前期的研究成果配置银鲳的人工配合饲料[1],每天换50%水(07∶30)。驯养2周后,选取1个水泥池,除了投喂人工配合饲料,每天还额外投喂银鲳体质量3%的新鲜水母(伞盖3~5 cm,),于每日17∶00与配合饲料一起投喂。将未投喂水母的一组命名为对照组,投喂水母的一组命名为试验组,实验周期20 d(基于转录组学的时空表达分析发现,实验维持20 d后与营养相关主要基因的表达基本趋于稳态)。第20天投喂结束后停食24 h,从每个水泥池中分别随机选取36尾鱼,经丁香酚麻醉(100 mg·L-1)后解剖采集中肠、脑、鳃、肝脏、性腺、肾脏和肌肉组织,每6尾鱼的相同组织合并后放入一个无菌管中混匀作为一个样品,所有样品经液氮速冻后,置于-80 ℃保存。
1.2 银鲳总RNA的提取
银鲳各个组织的混合样品总RNA提取按照RNAiso Plus(Total RNA提取试剂)试剂盒说明书操作,使用酚氯仿混合抽提去除蛋白,使用GenovaNano测定总RNA的浓度和纯度,观察A260/A280比率确定RNA的完整性,并用琼脂糖凝胶电泳检测。
第一链cDNA合成根据PrimeScript RT reagent Kit with gDNA Eraser(Perfect Real Time)说明书操作步骤进行。合成后的产物放于-20 ℃冰箱里保存。RACE的cDNA合成按照SMARTer RACE 5′/3′试剂盒中的说明进行。所获得的RACE反转录产物用于后续的PCR扩增,并于-20 ℃保存。
1.3 银鲳cck、cart4基因的全长克隆
本研究从银鲳中肠(对照组与试验组)的转录组文库(https://www.ncbi.nlm.nih.gov/sra/PRJNA736245)中分别筛选得到了cck和cart4基因的片段。将cck和cart4基因的序列与NCBI数据库比对,该片段与鱼类的cck和cart4基因具有极高的相似度。以此片段为模板,参照引物设计原则,使用Primer designing tool(http://www.ncbi.nlm.nih.gov/tools/primer-blast/)在线引物设计软件进行引物设计(表1)。参照5′3′ RACE试剂盒中操作说明,采用巢式PCR对银鲳cck和cart4基因5′3′端序列进行克隆。PCR反应程序为预变性95 ℃ 3 min,变性94 ℃ 30 s,退火55 ℃ 30 s,延伸72 ℃ 30 s,修复延伸72 ℃ 7 min,30个循环。

表1 本文所用引物
将上述PCR产物用1.2%琼脂糖凝胶电泳检测后,按胶回收试剂盒[生工生物工程(上海)]使用说明书进行操作回收。将纯化后的产物参照质粒连接说明书连接到pMD18-T载体上。将已连接PCR产物的pMD18-T载体按照说明转化到感受态细胞(DH5α)中。过夜培养后,根据蓝白斑规则,挑选阳性单克隆结果进行扩增培养,将培养好的菌液送至生工生物工程(上海)股份有限公司进行测序。
1.4 生物信息学分析
在NCBI网站上的ORF程序(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)中分析了cck和cart4基因的全长cDNA序列。对ORF进行Blast比对,检验其与其他物种的同基因的相似度和一致性。用DNAMAN 6.0 软件进行序列拼接以及序列比对分析。用BLASTX 和BLASTN 程序(http://www.ncbi.nlm.nih.gov/BLAST/)比较已知物种的cck和cart4基因序列。系统进化树分析使用MEGA 5.1进行,用Bootstrap法重复计算 1 000次。信号肽分裂位点用SignalP Ver.4.0程序[SignalP 4.0 Server(dtu.dk)]进行测定。
1.5 银鲳cck和cart4基因组织表达
根据银鲳cck和cart4基因的cDNA序列,在其开放阅读框内用Primer5.0在线设计Real-time PCR引物,并用琼脂糖凝胶电泳检测目的片段的正确性。引物列表见表1。根据1.2所采集样品RNA的浓度,分别取各组织中1 μg总RNA用作逆转录反应的模板进行反转录获得cDNA。以cDNA为模板,以β-actin基因为内参基因,用Real-time PCR检测cck和cart4基因在不同组织CT值,采用2-ΔΔCT方法分析其表达模式以及摄食水母对其表达模式的影响(Livak and Schmittgen, 2001)。Real-time PCR反应体系为25 μL, 包括2×UltraSYBR MixTure Supermix12.5 μL、上下游引物各0.5 μL、ddH2O 10.5 μL、cDNA模板1 μL。RT-PCR 反应程序设置为(three steps):Step 1:95 ℃ 10 min;Step 2:94 ℃ 15 s、60 ℃ 1 min、40 Cycles;Step 3:65~95 ℃,增量0.5 ℃ 5 sec(绘制熔解曲线)。
1.6 统计学分析
本研究所用数据用平均值±标准差表示,用SPSS 20.0进行统计分析,用one-way ANOVA方法对cck和cart4基因在不同组织的表达量进行显著性检验和多重比较分析(P<0.05)。用独立样本t检验分析摄食水母对cck和cart4基因表达模式的影响,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 银鲳cck基因的克隆及序列结构分析
通过RACE方法在银鲳中成功获得了cck基因(GenBank登录号:MZ592785)全长序列。cck基因全长1 125 bp,5′-非翻译区(5′-UTR)长42 bp,3′-UTR长679 bp,包含一个405 bp的开放阅读框(ORF),编码合成一个134氨基酸的蛋白(图1)。3′端发现多聚腺苷酸加尾信号(polyadenylation signal)和poly(A)尾巴,起始密码子为ATG,终止密码子为TAA(图1)。位于3′-RACE PCR产物上的终止密码子和poly(A)尾巴表明了cck基因的序列的完整性(图1)。cck基因的氨基酸序列包含一个由21个氨基酸组成的信号肽(1~21位氨基酸)和一个典型的Cck家族的特征序列八肽(115~122位氨基酸)(图2)。用BlastP 程序对Cck进行比对,结果显示,银鲳Cck与大口黑鲈(Micropterussalmoides)Cck的同源性最高(87.59%),且与其他鱼类同源性均高于67.88%(图3)。由MEGA5.1构建的多物种Cck系统进化树(图4)显示,硬骨鱼类Cck独立于哺乳类(人类Homosapiens、苏门答腊猩猩Pongoabelii、小鼠Musmusculus和奶牛Bostaurus)、软体动物(虾夷扇贝Mizuhopectenyessoensis)单独聚成的一支,且银鲳Cck与鲑形目(大西洋鲑)、狗鱼目(白斑狗鱼Esox lucius)、金眼鲷目(赤锯鳞鱼Myripristis murdjan)、合鳃鱼目(黄鳝Monopterus albus)进化关系较远,但与同为鲈形目的大口黑鲈聚在一个分支上,亲缘关系最近。

图1 银鲳cck基因的核酸和氨基酸序列
图2 用I-TASSER分析Cck的3D结构

图3 基于银鲳和其他物种Cck序列的序列比对

图4 银鲳和其他物种Cck序列的系统进化树
2.2 银鲳cart4基因的克隆及序列结构分析
通过RACE的方法在银鲳中成功获得一个cart的全长基因,使用BLAST比对发现,银鲳的cart基因和其他鱼类cart4基因高度相近,因此将本研究中克隆得到的cart基因命名为cart4(GenBank登录号:MZ592784)。银鲳cart4基因全长865 bp,5′-UTR长133 bp,3′-UTR长400 bp,包含一个333 bp的ORF,编码合成一个110氨基酸的蛋白(图5)。3′端发现poly(A)尾巴,起始密码子为ATG,终止密码子为TAA(图5)。位于3′-RACE PCR产物上的终止密码子和poly(A)尾巴表明了cart4基因的序列的完整性(图5)。Cart4氨基酸序列包含一个由24个氨基酸组成的信号肽(1~24位氨基酸)和一个名为CART的结构域(45~110位氨基酸)(图6)。用BlastP 程序对Cart4氨基酸序列进行比对,结果显示银鲳Cart4与剑鱼(Xiphiasgladius)Cart4同源性最高达91.82%,与其他鱼类同源性均高于60.00%(图7)。通过MEGA5.1构建的多物种Cart4系统进化树(图8)显示,硬骨鱼类Cart4独立于哺乳类(人类、大鼠)、野猪(Susscrofa)和鸡(Gallusgallus))、两栖动物(饰纹姬蛙Microhylaornate和非洲爪蟾Xenopustropicalis)而单独聚为一支,并且银鲳Cart4与鲤形目(银鲫Carassiusgibelio)、鲑形目(虹鳟)、鳉形目(青鳉Oryziasmelastigma)进化关系较远,但与同为鲈形目的剑鱼聚在一个分支上,亲缘关系最近。

图5 银鲳 cart4 基因的核酸和氨基酸序列
图6 I-TASSER分析Cart4的3D结构
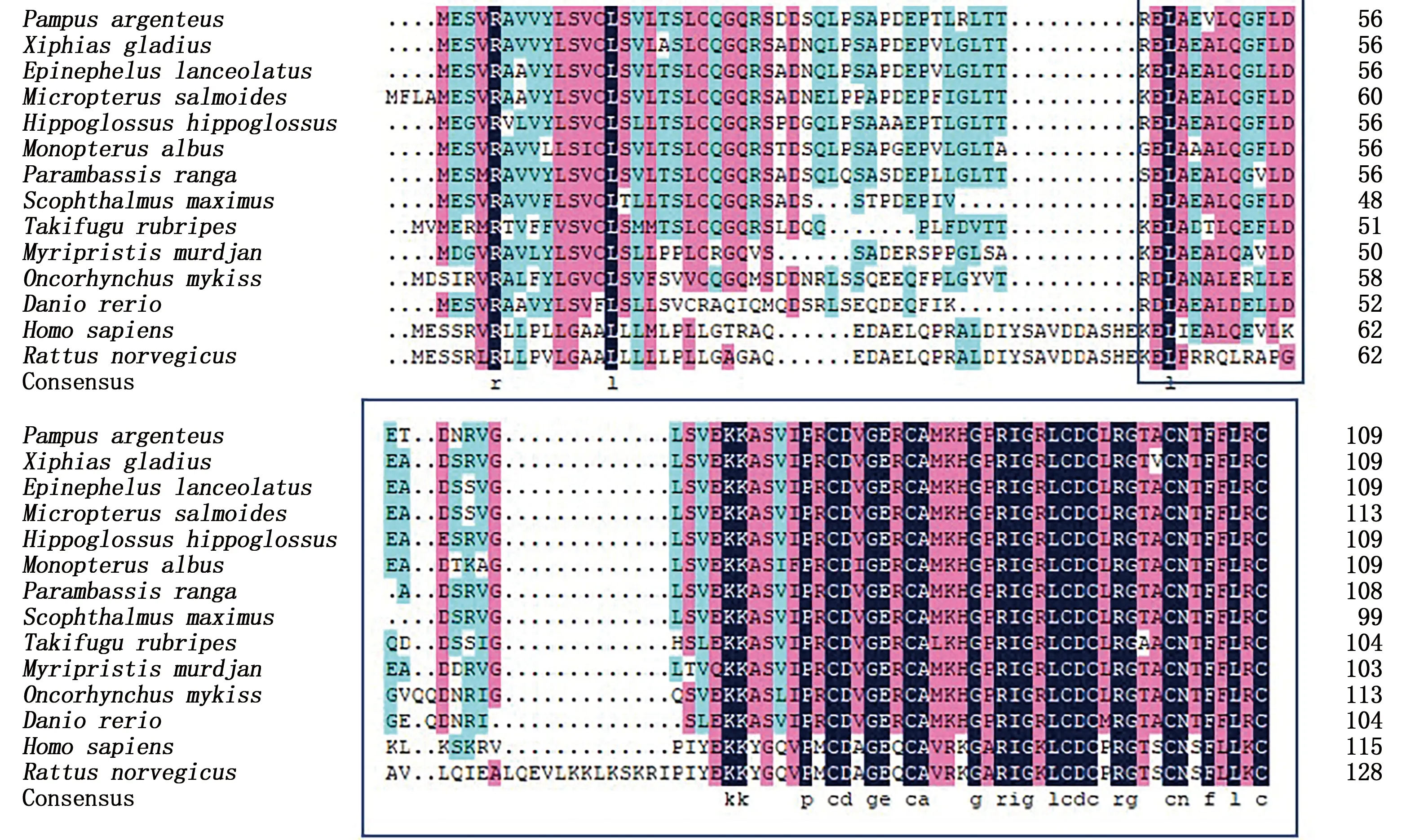
图7 基于银鲳和其他物种Cart4氨基酸序列的序列比对

图8 银鲳和其他物种Cart4序列的系统进化树
2.3 银鲳cck基因的组织表达模式及摄食水母对其表达规律的影响
cck基因在不同组织的表达模式及摄食水母对其表达规律的影响见图9。cck基因在中肠、脑、鳃、肝脏、性腺、肾脏和肌肉中均有表达,对照组在中肠表达量最高(P<0.05),而试验组在脑中表达量最高(P<0.05)。其中无论是否摄食水母,cck在中肠、脑、鳃和肌肉中表达量均较高(P<0.05)。试验组与对照组相比,cck在脑、肝脏和肾脏中的表达量极显著增加(P<0.01),在肌肉中的表达量略有增加,但差异不显著(P>0.05),而在中肠、鳃和性腺中的表达量极显著下降(P<0.01)。

图9 摄食水母对银鲳cck基因不同组织中相对表达量的影响
2.4 银鲳cart4基因的组织表达模式及摄食水母对其表达规律的影响
如图10所示,cart4基因在中肠、脑、鳃、肝脏、性腺、肾脏和肌肉中均有表达,且摄食或未摄食水母的银鲳cart4基因在脑中表达量均为最高(P<0.05)。其中,对照组cart4在中肠、脑、肝脏和肌肉中表达量均较高(P<0.05)。试验组与对照组相比,在脑中的表达量极显著增加(P<0.01),而在性腺中显著下降(P<0.05),在中肠、鳃、肝脏和肌肉中极显著下降(P<0.01)。
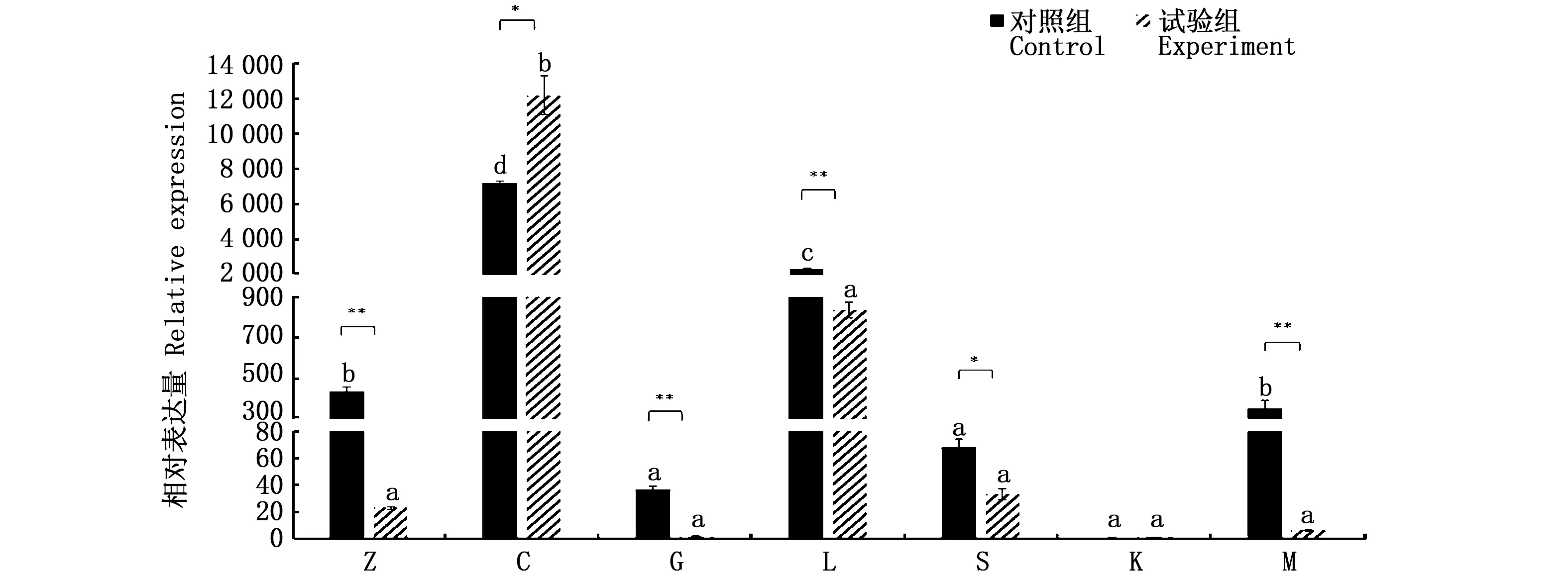
图10 摄食水母对银鲳cart4基因不同组织中相对表达量的影响
3 讨论
3.1 银鲳cck基因的生物信息学分析
银鲳cck基因的氨基酸序列包含一个信号肽和一个典型的Cck家族的特征序列八肽。在八肽中,第116位氨基酸残基酪氨酸发现硫化修饰,该结果与异齿裂腹鱼(Schizothoraxo′connori)[23]、齐口裂腹鱼(Schizothoraxprenanti)[24]和草鱼(Ctenopharyngodonidella)[25]等其他鱼类中的研究结果相同。推测其是激活cck基因受体与之结合的活性位点。Cck蛋白序列中段在种间差异较大,但N端和C端序列的差异较小,且八肽在整个生物进化过程中极度保守,推测其在不同物种中行使着相似的功能。将银鲳Cck与其他物种Cck进行同源比较,发现银鲳Cck与大口黑鲈的Cck相似度最高为87.59%,与其他鱼类同源性均高于67.88%,表明cck基因在整个鱼类进化过程中均较为保守。
3.2 银鲳cart4基因的生物信息学分析
银鲳cart4基因的氨基酸序列包含一个信号肽和一个名为CART的结构域。其是一种厌食肽,含有3个二硫桥的C端部分是影响银鲳对食物摄取活动调节物质分子的生物活性部分。该结果与齐口裂腹鱼[26]、南方鲇(Silurusmeridionalis)[27]等其他鱼类的研究结果相似,Cart4蛋白序列中段种间差异较大,但N端和C端序列的差异较小,且cart4基因的结构域在整个生物进化过程中均较为保守,推测其在不同物种中行使着相似的功能。并且将银鲳Cart4与其他物种编码氨基酸进行同源比较发现,不同物种Cart4存在差异,如银鲳Cart4与剑鱼Cart4同源性最高达91.82%,与其他鱼类同源也均高于63.06%,表明cart4基因在整个鱼类进化过程中较为保守。
3.3 银鲳cck的组织表达模式及摄食水母对其表达规律的影响
Cck表达的蛋白质是以多种大分子形式存在于小肠黏膜、脑和周围神经组织中[28-29], 多为可以使胆囊收缩的脑-肠肽物质[30]。Cck具有广泛的生物活性, 主要包括调节摄食[31]、促进胰腺分泌[32]、促进胆囊收缩[33]、调节胃肠道运动[34]等多种功能,其中调节摄食的功能主要表现为降低摄食量、减短摄食时间以及增加饱感。GIBBS等[35]证实了Cck内分泌因子的产生和饱足感的产生对摄食的影响是一致的,即均是由内源性Cck的生理学作用引起的。由于Cck是一种脑-肠肽物质,所以一般在脑和肠中表达量较高[36]。本研究结果发现,银鲳cck基因在中肠和脑中表达量较高,也进一步印证了上述的研究报道,此外在草鱼[25]、虹鳟[13]、大西洋鲑[15]等鱼类中也得出了相似的研究结果。Cck是一种餐后饱感信号因子[37]。YUAN等[24]在齐口裂腹鱼中观察到下丘脑和前肠中cck基因的表达量在餐后3 h都显著升高。在金鱼中,脑中cck基因的表达量同样在餐后2 h有明显的升高, 并有持续升高的趋势。本研究在摄食后取样,试验组脑部cck基因的表达量极显著高于对照组,可以推测摄食水母可以使银鲳产生更强的饱腹感。已有的研究表明,cck的表达量受肠管内容物的调节,当肠管充满时,cck的表达量较低,而在排空时cck的表达量较高[10]。本研究发现,试验组肠道cck基因的表达量极显著低于对照组,由此可以推测银鲳在摄食水母后,由于水母中较高的水分含量,导致肠管充塞度较高,这可能是银鲳摄食水母后肠道cck基因明显下调的原因之一。
3.4 银鲳cart4的组织表达及摄食水母对其表达规律的影响
在哺乳动物中发现Cart主要在脑内与动物自发活动和激发性兴奋相关的区域[22]以及在肠道系统和迷走神经系统中表达[38]。其中Cart在下丘脑中广泛表达,在弓状核、室旁核、下丘脑背内侧核和下丘脑外侧核密集表达[39-41]。弓状核到下丘脑外侧核和室旁核的通路可能介导饱足信息。另一种可能是直接从弓状核延伸到伏隔核壳部,或间接通过下丘脑外侧核-室旁核[42]的通路,并在伏隔核壳部中触发奖赏体验。下丘脑神经元组内的Cart回路处理能量稳态[43],而与伏隔核壳部的连接可能介导了食物奖赏反应[44]。cart基因除了调节饱腹感和奖励机制[45],还在抑制动物摄食量的同时影响动物的摄食行为[22]。在异齿裂腹鱼的研究中发现,摄食后cart基因在脑组织的相对表达量下降,且随着摄食后时间逐渐延长其表达量持续降低,说明cart基因并不是异齿裂腹鱼的饱感信号因子[26],但在本研究中,试验组cart基因在不同组织的表达量均极显著高于对照组,而袁登越[38]对齐口裂腹鱼的研究中发现,餐后组下丘脑cart基因的表达量显著高于餐前组,同样在斑点叉尾鮰(Ictaluruspunetaus)的研究中也发现,其脑组织cart基因的表达量在餐后1.5 h显著升高[46],所以推测Cart4是银鲳的饱感信号因子。但由于脑部又分为弓状核、室旁核、下丘脑背内侧核、下丘脑外侧核和伏隔核壳部,其中弓状核-室旁核和下丘脑背内侧核-下丘脑外侧核属于两个独立的回路,即饱腹感和奖励机制。而本实验使用的是整个脑部组织,所以无法准确判断试验组脑部cart基因表达量的增加是由于弓状核-室旁核和下丘脑背内侧核-下丘脑外侧核回路共同增加还是其中一个回路的增加高于另一回路的降低。有研究表明,下丘脑背内侧核和下丘脑外侧核中的Cart可能参与了促食欲效应的激活[47],结合cck基因脑部的表达量,可以推测实验组银鲳脑部弓状核-室旁核回路cart4基因表达量是高于对照组的。假设下丘脑背内侧核和下丘脑外侧核回路是正向反馈作用,则可以说明摄食水母可以使银鲳得到更大的满足感。有研究表明,鱼类下丘脑cart基因的表达量与食物摄入量的增加呈反比[48],在本实验中试验组脑部cart基因的表达量极显著高于对照组,结合脑部和肠道cck基因的表达规律,可以推测银鲳摄食较少量的水母就能获得更好的饱腹感。

