SLC40A1与女性生殖系统恶性肿瘤预后相关性的生物信息学分析
黄宝友 夏哲新 陈子宁 张 成 吴艳阳 倪 静 奚嘉妮 朱芳芳
铁是大多数生物体所需的金属微量营养素,在细胞水平上参与能量代谢、线粒体功能和DNA合成等功能。膜铁转运蛋白1(ferroportin1,FPN1)是目前已知的唯一具有由胞内向胞外转移铁能力的细胞膜蛋白,也是唯一的非血红素铁输出蛋白[1]。如果细胞内铁过多,则会以铁蛋白的形式储存,当体内需要时,通过FPN1将铁释放入血并循环进入全身组织细胞,细胞内铁也经由FPN1通道进入血浆。巨噬细胞吞噬红细胞后亦通过FPN1向血浆中释放铁,过多的铁可能造成铁稳态的失衡从而带来生物毒性,影响细胞膜的功能,导致细胞死亡[2]。SLC40A1基因编码FPN1,位于2q32.2,其编码的蛋白拥有12个跨膜结构域,末端定位于细胞膜内,具有2个亚型,分别为FPN1A和FPN1B,前者拥有一个5-铁反应元件,在铁缺乏细胞中表达受到抑制;后者主要表达于十二指肠细胞,没有上述反应元件,因此它在铁缺乏细胞中也能够持续地向细胞外供铁[3]。
在多种癌症研究中发现,SLC40A1低表达可以被用作癌症临床预后不良的预测,且下调SLC40A1表达可能通过减少铁外流促进癌细胞增殖。值得注意的是,SLC40A1在常见的女性生殖系统恶性肿瘤如宫颈癌(cervical cancer,CESC)、卵巢癌(ovarian cancer,OV)、子宫内膜癌(endometrial cancer,UCEC)的表达谱和预后潜力仍然未知。因此本研究通过结合不同的生物信息学数据库探讨不同疾病中SLC40A1的表达及SLC40A1表达量与临床预后的相关性,以挖掘疾病诊断和预后指标。
材料与方法
1.SLC40A1人体组织分布情况:GeneCard数据库展示SLC40A1在人体主要组织和器官中的分布情况[4]。GEPIA2数据库分析SLC40A1不同变异体在CESC、OV、UCEC分布情况[5]。
2.SLC40A1mRNA、蛋白表达情况:Oncomine数据库分析SLC40A1在不同癌症组织及正常组织中表达的差异[6]。Timer2.0是一个交互式的在线工具,可利用TCGA数据研究SLC40A1在正常组织与癌症组织中的表达差异[7]。GEPIA2分析 SLC40A1mRNA在CESC、OV、UCEC和正常组织表达的差异。HPA数据库展示SLC40A1蛋白在正常组织和肿瘤组织中免疫组化的结果[8]。
3.SLC40A1表达量与临床预后分析:Ualcan是肿瘤亚组基因分析和生存分析的工具,SLC40A1表达量与肿瘤不同分期的相关性[9]。HPA 验证SLC40A1高低表达与患者生存率的相关性。
4.蛋白互相作用网络分析:GeneMANIA数据库生成SLC40A1相互作用网络,并评估这些相互作用的作用[10]。STRING数据库生成SLC40A1的蛋白质相互作用网络(protein-protein interaction network,PPI)[11]。取两者共同的互作基因,利用GEPIA2数据库研究了不同疾病中SLC40A1mRNA的表达与互作基因表达水平之间的相关性。
结 果
1.SLC40A1分布情况:GeneCard展示了SLC40A1广泛分布人体各个组织,其中肝脏、肾脏、胎盘组织中为主,女性生殖系统表达量也较高(图1A)。GEPIA2显示 SLC40A1 在CESC、OV、UCEC中存在7种变异体,其中以SLC40A1-001最为常见(图1B)。

图1 SLC40A1分布情况A.SLC40A1在人体各种组织中的分布,女性生殖系统表达量较高;B.GEPIA2数据库SLC40A1在CESC、OV、UCEC中的变异体分布情况
2.SLC40A1mRNA表达情况:Oncomine分析得出SLC40A1在肺癌、前列腺癌、白血病以及卵巢癌中低表达,而在脑和神经肿瘤中高表达,在CESC、UCEC中尚无研究,OV研究结果表明,在癌组织中呈低表达(图2A)。Timer 2.0数据库中 SLC40A1mRNA在不同类型癌症中癌组织与正常组织表达情况,因卵巢癌中无正常组织对照而无法判定差异,在CESC、UCEC较正常组织均呈低表达且差异显著(图2B)。GEPIA2数据库中SLC40A1mRNA在女性生殖系统恶性肿瘤较正常组织表达低,CESC、OV差异有统计学意义,而在UCEC中差异无统计学意义(图2C)。图2中B与C的结果略有不同,但是趋势基本上一致,考虑是病例数不同或数据来源不同造成的偏倚。

图2 SLC40A1 mRNA在组织中的表达情况A.Oncomine数据库SLC40A1 mRNA在不同类型癌症中癌组织与正常组织表达情况;B.Timer 2.0数据库SLC40A1 mRNA在不同类型癌症中癌组织与正常组织表达情况,CESC、VCEC差异有统计学意义;C.GEPIA2数据库SLC40A1 mRNA在女性生殖系统恶性肿瘤较正常组织表达低,CESC、OV差异有统计学意义。*P<0.05,**P<0.01,***P<0.001。TPM.每百万转录数
3.LC40A1蛋白表达情况:通过HPA数据库将SLC40A1蛋白在CESC、OV、UCEC中的表达情况,图3中A~C显示SLC40A1蛋白在宫颈鳞癌、宫颈腺癌较正常宫颈组织表达低;图3中D~F显示SLC40A1蛋白在浆液性卵巢癌、黏液性卵巢癌较正常卵巢组织的表达低;图3中G~H显示SLC40A1蛋白在子宫内膜样腺癌较正常子宫内膜组织表达低,以上均从组织的蛋白层面证明癌组织中低表达,与SLC40A1 mRNA的表达趋势相符合。

图3 SLC40A1免疫组化结果A~C.正常宫颈组织、宫颈鳞癌、宫颈腺癌SLC40A1蛋白的表达情况; D~F.正常卵巢组织、浆液性卵巢癌、黏液性卵巢癌SLC40A1蛋白的表达情况;G、H.正常子宫内膜组织、子宫内膜样腺癌SLC40A1蛋白的表达情况
4.SLC40A1与肿瘤分期的相关性分析:Ualcan数据库SLC40A1与肿瘤分期的相关性分析,在CESC、UCEC中宫颈癌患者较正常人SLC40A1表达低,且部分呈肿瘤分期越晚,表达越低。在CESC中,Ⅱ期、Ⅳ期患者较正常人明显低表达,Ⅰ期较Ⅱ期明显低表达。在UCEC中,Ⅳ期较正常人以及其他期别表达显著降低,差异均有统计学意义。特殊的是,在OV中不同肿瘤分期间的SLC40A1表达无明显趋势,各组间表达差异无统计学意义,推测原因是卵巢癌早期患者较少,一般发现均以晚期为主,需要增加早期卵巢癌患者数量再进一步统计学分析。
5.SLC40A1与临床生存率的相关性分析:HPA数据库SLC40A1与临床生存率的相关性分析,291例宫颈癌、541例子宫内膜癌中SLC40A1表达量不同,其5年生存率差异有统计学意义(P<0.05)。在CESC中,152例高表达、139例低表达的5年生存率分别为73%、58%;在UCEC中,210例高表达、331例低表达的5年生存率分别为83%、73%。而在OV中SLC40A1表达量不同,其5年生存率差异无统计学意义,75例高表达、298例低表达的5年生存率基本相同。
6.SLC40A1蛋白互相作用网络分析:GeneMANIA数据库构建了SLC40A1的蛋白互相作用网络,中间的节点代表SLC40A1,周围的20个节点代表与SLC40A1相关的基因,STRING构建10个相关基因(图4)。CP、HEPH、HAMP、SLC11A2这4个相关基因两者共有,SLC40A1与4个基因在OV中的表达均显著相关。而在CESC、UCEC中,除了与HAMP无显著相关性,其余均显著相关。
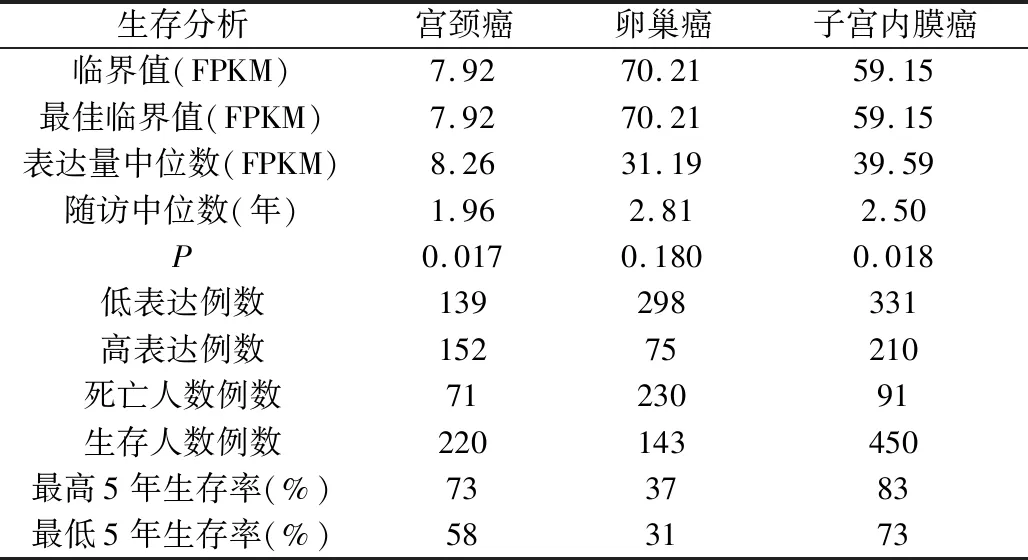
表1 SLC40A1 在妇科恶性肿瘤中的预后分析
讨 论
1. SLC40A1与铁代谢的关系:不同条件下铁在癌细胞中发挥着不同的作用。一方面,铁可以改变作为自由基电子供体的细胞氧化还原状态。过量的自由基会促进基因突变,从而加速肿瘤的发生。另一方面,铁作为一种营养元素,对癌细胞的生长和增殖至关重要[12]。铁稳态失调,即过量铁的获取和保留,有助于肿瘤的发生和肿瘤的生长,这一观察结果孕育了在抗癌治疗中靶向细胞内铁的各种方法,包括使用铁螯合剂和针对转铁蛋白受体1(transferrin receptor 1,TFR1)的细胞毒性药物偶联物,诱导铁依赖性细胞死亡的药物治疗癌细胞是一种将癌细胞中过量的铁转化为治疗优势的策略[13]。已知参与铁代谢的基因36个,包括HAMP、CP、HEPH、Tf、TfR1、TfR2、HFE、HJV、STEAP3、MET1(DMT1)、DCytb、ZIP14、ZIP8、SCARA5、FLVCR2、HRG-1、CDP1、CD91、CD163、HO-1、Mfrn1、Mfrn2、ABCB7、ALAS1、FLVCR1、FTMT、FtH、FTL、PCBP1、PCBP2、NCOA4、FPN1、IRP1、IRP2、FBXL5、FAM96A,本研究中互作基因绝大多数属于铁代谢基因,侧面反映了SLC40A1在铁代谢中的作用[14]。

图6 SLC40A1蛋白互相作用网络分析A.GeneMANIA构建SLC40A1互作蛋白20个;B.STRING构建SLC40A1互作蛋白10个;C.CESC中SLC40A1与HEPH、CP、HAMP、SLC11A2互作蛋白表达的相关性;D.OV中SLC40A1与HEPH、CP、HAMP、SLC11A2互作蛋白表达的相关性;E.UCEC中SLC40A1与HEPH、CP、HAMP、SLC11A2互作蛋白表达的相关性。TPM.每百万转录数
目前许多种铁螯合剂包括Dp44mT、Deferasirox (DFX)和Deferoxamine (DFO)等通常会触发各种癌细胞的凋亡引起细胞死亡,已被开发为靶向铁代谢的抗癌药物[15]。在实体肿瘤和急性髓细胞白血病中,铁螯合剂或以其他方式影响铁代谢的药物都可以诱导分化并抑制细胞增殖[16, 17]。有临床研究表明,铁螯合剂在白血病和神经母细胞瘤患者中获得了抑制肿瘤的潜在获益[18]。此外,铁螯合剂可以与分子靶向药物联合用于治疗顽固性和耐药性癌症。Dp44mT可显著逆转乳腺癌细胞对依托泊苷的耐药性,并可显著逆转表皮癌细胞对长春新碱的耐药性[19]。另有文献报道,DFX被用于治疗高血清铁蛋白和妥珠单抗奥唑咪定耐药性白血病,DFX降低了血清铁蛋白,消除了持续输血的需求,并帮助患者实现完全缓解[20]。
2. SLC40A1与肿瘤预后的关系:在临床预后的研究中,Wang等[21]研究表明,FPN1在正常肝组织、癌旁组织表达呈强阳性,而在肝癌细胞中大部分表达缺失或降低,且与肝内转移、TNM分期晚、门静脉浸润、细胞低分化相关,认为SLC40A1低表达预测肝癌预后不良。Liu等[22]通过生物信息学分析总结了肺癌组织中SLC40A1mRNA和蛋白表达显著下调,低SLC40A1表达与肺癌患者预后较差密切相关且SLC40A1与铁稳态和免疫显著相关。有研究发现,SLC40A1低表达与乳腺癌患者无转移生存期有关,与雌激素受体缺失、低分级、淋巴转移等不良预后因素相关,是乳腺癌患者预后的预测因子[23]。乳腺癌中SLC40A1表达下调,并且这种下调程度与预后相关,在乳腺癌细胞中恢复SLC40A1的表达可以抑制癌细胞的生长,进一步研究发现在三阴乳腺癌中SLC40A1表达减少也导致上皮间质转化(epithelial mesenchymal transition,EMT)的发生,E-cadherin表达增加,N-cadherin、Twist和Slug表达减少[24]。本研究发现在妇科恶性肿瘤中的结果与肝癌、肺癌相似,而与乳腺癌相反。
越来越多的研究者开始关注SLC40A1与肿瘤发生、发展的相关性,并在多种肿瘤细胞上开展基础实验。有文献报道,SLC40A1在前列腺癌组织中的表达量较增生的前列腺组织及正常前列腺组织明显降低,SLC40A1能够抑制癌细胞增殖甚至不同组织病理学亚型的前列腺癌细胞激活聚合途径,以影响SLC40A1介导的铁损耗,SLC40A1诱导自噬并激活转录因子p53和KLF6以及它们共同的下游靶细胞p21,还能诱导细胞周期阻滞和应激诱导的DNA损伤基因[25, 26]。另外在多发性骨髓瘤(multiple myeloma,MM)的研究中发现,SLC40A1的异常下调与MM的预后不良和破骨细胞分化有关,SLC40A1在MM中下调,同时促进了细胞内铁的积累和活性氧的产生,SLC40A1敲除促进MM细胞的生长和存活,验证了SLC40A1的预后价值及其作为MM的新治疗靶点的潜在前景[27]。回顾既往文献,SLC40A1在女性生殖系统恶性肿瘤的研究甚少,仅在卵巢癌中有研究,在卵巢癌肿瘤起始细胞(tumor initiating cells,TICs)的遗传模型中也观察到类似的SLC40A1减少和TFR1增加,最终结果是细胞内过量铁的积累和对铁增殖的依赖增强,如使细胞内铁的强制减少,可减少TICs的增殖并抑制肿瘤生长和肿瘤细胞的腹腔内扩散[28],此外,有进一步研究表明SLC40A1的表达与卵巢癌铂类耐药呈明显负相关[29]。
综上所述,SLC40A1在铁代谢中具有重要的地位,SLC40A1在宫颈癌、卵巢癌、子宫内膜癌中呈低表达,宫颈癌、子宫内膜癌中表达量低预示患者的肿瘤分期越晚,同时生存率越低,是潜在的临床预后标志物。

