天麻素通过调节miR-155介导的Notch通路对脑卒中大鼠发挥神经保护作用
刘振 张磊 胡灿芳 罗国君 汤定中
上海市第六人民医院金山分院神经内科,上海 201599
脑卒中属于急性脑血管疾病,因脑部血管突发阻塞或破裂,造成脑组织损伤,分为缺血性卒中和出血性卒中,约70%的脑卒中为缺血性卒中,即脑梗死[1]。现已知微小核糖核酸(miRNA)可调节靶基因表达,广泛参与到细胞的增殖、分化、凋亡等过程中[2]。Xing等[3]研究发现,脑卒中大鼠脑组织中存在微小RNA155(microRNA-155,miR-155)的高表达,推测miR-155与缺血性脑卒中关系密切。Notch信号通路在神经发生过程中具有重要作用,该通路的激活可促进受损神经元的修复[4]。Wang等[5]研究发现,miR-155与Notch信号之间存在负向调节关系。天麻素提取于天麻根块,已有研究表明其具有抗癫痫、改善脑供血不足、营养脑神经等药理作用[6]。为明确天麻素对脑卒中大鼠神经是否具有保护作用,其中又是否涉及miR-155介导的Notch信号通路,2020年1月至2021年3月,本实验建立缺血性脑卒中大鼠模型并进行探究,以期为脑卒中临床治疗新药物的开发提供理论依据。
资料与方法
1、材料
清洁级健康雄性SD大鼠94只,体质量(250±10)g,在适宜环境中饲养,实验过程严格遵循3R原则,经上海市第六人民医院金山分院的医学伦理委员会审核通过。斯贝福(北京)生物科技有限公司;天麻素注射液,广东三才石岐制药股份有限公司;Caspase-3、Caspase-9活性测定试剂盒,北京索莱宝科技有限公司;细胞/组织miRNA提取试剂盒,上海翊圣生物科技有限公司;BCA快速蛋白定量试剂盒、兔抗大鼠Notch1抗体、兔抗大鼠Jagged1抗体、兔抗大鼠Hes1抗体、羊抗兔免疫球蛋白(Ig)G(HRP)抗体,赛默飞世尔科技(中国)有限公司。
2、方法
2.1、建立动物模型[7]大鼠术前12 h禁食、前4 h禁水,麻醉后于颈正中切口。分离左侧颈总动脉,于近心端结扎;分离左侧颈内动脉,于远心端动脉夹夹闭;分离左侧颈外动脉,靠近分叉处结扎。左侧颈总动脉和左侧颈内动脉之间切口,颈内动脉方向插入线栓,感受到阻力时取下动脉夹,当线栓不能继续前进时,将其固定,缝合手术切口,整个过程持续照射恒温灯,以保持大鼠体温,防止术中大鼠体温过低而亡。1 h后,同样方式取出线栓。造模成功判断:提尾时,大鼠右侧肢体呈现屈曲状态;活动时,大鼠身体倾倒或者转圈;刺激时,大鼠右侧肢体痛觉迟钝甚至消失。
2.2、实验分组 实验分为假手术组、模型组、天麻素低剂量组、天麻素中剂量组、天麻素高剂量组,各18只。天麻素低剂量组、天麻素中剂量组、天麻素高剂量组:术后1 h通过腹腔注射,进行天麻素给药[8](低剂量50 mg/kg、中剂量100 mg/kg、高剂量150 mg/kg),1次/d,共3 d。假手术组:在手术中分离动脉,但不放置线栓、不结扎,术后注射等体积生理盐水,1次/d,共3 d。模型组:术后注射等体积生理盐水,1次/d,共3 d。
术后24 h,假手术组大鼠无死亡,模型组及天麻素低、中、高剂量组大鼠死亡1~3只不等,为保持各组实验动物数量一致,每组随机选取18只大鼠进行后续实验。
2.3、评估大鼠神经功能 Longa评分法:神经功能无障碍,即正常,计0分;提尾时,右侧肢体屈曲,即轻度受损,计1分;活动时,大鼠身体朝右侧倾斜或转圈,即中度受损,计2分;活动时,大鼠身体朝右侧摔倒,即重度受损,计3分;大鼠无自发活动,计4分。
2.4、测定大鼠脑含水量 每组随机选取5只大鼠,麻醉后取完整大脑,蒸馏水冲洗,滤纸擦干,电子精密天平称重,记为m(湿)。脑组织置于恒温干燥箱中烘干至恒重,再次称重,记为m(干)。含水量=[m(湿)-m(干)]/m(湿)×100%。
2.5、2,3,5三苯基氯化四氮唑(TTC)染色观察大鼠脑梗死情况 每组随机选取5只大鼠,麻醉后取完整大脑,置于-20℃冰箱冷冻层冷冻20 min,以便切片。切片方向沿额级向后,厚度约2 mm,切下的脑组织立即浸入2%TTC染液中,避光37℃、20 min。数码相机拍照后通过Image J系统分析结果。T为切片厚度,A为梗死面积,V为梗死体积。V=(A1+A2+A3+…+An)T,梗死率=V/脑组织总体积×100%。
2.6、苏木素伊红(HE)染色观察海马组织神经元形态每组随机选取3只大鼠,深度麻醉后进行4%多聚甲醛心脏灌注,取脑,固定,再经75%乙醇脱水,进行石蜡包埋,5μm切片。梯度二甲苯、梯度乙醇处理后,HE染色,脱水透明,中性树脂封片,光镜下观察海马CA1区神经元形态。
2.7、比色法测定Caspase-3和Caspase-9活性 每组随机选取5只大鼠,麻醉,取完整大脑,冷冻后剪为组织碎片,充分研磨。取部分组织匀浆按照试剂盒说明书,进行Caspase-3和Caspase-9活性测定,Caspase活性以405 nm吸光度(A)值表示。
2.8、实时定量聚合酶链反应(RT-qPCR)检测miR-155表达 取2.7中组织匀浆,提取总RNA,逆转录为cDNA,用于 RT-qPCR。miR-155正向引物:GGGTTAATGCTAATTGTG;反 向 引 物 :AACTGGTGTCGTGGAGTCGGC。内参U6正向引物:GCTTCGGCACGTAACATATACTAAAAT;反向引物:CGCTTCACGACCTAGTGCGTGTCAT。2-ΔΔCt法分析实验结果。
2.9、蛋白质免疫印迹检测Notch1、Jagged1、Hes1表达取2.7中组织匀浆,4℃低温15 000 r/min离心15 min,离心半径12 cm,取上清定量蛋白。将50μg蛋白和上样缓冲液混合均匀,10 min沸水浴,上样并电泳。在将蛋白转移至PVDF膜上,5%脱脂奶4℃封闭过夜,稀释一抗(1∶1 000稀释的Notch1抗体、Jagged1抗体、Hes1抗体)4℃过夜孵育;稀释二抗(1∶1 000稀释的羊抗兔IgG抗体)室温孵育1 h;显色、成像系统拍照,Image J软件分析结果。
3、统计学方法
SPSS 20.0软件分析数据,符合正态分布的计量资料以(±s)表示,多组间比较行单因素方差分析,进一步两组间比较行SNK-q检验,P<0.05为差异有统计学意义。
结 果
1、大鼠神经功能评分
如表1所示,相较于假手术组,模型组和天麻素各剂量组评分显著升高(均P<0.05);相较于模型组,天麻素低、中、高剂量组评分显著降低(均P<0.05),其中天麻素高剂量组最低。
表1 各组清洁级健康雄性SD大鼠神经功能评分比较(±s,n=18)

表1 各组清洁级健康雄性SD大鼠神经功能评分比较(±s,n=18)
注:天麻素低剂量组、天麻素中剂量组、天麻素高剂量组术后1 h通过腹腔注射,进行天麻素给药(低剂量50 mg/kg、中剂量100 mg/kg、高剂量150 mg/kg),1次/d,共3 d;假手术组在手术中分离动脉,但不放置线栓、不结扎,术后注射等体积生理盐水,1次/d,共3 d;模型组术后注射等体积生理盐水,1次/d,共3 d。相较于假手术组,a P<0.05;相较于模型组,b P<0.05
组别假手术组模型组天麻素低剂量组天麻素中剂量组天麻素高剂量组F值P值神经功能评分0 3.52±0.31a 2.64±0.28ab 2.03±0.33ab 1.55±0.34ab 389.655<0.001
2、大鼠脑含水量
如表2所示,相较于假手术组,模型组和天麻素各剂量组大鼠脑组织含水量显著升高(均P<0.05);相较于模型组,天麻素低、中、高剂量组大鼠脑组织含水量显著降低(均P<0.05),其中天麻素高剂量组最低。
表2 各组清洁级健康雄性SD大鼠脑组织含水量比较(±s,n=5)

表2 各组清洁级健康雄性SD大鼠脑组织含水量比较(±s,n=5)
注:天麻素低剂量组、天麻素中剂量组、天麻素高剂量组术后1 h通过腹腔注射,进行天麻素给药(低剂量50 mg/kg、中剂量100 mg/kg、高剂量150 mg/kg),1次/d,共3 d;假手术组在手术中分离动脉,但不放置线栓、不结扎,术后注射等体积生理盐水,1次/d,共3 d;模型组术后注射等体积生理盐水,1次/d,共3 d。相较于假手术组,a P<0.05;相较于模型组,b P<0.05
组别假手术组模型组天麻素低剂量组天麻素中剂量组天麻素高剂量组F值P值脑组织含水量(%)71.31±2.22 87.44±2.56a 81.52±2.19ab 80.39±2.24ab 79.33±2.05ab 32.791<0.001
3、大鼠脑梗死情况
如表3、图1所示,可观察到染色的切片组织呈现红白相间,白色部分即为梗死组织。相较于假手术组,模型组和天麻素各剂量组大鼠脑梗死率显著升高(均P<0.05);相较于模型组,天麻素低、中、高剂量组大鼠脑梗死率显著降低(均P<0.05),其中天麻素高剂量组最低。

图1 各组清洁级健康雄性SD大鼠脑梗死情况(2,3,5三苯基氯化四氮唑染色);A为假手术组,B为模型组,C为天麻素低剂量组,D为天麻素中剂量组,E为天麻素高剂量组
表3 各组清洁级健康雄性SD大鼠脑梗死比较(%,±s,n=5)

表3 各组清洁级健康雄性SD大鼠脑梗死比较(%,±s,n=5)
注:天麻素低剂量组、天麻素中剂量组、天麻素高剂量组术后1 h通过腹腔注射,进行天麻素给药(低剂量50 mg/kg、中剂量100 mg/kg、高剂量150 mg/kg),1次/d,共3 d;假手术组在手术中分离动脉,但不放置线栓、不结扎,术后注射等体积生理盐水,1次/d,共3 d;模型组术后注射等体积生理盐水,1次/d,共3 d。相较于假手术组,a P<0.05;相较于模型组,b P<0.05
组别假手术组模型组天麻素低剂量组天麻素中剂量组天麻素高剂量组F值P值脑梗死率0 32.15±3.59a 24.66±2.35ab 20.87±2.06ab 15.65±1.54ab 144.880<0.001
4、大鼠神经元形态变化
如图2所示,假手术组大鼠海马CA1区可观察到锥体神经元形态结构清晰完整,排列紧密,细胞核圆润,染色清楚;模型组大鼠海马CA1区则观察到神经元细胞数目大量减少,细胞结构不规则,轮廓模糊,排列松散,细胞核固缩;天麻素各剂量组大鼠海马CA1区可观察到神经元细胞数目较模型组有所增加,细胞排列相对紧密,边界较为清晰。
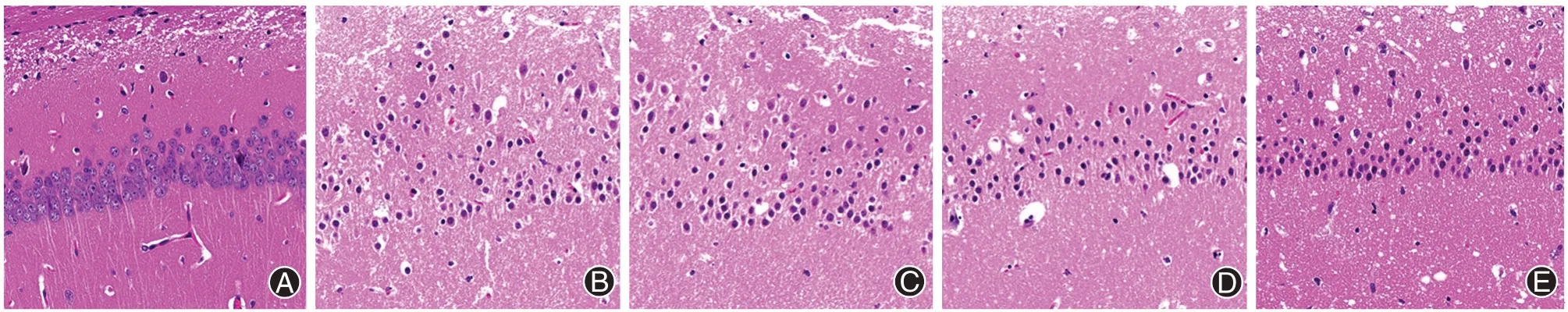
图2 各组清洁级健康雄性SD大鼠神经元形态(苏木素伊红染色 ×200);A为假手术组,B为模型组,C为天麻素低剂量组,D为天麻素中剂量组,E为天麻素高剂量组
5、大鼠脑组织中Caspase-3和Caspase-9活性
如表4所示,相较于假手术组,模型组和天麻素各剂量组大鼠脑组织中Caspase-3和Caspase-9活性显著升高(均P<0.05);相较于模型组,天麻素低、中、高剂量组大鼠脑组织中Caspase-3和Caspase-9活性显著降低(均P<0.05),其中天麻素高剂量组最低。
表4 各组清洁级健康雄性SD大鼠脑组织中Caspase-3和Caspase-9活性比较(±s,n=5)

表4 各组清洁级健康雄性SD大鼠脑组织中Caspase-3和Caspase-9活性比较(±s,n=5)
注:天麻素低剂量组、天麻素中剂量组、天麻素高剂量组术后1 h通过腹腔注射,进行天麻素给药(低剂量50 mg/kg、中剂量100 mg/kg、高剂量150 mg/kg),1次/d,共3 d;假手术组在手术中分离动脉,但不放置线栓、不结扎,术后注射等体积生理盐水,1次/d,共3 d;模型组术后注射等体积生理盐水,1次/d,共3 d。相较于假手术组,a P<0.05;相较于模型组,b P<0.05
组别假手术组模型组天麻素低剂量组天麻素中剂量组天麻素高剂量组F值P值Caspase-3 0.43±0.04 3.27±0.42a 2.48±0.31ab 2.12±0.27ab 1.43±0.21ab 74.036<0.001 Caspase-9 0.37±0.04 2.79±0.36a 2.05±0.25ab 1.76±0.20ab 1.23±0.16ab 79.203<0.001
6、大鼠脑组织中miR-155的表达
如表5所示,相较于假手术组,模型组和天麻素各剂量组大鼠脑组织中miR-155表达显著升高(均P<0.05);相较于模型组,天麻素低、中、高剂量组大鼠脑组织中miR-155表达显著降低(均P<0.05),其中天麻素高剂量组最低。
表5 各组清洁级健康雄性SD大鼠脑组织中微小RNA155的表达比较(±s,n=5)

表5 各组清洁级健康雄性SD大鼠脑组织中微小RNA155的表达比较(±s,n=5)
注:天麻素低剂量组、天麻素中剂量组、天麻素高剂量组术后1 h通过腹腔注射,进行天麻素给药(低剂量50 mg/kg、中剂量100 mg/kg、高剂量150 mg/kg),1次/d,共3 d;假手术组在手术中分离动脉,但不放置线栓、不结扎,术后注射等体积生理盐水,1次/d,共3 d;模型组术后注射等体积生理盐水,1次/d,共3 d。相较于假手术组,a P<0.05;相较于模型组,b P<0.05
组别假手术组模型组天麻素低剂量组天麻素中剂量组天麻素高剂量组F值P值微小RNA155 1.00±0.00 2.64±0.27a 2.15±0.18ab 1.97±0.16ab 1.63±0.15ab 60.930<0.001
7、大鼠脑组织中Notch1、Jagged1、Hes1的表达
如表6、图3所示,相较于假手术组,模型组大鼠脑组织中Notch1、Jagged1、Hes1表达差异均无统计学意义(均P>0.05),天麻素各剂量组Notch1、Jagged1、Hes1表达显著升高(均P<0.05);相较于模型组,天麻素低、中、高剂量组大鼠脑组织中Notch1、Jagged1、Hes1表达显著升高(均P<0.05),其中天麻素高剂量组最高。

图3 各组清洁级健康雄性SD大鼠脑组织中Notch1、Jagged1、Hes1的表达;A为假手术组,B为模型组,C为天麻素低剂量组,D为天麻素中剂量组,E为天麻素高剂量组
表6 各组清洁级健康雄性SD大鼠脑组织中Notch1、Jagged1、Hes1的表达比较(±s,n=5)

表6 各组清洁级健康雄性SD大鼠脑组织中Notch1、Jagged1、Hes1的表达比较(±s,n=5)
注:天麻素低剂量组、天麻素中剂量组、天麻素高剂量组术后1 h通过腹腔注射,进行天麻素给药(低剂量50 mg/kg、中剂量100 mg/kg、高剂量150 mg/kg),1次/d,共3 d;假手术组在手术中分离动脉,但不放置线栓、不结扎,术后注射等体积生理盐水,1次/d,共3 d;模型组术后注射等体积生理盐水,1次/d,共3 d。相较于假手术组,a P<0.05;相较于模型组,b P<0.05
组别假手术组模型组天麻素低剂量组天麻素中剂量组天麻素高剂量组F值P值Notch1 0.32±0.07 0.42±0.09 0.77±0.13ab 0.84±0.16ab 0.95±0.18ab 21.459 0.001 Jagged1 0.27±0.06 0.38±0.06 0.68±0.10ab 0.73±0.15ab 0.87±0.16ab 24.169<0.001 Hes1 0.35±0.06 0.43±0.07 0.81±0.12ab 0.93±0.15ab 1.07±0.17ab 33.283<0.001
讨 论
在我国,脑卒中的发病率正逐年攀升,它具有高复发、高致残、高致死的特点,关于该病的防治和预后判断仍有许多问题需要探讨。研究发现,脑卒中的发病原因主要是由于脑组织血液局部供应障碍导致的脑组织缺氧性坏死,进而诱发神经系统功能缺损[9]。在Papagianni等[10]的研究中,急性缺血性卒中患者会出现占位性脑水肿。Si等[11]建立大鼠脑动脉栓塞缺血性脑卒中模型用以探究6 h内溶栓对缺血性脑卒中急性脑梗死的影响。本研究构建的缺血性脑卒中模型与假手术组相比,大鼠神经功能受损严重,脑含水量、脑梗死率显著上升,表明模型构建成功,并在此基础上进行后续实验。
天麻素是兰科植物天麻提取物中的有效成分。Li等[12]研究发现,天麻素/PU膜可增强神经突延伸,上调脑源性神经营养因子和胶质细胞源性神经营养因子的表达。Jiao等[13]研究发现,天麻素抑制2,3,7,8-四氯二苯并对二噁英处理星形胶质细胞诱导的PC12神经元细胞凋亡。Li等[14]研究发现,天麻素预处理可显著补偿缺血再灌注损伤大鼠的神经行为缺陷,减少脑梗死面积,逆转血脑屏障损伤,减轻炎性反应。Liu等[15]研究发现,天麻素能显著降低血肿溶血诱导的原代皮质神经元细胞活力和细胞凋亡,显著改善脑出血后的脑水肿和神经功能缺损,并且显著提高脑出血72 h后Bcl-2表 达,降 低Bax、活 性Caspase-3、活 性Caspase-9水平,对神经具有保护作用。Liu等[16]研究表明,天麻素通过下调Bax和上调Bcl-2抑制细胞凋亡,并且靶向β相关蛋白的形成,抑制海马神经元自噬和凋亡。在此基础上,本研究探讨了天麻素对脑卒中大鼠的作用,发现天麻素可显著降低脑卒中大鼠神经功能受损程度、脑含水量、脑梗死率以及Caspase-3、Caspase-9活性,并且大鼠海马CA1区神经元细胞数目较模型组有所增加,细胞排列相对紧密,边界较为清晰。这提示天麻素对脑卒中大鼠具有神经保护作用,进一步丰富了天麻素的药理作用。
Notch通路由Notch受体、配体和DNA结合蛋白-CSL构成,在神经前体细胞增殖、神经元分化中起关键的调控作用[17-18]。Notch1主要表达于神经干细胞或神经前体细胞,Jagged1则主要表达于邻近的神经元和神经胶质细胞。Notch受体与配体结合则激活Notch通路。Wang等[19]研究表明,Notch信号缺失模型中存在miR-155表达上调。Wang等[20]的研究提示,活性Notch信号有助于卒中后神经功能缺损恢复。Liu等[21]研究表明,Notch信号有助于脑卒中后血管生成,促进缺血区血供恢复。本研究结果显示,天麻素可显著下调脑卒中大鼠脑内miR-155表达,显著上调Notch1、Jagged1、Hes1的表达;提示天麻素对脑卒中大鼠的神经保护作用可能是通过miR-155介导的Notch通路实现的。
综上所述,天麻素可能通过下调miR-155的表达,激活Notch通路,从而对脑卒中大鼠发挥神经保护作用。本研究后续实验将在此基础上,进一步阐明天麻素对脑卒中的临床价值。
利益冲突 所有作者均声明不存在利益冲突

