曲面响应法优化核桃雄花多酚提取工艺及其组成与抗氧化活性分析
王纪辉,曾亚军,侯娜*,耿阳阳*,胡伯凯,刘亚娜,张时馨,杨光
(1贵州省林业科学研究院核桃研究所,贵州贵阳 550005;2贵州阳光食品有限公司,贵州毕节 551600)
0 引言
【研究意义】核桃雄花别名核桃絮、长寿菜和龙须菜,鲜嫩的核桃雄花可烹饪食用,经炒制后具有清香气味、口感鲜嫩清脆(张文娥等,2016;张俊丽等,2018)。核桃雄花资源丰富,是一种亟待开发的天然营养保健食品资源,开发利用前景广阔(胡大佐等,2020)。目前大量核桃雄花被当作废弃物烧毁,或堆放于耕地以腐烂,加之日晒雨淋、引起土地酸化,造成严重环境问题(张柳婷等,2021);核桃雄花富含多酚和矿物元素,这些活性物质未得到合理利用,造成很大的资源浪费(韩本勇和任英,2014;胡伯凯等,2018)。因此,探索核桃雄花中多酚物质提取及其特性,对核桃雄花的资源化开发利用具有一定意义。【前人研究进展】核桃雄花序富含钾(K)和钠(Na),在维持机体酸碱平衡方面有重要作用(樊建等,2000)。铁(Fe)、锰(Mn)、锌(Zn)、硒(Se)及β-胡萝卜素等可参与人体蛋白质、碳水化合物、脂肪代谢等过程(俞秀玲和侯小玲,2012),而多酚类物质在维持细胞正常功能、清除自由基、抗氧化等方面作用突出(Shi et al.,2005;Porto et al.,2013;孔 方 南 等,2020)。樊建等(2000)研究pH、温度和3种阳离子溶液对核桃雄花序蛋白质提取率的影响,发现核桃雄花序蛋白质在碱性溶液中抽提率较大、在酸性溶液中最小,温度对其影响不明显,Na+和K+溶液中的抽提率明显大于Ca2+溶液。核桃雄花序采摘或落地后外表极易氧化而呈深黑色,属天然黑色素提取原料之一,余晓焕等(2007)研究核桃花中黑色素提取工艺,结果显示固液比1∶150、提取时间1.5 h、提取级数一级时,提取率可达28.96%,色价为48.08。贾忠(2008)采用重结晶、硅胶柱层析和聚酰胺柱层析等方法从核桃雄花序中分离纯化得到13种化合物,采用现代波谱技术鉴定了10种化合物。汪海波等(2008)发现核桃雄花序有一定的抗氧化活性,乙酸乙酯提取物对1,1-二苯基-2-三硝基苯肼自由基(DPPH·)清除作用优于叔丁基-4-羟基茴香醚(BHA)。王长雷等(2015)优化得到核桃雄花中多酚提取工艺:料液比1∶30、甲醇体积分数30%、温度70℃、时间70 min,雄花多酚提取率为2.63%。漂烫可有效钝化氧化酶活性,便于干制(Zheng and Lu,2011),张文娥等(2017)研究发现,随漂烫时间延长,核桃雄花的多酚和总黄酮含量明显降低,抗氧化能力也随之下降。陈静等(2019)研究发现盛果期铁核桃雄花的常规营养成分、矿质营养及氨基酸含量高于初果期雄花,但初果期雄花生物活性物质含量高,抗氧化能力较强。【本研究切入点】传统的溶剂浸提法提取时间较长,通常超1.0 h,多酚提取率较低,而超声提取是利用超声波作用于介质(Ghitescu et al.,2015;Saini et al.,2019),使植物细胞壁及整个生物体在瞬间破裂,缩短破碎时间(Bochi et al.,2014;Mojzer et al.,2016),同时超声波产生的振动作用加强胞内物质的释放、扩散和溶解,从而显著提高提取效率(d’Alessandroa et al.,2012;Wong Paz et al.,2015)。近年来,植物多酚的抗氧化活性受到国内外学者的广泛研究(Xiong et al.,2017),但针对核桃雄花中活性成分多酚超声提取工艺优化及其抗氧化活性分析鲜见报道。【拟解决的关键问题】以干燥核桃雄花为原料,探讨料液比、提取时间、乙醇体积分数、提取温度和超声功率等参数对雄花多酚提取率的影响,采用多元二次回归方程对提取工艺参数进行优化拟合,确定较佳提取条件,并对提取的雄花多酚抗氧化活性进行研究,以期为核桃雄花的开发利用提供技术支持。
1 材料与方法
1.1 试验材料
泡核桃雄花于2020年4月中旬采自贵州省核桃研究所良种基地。多酚单体标准品(色谱级)和福林酚购自上海源叶生物科技有限公司;无水乙醇和甲醇购自天津市富宇精细化工有限公司;浓盐酸购自重庆川东化工(集团)有限公司;无水碳酸钠购自天津市永大化学试剂有限公司;2,6-二叔丁基对甲酚(BHT)购自上海阿拉丁生化科技股份有限公司;L(+)-抗坏血酸、三羟甲基氨基甲烷、焦性没食子酸和水杨酸购自天津市科密欧化学试剂有限公司;30%过氧化氢和硫酸亚铁购自成都金山化学试剂有限公司,以上试剂均为国产分析纯。
主要仪器设备:MS104TS电子天平[梅特勒—托利多仪器(上海)有限公司]、KQ-500DE浴槽式数控超声波清洗器(昆山市超声仪器有限公司)、L5S紫外可见分光光度计(上海仪电分析仪器有限公司)、3-18R台式高速冷冻离心机(湖南可成仪器设备有限公司)、XH-C旋涡混合器(金坛市白塔新宝仪器厂)、LGJ-22系列冷冻干燥机[四环福瑞科仪科技发展(北京)有限公司]、101-2A型电热鼓风干燥箱(天津市泰斯特仪器有限公司)、HH-S型水浴锅(常州翔天实验仪器厂)、RE-52AA旋转蒸发器(上海亚荣生化仪器厂)、EM-30台式扫描电镜(库赛姆)、ETD-900M小型离子溅射仪(北京意力博通技术发展有限公司)、U3000高效液相色谱仪(赛默飞世尔科技公司)和HP6890/5975C GC/MS联用仪(美国安捷伦公司)。
1.2 试验方法
1.2.1 核桃雄花样品制备将新鲜核桃雄花置于-40℃真空冷冻干燥机中干燥30 h,在硅胶干燥器中冷却至室温,采用多功能粉碎机粉碎,过60目筛备用。
1.2.2 影响因素试验.以乙醇溶液作提取剂,考察料液比、提取时间、乙醇体积分数、提取温度和超声功率对核桃雄花多酚提取率的影响,其中设料液比1∶20、1∶40、1∶60、1∶80和1∶100(g/mL,下同),提取时间10、20、30、40和50 min,乙醇体积分数10%、30%、50%、70%和90%,提取温度20、30、40、50和60℃,超声功率200、250、300、350和400 W,以多酚提取率作评价指标。
1.2.3 没食子酸标准曲线绘制和多酚提取率计算参考梁杏(2016)的方法,略有改动,采用Folin-Ciocaileu比色法,称取核桃雄花粉末0.2 g,按照料液比1∶60加入提取液置于浴槽式数控超声波清洗器中,200 W下提取20 min,取出,8000 r/min离心5 min,取上清液。吸取1.0 mL上清液放入试管中,加入蒸馏水将上清液稀释至一定比例,取1.0 mL上清液测定其吸光值,根据标准曲线方程y=0.0103c+0.0196,计算多酚提取率。
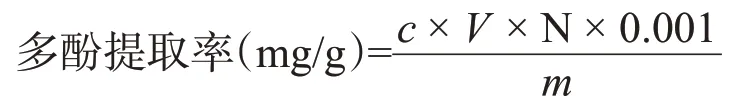
式中,y为吸光值,c为样品多酚浓度(μg/mL),V为提取液总体积(mL),N为稀释倍数,m为样品质量(g)。
1.2.4 多元二次回归方程模型.基于单因素试验及显著性分析结果,选取料液比、提取时间、乙醇体积分数和提取温度4个因素,以多酚提取率为评价指标,进行试验方法设计,设计方案见表1。

表1 试验因素与水平Table 1 Factors and levels of the test
1.2.5 核桃雄花多酚体外自由基清除对比试验核桃雄花多酚制备:称取一定质量雄花粉末,按料液比1∶40加入50%乙醇提取液,置于浴槽式数控超声波清洗器中,60℃、300 W下提取30 min,得到多酚提取液,8000 r/min离心后取上清液测定多酚含量,再配制成不同浓度梯度多酚样液备用。核桃雄花多酚、抗坏血酸及BHT浓度梯度样液均用50%乙醇溶液稀释并定容,配成所需浓度进行清除自由基试验。
1.2.5 .1 对超氧阴离子的清除作用.参考杨喆等(2015)的方法并略作改动,吸取2.3 mL 0.05 mol/L Trs-HCl缓冲液(pH 8.2)于具塞试管中,分别加入1.0 mL 0.01、0.03、0.05、0.07、0.09和0.11 mg/mL多酚待测液及1.0 mL 5 mmol/L邻苯三酚溶液,混匀置于室温下反应20 min,加入2滴浓盐酸终止反应,多酚待测液在420 nm处测的吸光值为A。以超纯水代替样本溶液测的吸光值为A0,以超纯水代替邻苯三酚溶液测的吸光值为A1,核桃雄花多酚的超氧阴离子清除率按下式计算:
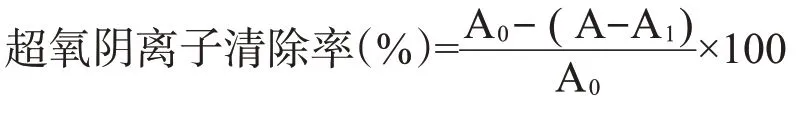
1.2.5 .2 对羟基自由基的清除作用采用水杨酸法测定。吸取1.5 mL 0.1、0.2、0.3、0.4、0.5和0.6 mg/mL多酚待测液,依次加入2.0 mL 6 mmol/L FeSO4、2.0 mL 6 mmol/L水杨酸—乙醇溶液和2.0 mL 6 mmol/L H2O2溶液,混匀置于37℃水浴中反应30 min,多酚待测液在510 nm处测的吸光值为A。以超纯水代替样本溶液测的吸光值为A0,以超纯水代替H2O2溶液测的吸光值为A1,核桃雄花多酚的羟基自由基清除率计算公式(王新然,2019)如下:
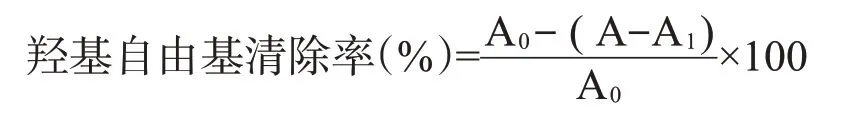
1.2.6 核桃雄花多酚物质分析鉴定
1.2.6 .1 样品溶液制备.取核桃雄花粉末3.5 g置于250 mL锥形瓶中,加入100 mL 50%甲醇水溶液,置于浴槽式数控超声波清洗器中,50℃、300 W下提取30 min,重复提取2次,合并提取液。提取液经8000 r/min离心10 min,上清液在65℃下减压浓缩至膏状后用10.0 mL 50%甲醇超声辅助溶解,离心10 min,上清液置于10 mL容量瓶中,定容,即为多酚提取液,置于-4℃冰箱中冷藏备用(可保存7 d)(史斌斌等,2017)。多酚提取液用0.22 μm亲水滤膜过滤,置于1.5 mL进样瓶中,放入自动进样器中。
1.2.6 .2 检测条件.色谱柱为CAPCELL PAK C18,流动相为0.8%乙酸溶液(A相)、色谱甲醇(B相),进样量5 μL,流速0.9 mL/min。对照品没食子酸、儿茶素、绿原酸、香草酸、咖啡酸、丁香酸、表儿茶素、丁香醛、对香豆素和阿魏酸采用洗脱程序1,芦丁、杨梅素、胡桃醌和槲皮素采用洗脱程序2。其中,洗脱程序1为柱温30℃,波长280 nm(洗脱梯度:0~10 min,10%~20% B;10~30 min,20%~50% B;30~40 min,50% B;40~41 min,50%~100% B;41~50 min,100% B;50~51 min,100%~10% B;51~60 min,10% B);洗脱程序2为柱温25℃,波长251 nm(洗脱梯度:0~10 min,10%~40% B;10~25 min,40%~60%B;25~35 min,60%~80% B;35~36 min,80%~100%B;36~46 min,100% B;46~47 min,100%~10% B;47~57 min,10% B)。
1.2.7 微观结构观察.采用Scanning electron microscope(SEM)对超声处理前后的核桃雄花粉末进行表观形貌观察。在样品台贴上双面胶,双面胶上均匀放置少量样品,吹去多余样品,喷金处理,再利用SEM进行扫描观察、拍照(李明娟等,2021)。
1.3 统计分析
采用Excel 2007整理数据,Origin 9.1制图及相关分析,以SPSS 19.0对试验数据进行ANOVA分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 料液比对核桃雄花多酚提取率的影响.由图1可知,料液比在1∶20~1∶40和1∶60~1∶100时,随着溶剂用量的增大,核桃雄花多酚提取率显著提高(P<0.05,下同),料液比在1:40~1:60时多酚提取率显著下降,可能是溶剂用量继续增大致使部分脂溶性杂质渗出,阻碍多酚扩散、渗透;料液比为1∶100时,多酚提取率达最大值(17.91 mg/g);料液比为1∶40和1∶80时,多酚提取率较大,且料液比1∶40与1∶80、1∶80与1∶100之间多酚提取率差异不显著(P>0.05,下同),加之溶剂用量太大不利于后续多酚提纯,所以在料液比为1∶40时核桃雄花多酚提取更经济。

图1 不同料液比对核桃雄花多酚提取率的影响Fig.1 Effects of different solid to liquid ratios on polyphenol extraction yield from walnut male flowers
2.1.2 提取时间对核桃雄花多酚提取率的影响由图2可知,随着提取时间的延长,核桃雄花多酚提取率显著提高,在30 min时达最大值(20.23 mg/g),30 min后多酚提取率逐渐降低。30 min与10、20、50 min相比多酚提取率分别显著提高28.76%、19.69%和18.64%,但与40 min多酚提取率间无显著差异,多酚提取率增幅为9.36%。由于提取时间为30 min时,雄花多酚溶出已达饱和状态,且多酚易受外界环境的影响而较易发生氧化,因此本研究选择提取时间为30 min。
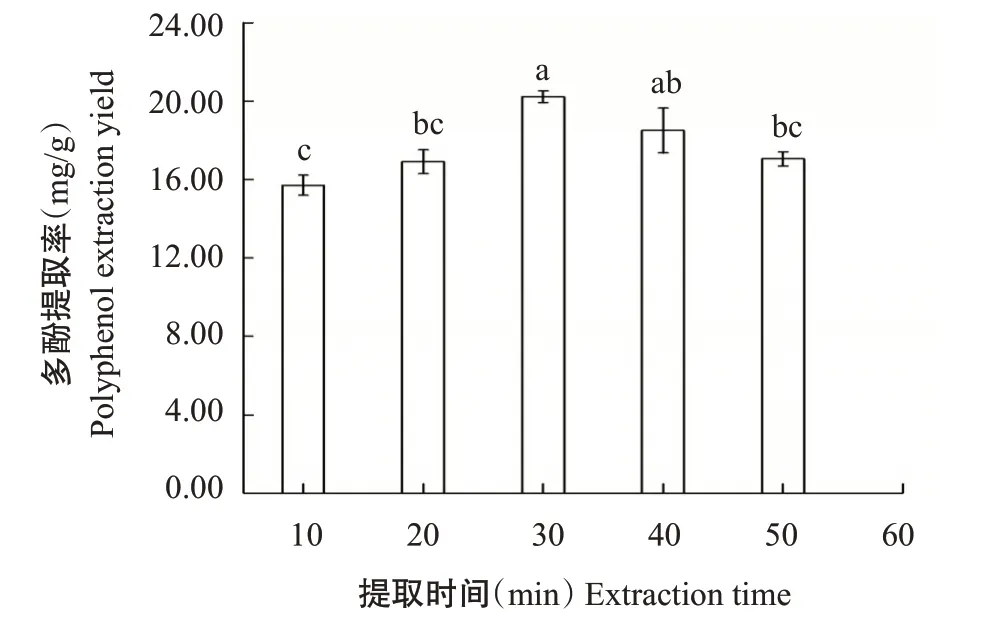
图2 不同提取时间对核桃雄花多酚提取率的影响Fig.2 Effects of different extraction times on polyphenol extraction yield from walnut male flowers
2.1.3 乙醇体积分数对核桃雄花多酚提取率的影响.由图3可知,乙醇体积分数为10%~50%时,核桃雄花多酚提取率随乙醇体积分数的增大而升高,在乙醇体积分数为50%时,雄花多酚提取率达最高值(16.67 mg/g);乙醇体积分数为50%~90%时,增大乙醇体积分数,多酚提取率逐渐降低。乙醇体积分数为50%时,多酚提取率较乙醇体积分数10%、30%和90%分别显著增加68.80%、36.55%和103.17%,较乙醇体积分数70%的多酚提取率增加15.22%,但二者差异不显著。随着乙醇体积分数不断增大,溶液极性逐渐减小,当乙醇水溶液与提取物极性相近时,核桃雄花多酚提取率达最大值,因此本研究选择乙醇体积分数为50%。
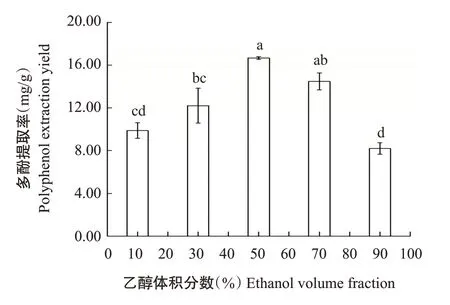
图3 不同乙醇体积分数对核桃雄花多酚提取率的影响Fig.3 Effects of different ethanol volume fraction on polyphenol extraction yield from walnut male flowers
2.1.4 提取温度对核桃雄花多酚提取率的影响由图4可知,提取温度为20~40℃时,核桃雄花多酚提取率随提取温度的升高而逐渐增加,但变化不显著;提取温度为40~50℃时,多酚提取率随提取温度的升高而显著增加;提取温度为50~60℃时,多酚提取率趋于平缓,增加不显著;核桃雄花多酚提取率在提取温度为60℃时达最大值(21.94 mg/g)。温度升高能加快多酚溶出,然而温度过高,杂质浸出会增多,且黄酮类物质不耐高温,致使有效成分溶出减少,因此,本研究将提取温度设定为55℃。

图4 不同提取温度对核桃雄花多酚提取率的影响Fig.4 Effects of different extraction temperatures on polyphenol extraction yield from walnut male flowers
2.1.5 超声功率对核桃雄花多酚提取率的影响由图5可知,超声功率为200~350 W时,核桃雄花多酚提取率随超声功率增大而逐渐增加,其中超声功率在200~300 W和250~350 W范围内时,多酚提取率增加不显著;超声功率在350~400 W范围内时,多酚提取率逐渐降低,但变化不显著。超声功率为350 W时,核桃雄花多酚提取率最高(19.25 mg/g),但与超声功率为250、300和400 W时的多酚提取率差异不显著,因此,本研究选择超声功率为300 W。
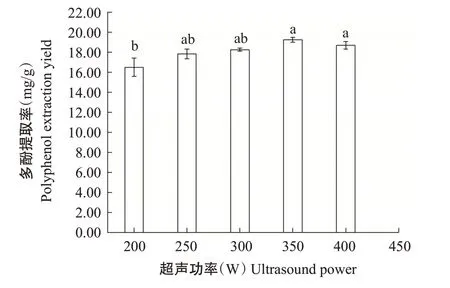
图5 不同超声功率对核桃雄花多酚提取率的影响Fig.5 Effects of different ultrasound powers on polyphenol extraction yield from walnut male flowers
2.2 核桃雄花多酚提取工艺多元二次回归方程拟合结果
在单因素试验结果的基础上,确定超声功率为300 W,以料液比(X1)、提取时间(X2)、乙醇体积分数(X3)和提取温度(X4)为影响因素,以多酚提取率(Y)为考察指标,采用多元二次回归方程进行拟合,结果见表2。试验结果经多元二次回归方程拟合,得到核桃雄花多酚提取率(Y)与4个自变量之间的四元二次回归方程模型:Y=22.02+0.75X1+0.18X2+0.15X3+0.49X4-0.41X1X2-0.64X1X3+0.19X1X4-0.022X2X3+0.28X2X4-0.35X3X4-2.26X12-1.51X22-0.69X32-0.86X42;经方差分析,模型(P<0.0001)极显著,失拟度(P=0.8247>0.05)不显著,说明该模型切实可行;由F、P及显著性水平差异可知,4因素对核桃雄花多酚提取率的影响排序为:X1>X4>X2>X3。一次项X1和X4、交互项X1X3及二次项X12、X22、X32和X42对核桃雄花多酚提取率的影响达极显著水平(P<0.01,下同);二次项X1X2对核桃雄花多酚提取率的影响达显著水平。此外,回归方程模型的变异系数为1.86%<10%,表明多酚提取率变异中仅1.86%不能由该模型解释,试验可靠性高,重复性好。回归方程模型的相关系数R2=0.9665,说明试验值与预测值拟合较好。
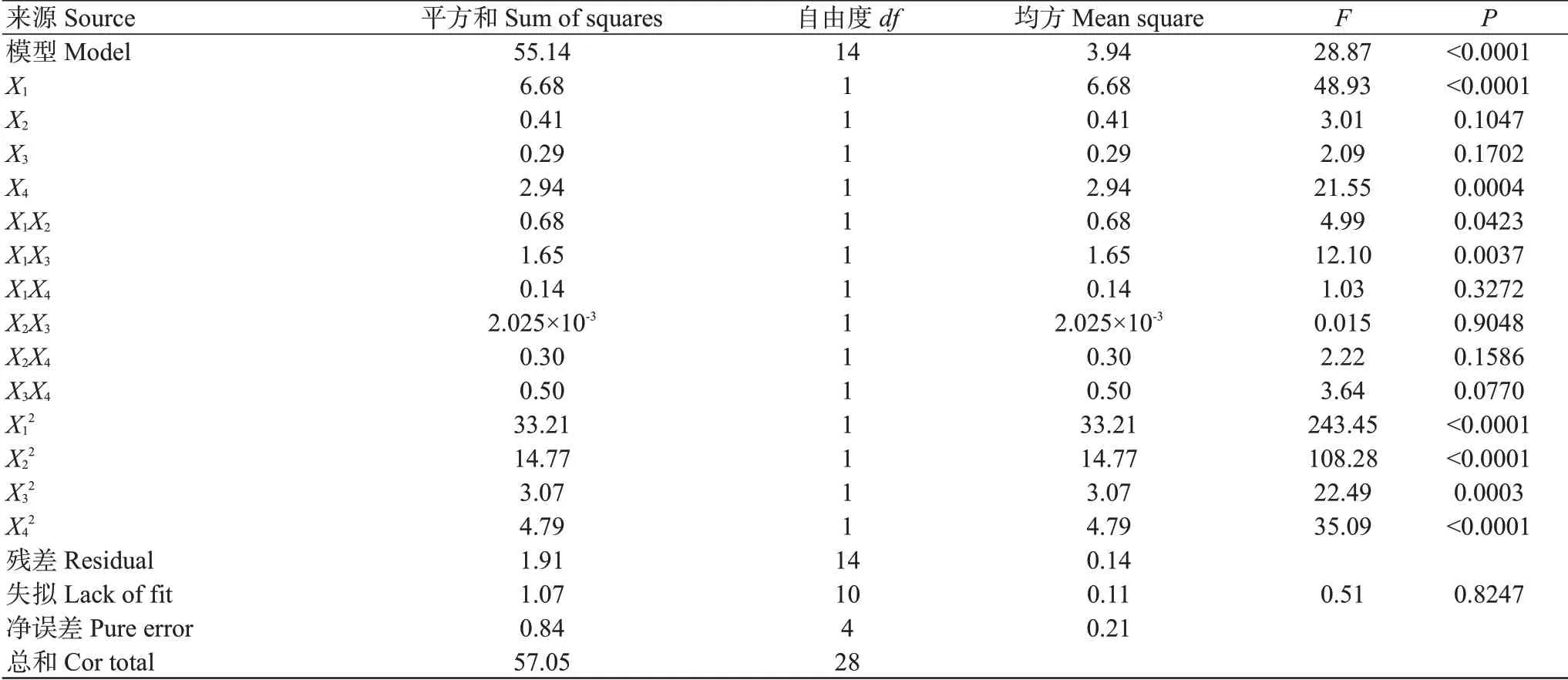
表2 回归模型的方差分析结果Table 2 Analysis of variance for regression model
通过多元二次回归方程模型预测分析,并将得到的提取工艺参数进行修正,得出核桃雄花多酚提取优化条件为:料液比1∶41、提取时间30 min、乙醇体积分数50%、提取温度52℃,理论提取率为22.17 mg/g,通过试验验证模型预测结果的准确性,得到核桃雄花多酚提取率为21.32 mg/g,与理论值相对误差为3.83%,说明多元二次回归方程能较好模拟和预测核桃雄花多酚提取率,进而证明提取技术参数的可行性,表明建立的回归模型准确可靠、重复性好,优化设计方案切实可行。
2.3 核桃雄花各影响因素相关分析结果
由图6可知,料液比与提取温度、超声功率之间均表现出正相关,但相关性不显著,相关系数均为0.83,说明料液比对核桃雄花多酚提取率的影响变化与提取温度、超声功率较一致;提取时间与乙醇体积分数、超声功率呈正相关,但相关性也不显著,相关系数分别为0.86和0.60,表明提取时间与乙醇体积分数的互相作用对核桃雄花多酚提取率的影响强于提取时间与超声功率的互相作用;提取温度与超声功率之间呈正相关,相关系数为0.84,表明不同提取温度与超声功率处理核桃雄花,其多酚提取率走向变化较相似,二者互作对核桃雄花多酚提取率有较大的影响。综上可知,在核桃雄花多酚提取过程中,多酚的溶出率不只是受单一因素的影响,而是影响因素之间互相作用的结果。
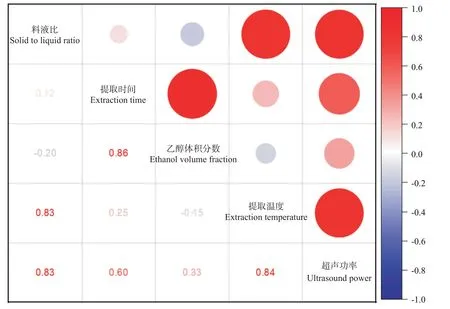
图6 各影响因素相关分析Fig.6 Correlation analysis of the influencing factors
2.4 核桃雄花多酚物质种类及含量
由图7可知,从核桃雄花中共鉴定出4种单体酚,分别是没食子酸、绿原酸、芦丁和槲皮素,其中芦丁含量最高,为804 μg/g,绿原酸含量(181 μg/g)次之,槲皮素含量(41 μg/g)较低,没食子酸含量最低,仅为18 μg/g;芦丁含量分别是绿原酸、槲皮素和没食子酸含量的4.44倍、19.61倍和44.67倍,且差异均达极显著水平;绿原酸含量分别是槲皮素和没食子酸含量的4.41倍和10.06倍,差异均达极显著水平;槲皮素与没食子酸含量之间差异达显著水平。
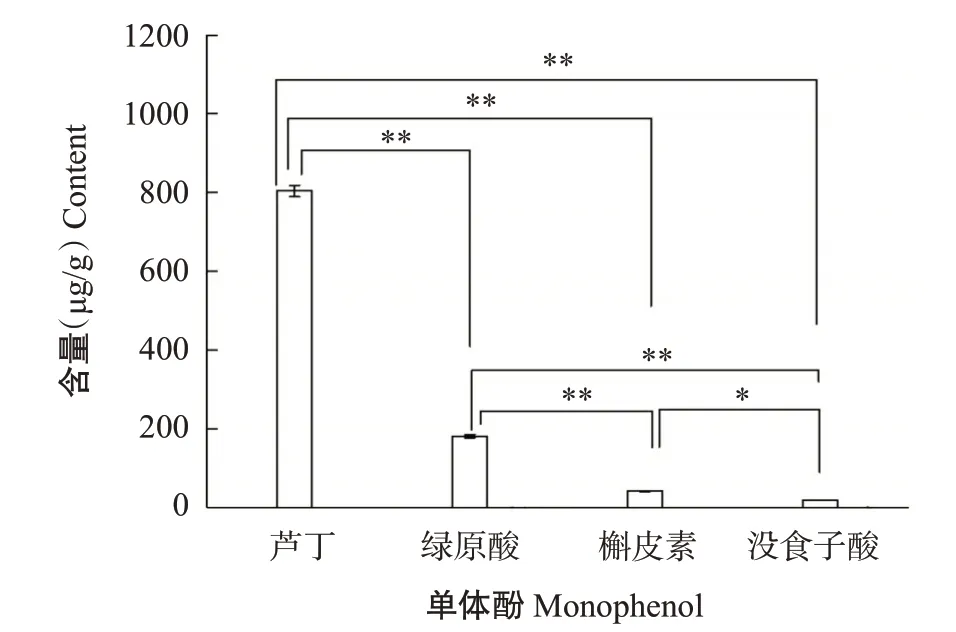
图7 核桃雄花中单体酚含量Fig.7 Monophenol content in walnut male flowers
2.5 核桃雄花多酚体外自由基清除试验结果
2.5.1 超氧阴离子清除效果由图8可知,核桃雄花多酚、抗坏血酸和BHT对超氧阴离子清除效果显著,三者对超氧阴离子清除率均随浓度升高呈逐渐增加趋势;就抗氧化能力强弱而言,抗坏血酸最强,核桃雄花多酚次之,BHT最弱。雄花多酚浓度为0.11 mg/mL时,超氧阴离子清除率达42.37%,较浓度为0.01和0.03 mg/mL的清除率分别显著提高33.03%和12.35%,较浓度为0.05、0.07和0.09 mg/mL的清除率分别提高7.33%、6.00%和3.98%,但差异不显著;抗坏血酸清除超氧阴离子能力最强,抗坏血酸浓度为0.11 mg/mL时,超氧阴离子清除率接近70.00%;BHT清除作用较弱,浓度为0.11 mg/mL时,超氧阴离子清除率低于30.00%。
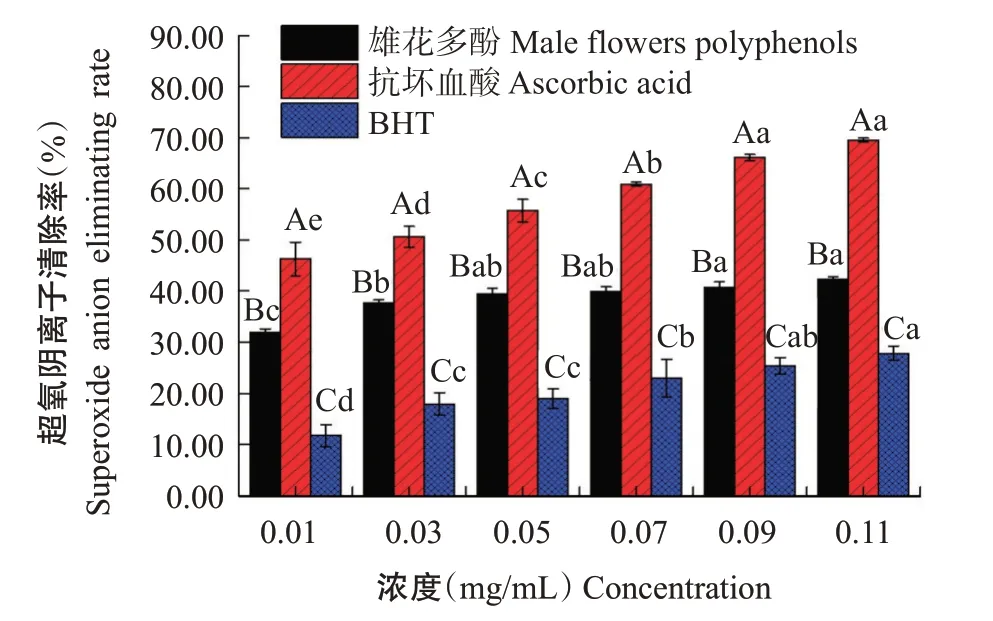
图8 核桃雄花多酚清除超氧阴离子效果Fig.8 Effects of eliminating superoxide anion of walnut male flowers polyphenols
2.5.2 羟基自由基的清除效果.由图9可知,核桃雄花多酚、抗坏血酸和BHT对羟基自由基均有一定的清除作用,表现为抗坏血酸>雄花多酚>BHT;三者对羟基自由基清除率均随浓度增大呈逐渐增加趋势。核桃雄花多酚浓度为0.6 mg/mL时,羟基自由基清除率最高,为15.06%,较浓度0.1、0.2、0.3和0.4 mg/mL的清除率分别显著提高79.94%、65.04%、31.56%和23.96%,但与0.5 mg/mL相比,清除率无显著差异,清除率增幅为14.53%;抗坏血酸浓度为0.6 mg/mL时清除率最高,接近100.00%,0.3 mg/mL时清除率已超50.00%;BHT在浓度为0.6 mg/mL时清除率也最高,但低于15.00%。

图9 核桃雄花多酚清除羟基自由基效果Fig.9 Effects of eliminate hydroxy radical of walnut male flowers polyphenols
2.6 超声处理对核桃雄花粉微观结构的影响
就100倍电镜观察而言,未经超声处理(对照组)(图10-A)和经超声处理后(处理组)(图10-C)核桃雄花均呈现大小不一的形状,其形状类似莲藕籽。就1000倍电镜观察而言,对照组核桃雄花呈方形,形状类似石头,表面有凹陷,并有片状颗粒附着其上,整个轮廓较紧实(图10-B);处理组形状类似棉花团,表面无明显片状颗粒,整个组织形态较空洞、松散(图10-D)。可见,经超声处理的核桃雄花组织结构不紧密、塌陷、较松垮,有利于组织内部的多酚物质穿过层层细胞组织进入提取溶剂(李明娟等,2021)。

图10 核桃雄花粉经超声处理前后的SEM图Fig.10 Scanning electron microscope micrographs of walnut male flower powders before and after ultrasound treatment
3 讨论
3.1 核桃雄花多酚的提取工艺
植物组织中多酚类物质通常以氢键和疏水键形式与蛋白质、多糖结合成化合物,多酚类物质分子之间也是以此种方式进行结合(方芳和王凤忠,2018)。提取溶剂如甲醇、乙醇、丙酮等有机溶剂,因能破坏多酚物质分子之间形成的氢键,进而减弱多酚分子间缔合作用,有利于多酚溶出,且不与多酚物质发生化学反应,浸出杂质少,较易分离,因此上述有机溶剂在提取植物多酚中最常用。此外,料液比、提取时间、溶剂浓度和提取温度等因素会对植物中酚类物质提取效果、植物多酚充分溶出及多酚有效成分保护产生直接影响(林建城等,2015)。本研究在确定超声功率为300 W的基础上,经多元二次方程回归得到核桃雄花多酚提取优化参数:料液比1∶41、提取时间30 min、乙醇体积分数50%、提取温度52℃,得到多酚提取率平均值为21.32 mg/g。王长雷等(2015)优化得到核桃雄花多酚类物质较佳提取工艺条件为料液比1∶30、甲醇体积分数30%、温度70℃、浸提时间10 min,核桃雄花多酚含量为6.56%,高于本研究结果,究其原因可能是提取所用溶剂类型不同。王长雷等(2015)前期研究发现甲醇较乙醇能更好地提取核桃雄花中的多酚物质,与甲醇、乙醇分子结构不同有关,可能甲醇的分子结构更有利于破坏聚合酚之间的化学键,促进聚合酚解体,此外可能与测定样品也存在关联,本研究是用整个雄花穗进行多酚提取,而王长雷等(2015)是用雄花序,雄花穗中存在的雄花粉可能会阻碍多酚渗出,致使本研究多酚提取率较低。此外,本研究采样地点为贵阳市,而王长雷等(2015)采样点为赫章县财神镇,该地海拔较高,高海拔地区可能更有利于多酚物质的积累和转化。丁建英等(2018)采用响应面法优化枇杷叶多酚工艺条件,得到较佳工艺参数为:提取温度67℃、提取时间40 min、料液比1∶25、乙醇体积分数60%,在此条件下得到枇杷叶多酚提取率为48.24 mg/g;孔方南等(2020)优化刺果番荔枝叶多酚乙醇浸提工艺,在乙醇体积分数55%、料液比1∶50、提取时间96 min、提取温度60℃的条件下,多酚提取率达20.37 mg/g。综上可见,来源不同的植物多酚采用乙醇提取的工艺存在差别、提取率也有所差异,可能与植物原料中固有的多酚含量、原料本身细胞壁厚度和通透性,以及所含的多酚种类和性质等影响因素存在密切关联(林建城等,2015)。此外,相同来源的植物原料多酚含量也存在差异,可能与浸提溶剂、提取温度、样品品种及采样地域和海拔高度等因素密切相关。
本研究中,核桃雄花多酚提取率随料液比增大呈升—降—升的变化趋势,可能是提取溶剂增大,传质动力就越大,多酚物质更容易释放溶出(汪涛等,2021),之后提取溶剂用量增加引起其他脂溶性成分溶出,与多酚产生竞争,致使多酚提取率下降;继续增大提取溶剂用量,植物组织内部液泡中极性较弱的其他酚类物质又继续溶出。核桃雄花多酚提取率随提取时间延长呈倒U型,提取前期超声产生的机械波穿透植物组织,溶剂与细胞内部浓度差促使多酚物质相继扩散溶出;多酚稳定性较差,时间过长有氧气进入参与反应,致使多酚氧化分解,此时其他杂质成分也相继溶出,进一步导致多酚提取率降低(董乐等,2020)。乙醇水溶液兼具一定的极性和非极性,能很好地将植物组织内部多酚带出,本研究中核桃雄花多酚提取率随乙醇体积分数增大呈先上升后下降的变化趋势,与赵强等(2020)研究得出随乙醇体积分数增加,藜麦糠多酚提取率先增后降的结果一致。乙醇浸提下多酚提取率呈现的这种变化与其所含酚羟基的极性相关,依据相似相溶原理,乙醇体积分数逐渐增大,溶剂极性下降,部分脂溶性成分溶出与多酚形成竞争,致使多酚提取率降低(徐萍等,2020)。温度对核桃雄花多酚提取效果影响显著,在试验设定的温度梯度范围内核桃雄花多酚提取率呈逐渐增加的变化趋势,可能原因是温度升高使溶剂分子具有足够的能量渗透进入细胞膜,多酚物质与大分子之间的氢键和疏水键遭到破坏,利于多酚溶出,多酚提取率得以提高。超声功率直接影响机械波穿透细胞的能量强弱,本研究中核桃雄花多酚提取率随超声功率增大呈先升高后略有下降的变化趋势,可能是一定范围内的超声功率促使介质质点运动加速,利于多酚物质渗出(张海容等,2019),而超声功率过大,大分子间的氢键和疏水键出现断裂,多糖及蛋白质大分子溶出,致使多酚提取率降低。
3.2 核桃雄花多酚组成及清除自由基能力
本研究从核桃雄花中测出4种单体酚,即芦丁、绿原酸、槲皮素和没食子酸。Chrzanowski等(2010)发现核桃雄花序的主要化合物为香草酸(359.5 μg/g),没食子酸含量(32.7 μg/g)最低,本研究结果与Chrzanowski等(2010)的研究结果存在差异,究其原因可能是所用样品不同;本研究采用整个雄花穗进行提取分析,Chrzanowski等(2010)仅以雄花序进行提取,然而二者均检测到绿原酸和没食子酸,本研究的没食子酸含量约为Chrzanowski等(2010)的一半,绿原酸含量较高,但本研究鉴定出的多酚种类较少,可能与样品处理方法不同有关。Pop等(2021)以40%丙酮为浸提溶剂,从核桃雄花中测出槲皮素含量为101.9 μg/g,高于本研究测定结果,可能原因是提取采用的有机溶剂不同,丙酮—水溶液较甲醇—水溶液更能兼顾槲皮素的溶解性,有待后续探索验证。
天然抗氧化剂能清除自由基,所以从植物中提取抗氧化剂植物多酚已逐渐被医药、食品及材料等领域广泛关注(Li et al.,2011),然而目前体内活性研发投入过大、耗时太长,故抗氧化活性物质研究主要以体外模拟为主。本研究结果表明,核桃雄花多酚能清除超氧阴离子和羟基自由基,在一定范围内样品浓度增加,清除能力随之增强,但其清除能力较抗坏血酸低,可能是研究提取的雄花多酚纯度较低,其中含有的杂质会对多酚类物质的共轭结构产生影响。虽然核桃雄花多酚能清除超氧阴离子和羟基自由基,但对不同自由基清除能力存在差异,是由多酚类化合物结构所决定,其羟基数量和位置直接影响抗氧化活性。柏宏伟等(2015)得出板栗雄花醇提物浓度为0.1 mg/mL时,对DPPH·清除率低于抗坏血酸;张珍林等(2020)发现霍山石斛和铁皮石斛干花均能清除DPPH·和还原铁氰化钾,但清除效果和还原能力均低于抗坏血酸,本研究结果与其具有相似之处;邢敏等(2021)研究发现杜仲雄花多酚浓度为0.1 mg/mL时,对超氧阴离子的清除率低于20%,杜仲雄花多酚浓度为0.5 mg/mL时,对羟基自由基的清除率达72.01%,而本研究发现核桃雄花多酚浓度为0.09 mg/mL时,对超氧阴离子的清除率达41.00%,核桃雄花多酚浓度为0.5 mg/mL时,对羟基自由基的清除率仅为13.15%,对超氧阴离子的清除率明显高于邢敏等(2021)的研究结果,但对羟基自由基的清除率明显低于邢敏等(2021)得出的结果,与不同原料中多酚的组成密切相关。综上,核桃雄花多酚具有一定的抗氧化能力,为其发挥抗氧化作用提供了可能。因此,下一步将开展分离和纯化核桃雄花多酚及确定有效抗氧化成分结构研究。
4 结论
多元二次回归方程模型能较好的模拟和预测核桃雄花多酚提取率,雄花多酚提取率是多种影响因素共同互相作用的复杂结果;核桃雄花富含多酚类物质,具有较强抗氧化活性,可作为天然抗氧化剂材料来源加以开发利用。

