低温驯化对菊花品种抗寒性的影响
王珂,李继东
(1商丘职业技术学院,河南商丘 476000;2河南农业大学,河南郑州 450046)
0 引言
【研究意义】菊花[Dendranthema morifolium(Ramat.)Tzvel.]是我国十大传统名花之一,同时也是世界著名的四大切花之一(李荣华等,2012)。菊花种质资源非常丰富,在我国乃至世界花卉市场中一直占据着非常重要的主导地位(孙静,2012)。我国北方地区秋冬季节天气寒冷,低温严重影响了菊花的生长、发育,其观赏价值和经济价值也大打折扣,极大地影响菊花的种植和推广。因此,研究低温条件下菊花的生理指标变化,对菊花的抗寒育种及栽培应用等均有重要意义(郭彤,2016)。【前人研究进展】菊花的抗寒性一直以来得到学者们的广泛关注。梁芳等(2010)分析了切花菊品种神马在低温弱光、偏低温弱光、临界低温弱光下净光合速率(Pn)、气孔限制值(Ls)、最大光化学效率(Fv/Fm)、初始荧光(Fo)的变化及恢复情况。Ren等(2014)指出低温会导致菊花器官非正常发育,并进一步影响菊花的生长。王翠丽等(2014)研究发现低温胁迫可以降低菊花叶片中饱和脂肪酸含量,增加不饱和脂肪酸含量。张严玮等(2014)研究发现低温胁迫条件下喷施适当浓度的氨基乙酰丙酸(ALA),可提高抗氧化酶活性,提高质膜透性,增强细胞渗透调节能力,从而提高切花菊的光合能力和抗寒性。近年来,关于低温胁迫对菊花光系统、渗透调节物质和脂肪酸含量的影响已有大量的研究,程祥飞等(2018)研究发现,在低温胁迫下,菊花叶片抗氧化酶活性大幅下降,使其缓解活性氧伤害的能力丧失。王蓓(2019)指出低温胁迫条件下,DgbZIP2基因和DgNF-YA1基因作为正调控因子,可增强菊花的抗寒性。赵鹏飞(2019)研究发现,低温胁迫使菊花叶片的光合色素含量显著降低,细胞代谢水平降低,受损程度增大。马娇等(2020)指出超声—低温破壁处理可最大程度提取和保留野生蔬菜的抗氧化活性,ABTS自由基清除试验也避免了样品溶液对DPPH自由基清除测量的光谱干扰。聂林杰等(2020)指出低温胁迫提高了菊花叶片脂肪酸去饱和酶基因表达量,促使不饱和脂肪酸质量分数增加,进而维持PSⅡ功能相对稳定。杨英楠等(2020)明确了菊花舌状花抗寒性的遗传变异,获得了抗寒性相关分子标记和抗寒材料。苗润田等(2022)指出低温胁迫下菊花叶片脂肪酸去饱和酶基因的表达量显著上调,促进细胞膜和类囊体膜脂不饱和度的增加,维持了膜的稳定性,可能在一定程度上缓解了低温对光系统造成的伤害。【本研究切入点】目前研究大多主要集中在菊花花期调控及优良品种的选育方面,针对低温胁迫方面的研究主要从生理生化方面及分子水平阐述了菊花对低温胁迫的响应机制,而低温驯化对菊花抗寒性影响的研究报道相对较少。【拟解决的关键问题】以姹紫嫣红和金龙腾云2个菊花品种为试验材料,比较在不同温度处理下2种菊花品种叶片生理生化指标的变化,探讨低温驯化对菊花品种抗寒性的影响,为菊花耐寒性种质挖掘以及新品种选育提供一定的理论依据。
1 材料与方法
1.1 试验材料
试验于2020年6—8月在河南农业大学试验基地开展,试验材料为姹紫嫣红和金龙腾云2个菊花品种,由开封市园林菊花研究所提供。所选的材料为当年生扦插苗,以草炭∶珍珠岩∶蛭石=2∶1∶1(V∶V∶V)的基质栽植于24孔穴盘中,将材料放置于人工气候室进行培养,人工气候室温度为(25±2)℃,空气湿度为(50±5)%,光照强度为36±3.6 μmol/(m2·s),光照时长为每天12 h,常规管理。待株高长至20±2 cm、叶片数达到13±1枚时,对植株进行相应的低温处理。磷酸缓冲液、氮蓝四唑、核黄素、甲硫氨酸等试剂由湖北鑫鸣泰化学有限公司生产。
1.2 试验方法
1.2.1 试验设计每个品种的幼苗均设置3个不同温度处理,即对照(CK),常温25℃;T1处理,低温驯化,先4℃处理24 h(低温驯化过程),然后-4℃处理24 h;T2处理,低温处理,-4℃处理24 h。每个处理重复3次,每个重复50株苗。处理过程中,其他环境条件不变。选取上部第4~5片长势健康的功能叶片,将样品置于锡箔纸中包好并在液氮中快速冷冻,随后将其放到-80℃超低温冰箱中贮存待用。受到冷害处理的幼苗其叶片会出现凋零状态,无法正常生长,因此试验中未对其进行生长指标测定。
1.2.2 生理指标测定.叶绿素a(Chlorophyll a,CHLA)、叶绿素b(Chlorophyll b,CHLB)和类胡萝卜素(Carotenoid,CAR)含量参照李合生(2000)的方法测定,采用80%丙酮提取;超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性参照王学奎和黄见良(2015)的方法测定。超氧阴离子()含量参照李忠光和龚明(2005)的方法进行测定;相对电导率(REC)参照郭海林等(2006)的方法测定;过氧化氢(H2O2)含量的测定参照Yin等(2010)的方法进行测定;丙二醛(MDA)含量参照王学奎和黄见良(2015)的方法测定;脯氨酸(Pro)含量参照王乾(2020)的方法测定。
1.2.3 耐冷性综合评价.采用模糊数学隶属函数法计算指标的耐冷性系数,对品种耐冷性进行综合评价(王阳等,2017)。如指标与耐冷性呈正相关,则Uij=(Xij-Xjmin)(/Xjmax-Xjmin);如指标与耐冷性呈负相关,则Uij=1-(Xij-Xjmin)(/Xjmax-Xjmin)。
式中,Uij表示i组j指标耐冷隶属值,Xij表示i组j指标耐冷性系数,Xjmax表示i组j指标最大值,Xjmin表示i组j指标最小值。
指标耐冷性系数(%)=(-4℃处理下平均测定值/对照测定值)×100。系数越高,代表越耐冷,反之不耐冷。
1.3 统计分析
试验数据采用Excel 2010和SPSS 22.0进行统计分析,显著性检验采用单因素方差分析和Duncan’s新复极差法进行。
2 结果与分析
2.1 低温驯化对菊花叶绿素含量的影响
从表1可知,经过低温驯化后,CHLA、CHLB和CAR的含量在姹紫嫣红和金龙腾云2个菊花品种叶片中均表现出下降的趋势。姹紫嫣红菊花叶片中CHLA、CHLB和CAR含量在经低温驯化后(T1处理)分别比CK下降18%、24%和14%,且分别比低温处理(T2处理)增长23%、58%和50%;经低温驯化后金龙腾云品种菊花叶片中CHLA、CHLB和CAR含量与CK相比也同样下降,分别下降17%、35%和32%,与T2处理相比分别增长38%、54%和50%。在不同处理下,2个菊花品种的CHLA和CAR含量均无显著差异(P>0.05,下同);而对于CHLB含量,2个菊花品种在CK和T1处理下表现出显著差异(P<0.05,下同),在T2处理下2个品种则无显著差异。
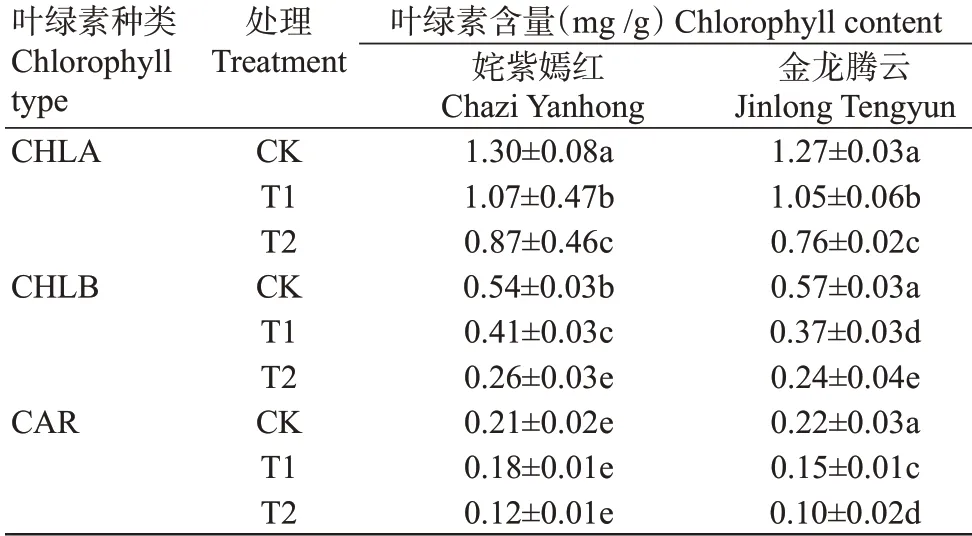
表1 低温驯化对菊花叶片叶绿素含量的影响Table 1 Effects of cold acclimation on chlorophyll content in chrysanthemum leaves
2.2 低温驯化对菊花叶片抗氧化酶活性的影响
由图1可看出,低温驯化后,姹紫嫣红叶片SOD活性呈下降趋势,而金龙腾云叶片SOD活性则表现出上升趋势。与CK相比,T1处理姹紫嫣红的叶片SOD活性未表现出显著差异,T2处理则显著下降,分别比CK和T1下降12%和8%;金龙腾云叶片SOD活性在T1与T2处理间无显著差异,但分别比CK显著上升18%和24%。
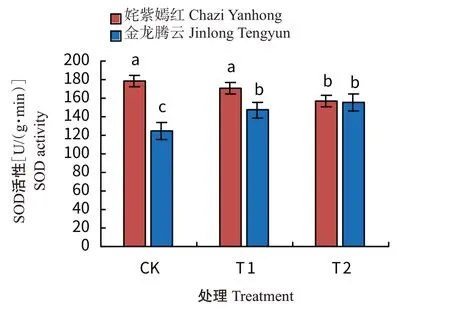
图1 低温驯化下菊花叶片SOD活性变化Fig.1 Effects of cold acclimation on SOD activity in chrysanthemum leaves
由图2可看出,2个菊花品种在3个不同温度处理过程中其叶片POD活性均表现出先下降再上升的变化趋势。在CK中,2个菊花品种的叶片POD活性均表现出最高值,且品种间差异不显著;低温驯化下,2个菊花品种叶片的POD活性均表现出最低值,且姹紫嫣红的叶片POD活性显著高于金龙腾云;低温处理下,姹紫嫣红的叶片POD活性也显著高于金龙腾云。

图2 低温驯化下菊花叶片POD活性变化Fig.2 Effects of cold acclimation on POD activity in chrysanthemum leaves
由图3可看出,2个菊花品种在3个不同温度处理中其叶片CAT活性下降的变化趋势基本一致,随着温度的降低,CAT活性表现出显著下降的趋势。与CK相比,T1和T2处理下姹紫嫣红叶片CAT活性分别降低20%和28%,金龙腾云叶片CAT活性分别降低21%和29%;3组处理下,姹紫嫣红的叶片CAT活性始终高于金龙腾云,且品种间差异显著。

图3 低温驯化下菊花叶片中CAT活性变化Fig.3 Effects of cold acclimation on CAT activity in chrysanthemum leaves
2.3 低温驯化对菊花叶片REC的影响
由图4可知,CK和T1处理下,叶片REC在2品种间均无显著差异,而在T2处理下,2个菊花品种间呈显著差异,金龙腾云的叶片REC显著高于姹紫嫣红。2个菊花品种的T1处理其叶片REC显著低于T2处理,表明经过低温驯化能明显抑制低温处理下叶片的REC。
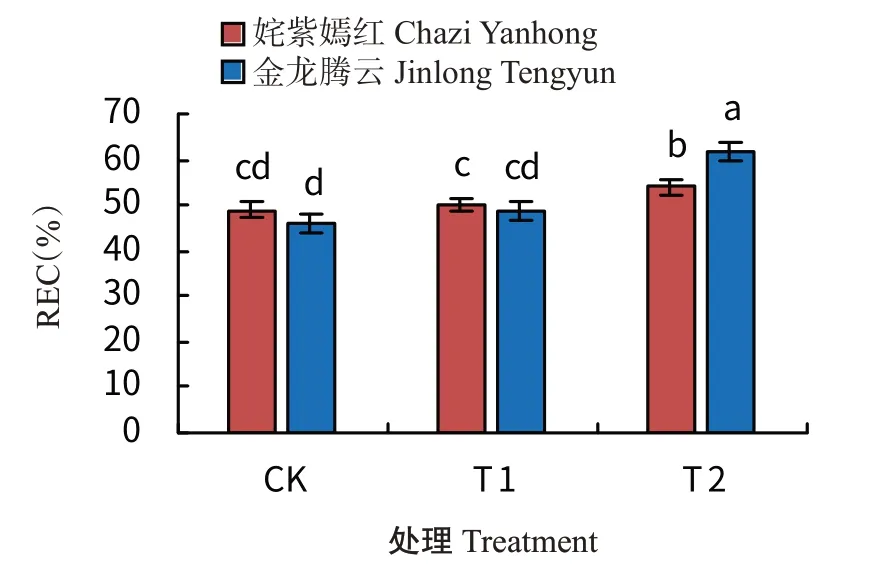
图4 低温驯化下菊花叶片REC变化Fig.4 Effects of low temperature domestication on relative electrical conductivity in chrysanthemum leaves
2.4 低温驯化对菊花叶片MDA含量的影响
从图5可看出,姹紫嫣红和金龙腾云在3种不同温度处理下,其叶片MDA含量逐渐增加的变化趋势基本一致。其中,在CK下,姹紫嫣红和金龙腾云的叶片MDA含量均表现出最低值,分别为7.86和9.83 nmol/g;在T2处理下,姹紫嫣红和金龙腾云的叶片MDA含量均表现出最高值,分别为11.24和12.19 nmol/g。随着温度的降低,菊花叶片MDA含量表现出了显著增加趋势。同时,姹紫嫣红的叶片MDA含量均表现出显著低于金龙腾云,表明在低温驯化下姹紫嫣红菊花叶片的膜脂过氧化程度相对较低。

图5 低温驯化下菊花叶片MDA含量变化Fig.5 Effects of cold acclimation on MDA content in chrysanthemum leaves
2.5 低温驯化对菊花叶片Pro含量的影响
由图6可知,随着冷胁迫的处理,2个菊花品种的叶片Pro含量均大量积累,暗示随着温度的降低增加了渗透调节物质的积累量。其中,CK下金龙腾云的叶片Pro含量比姹紫嫣红高21.38%,而经过T1和T2处理后姹紫嫣红的叶片Pro含量分别比金龙腾云高24.79%和4.65%,处理间差异均达显著差异。同时,CK下2个菊花品种叶片Pro含量均表现出最低值,且品种间差异显著;T2处理下,2个菊花品种叶片Pro含量均表现出最高值,品种间无显著差异。
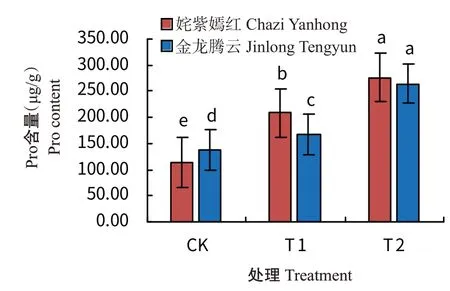
图6 低温驯化下菊花叶片Pro含量变化Fig.6 Effects of cold acclimation on Pro content in chrysanthemum leaves
2.6 低温驯化对菊花叶片H2O2及O-2含量的影响
由图7可看出,2个菊花品种在受到低温胁迫后,其叶片H2O2含量的变化趋势基本一致,随着温度的降低,叶片H2O2含量均表现出先降低后增加的趋势。在T1处理下,姹紫嫣红和金龙腾云的叶片H2O2含量均为最低值,分别为0.33和0.32 μmol/g,且品种间无显著差异;在T2处理下,2个品种的叶片H2O2含量均表现出最高值,姹紫嫣红菊花的叶片H2O2含量仅为金龙腾云的28.69%,说明低温驯化对植株起到一定的保护作用。
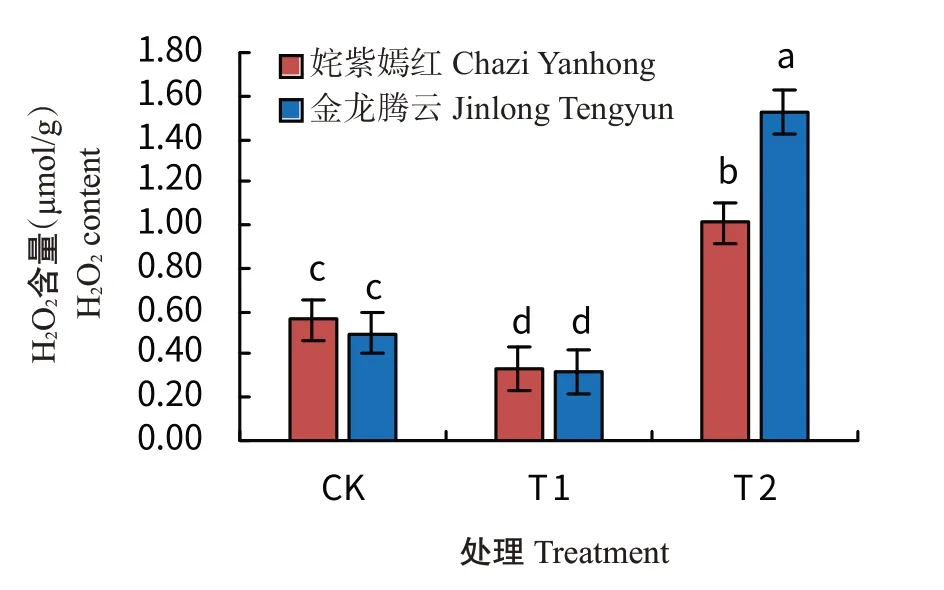
图7 低温驯化下菊花叶片H2O2含量变化Fig.7 Effects of cold acclimation on H2O2 content in chrysanthemum leaves
由图8可看出,姹紫嫣红和金龙腾云在低温胁迫下,其叶片O-2含量变化趋势基本一致,随着温度的降低,菊花叶片中O-2含量均表现出显著增加的变化趋势。其中,在CK下,姹紫嫣红和金龙腾云的叶片O-2含量均为最低值,在T2处理下,其叶片O-2含量均为最高值。在CK下,姹紫嫣红的叶片O-2含量显著低于金龙腾云,而T1和T2处理下姹紫嫣红的叶片O-2含量则显著高于金龙腾云,表明姹紫嫣红菊花品种在经过冷处理后产生更多的O-2,使得植株的耐寒性相对较差。
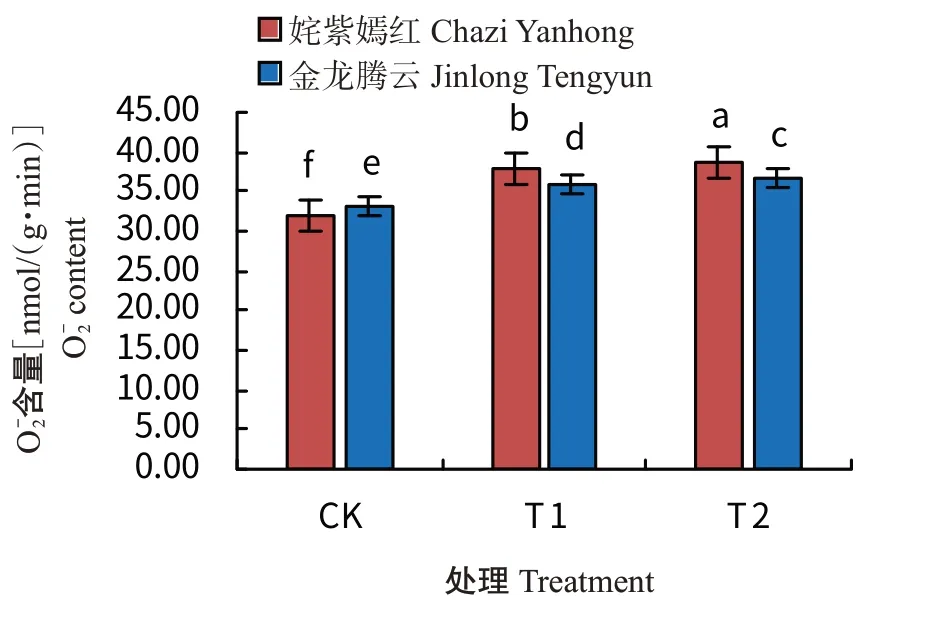
图8 低温驯化下菊花叶片O-2含量变化Fig.8 Effects of cold acclimation on O-2 content in chrysanthemum leaves
2.7 菊花生理指标间的相关分析
将2个菊花品种的11个生理指标进行相关分析,结果如表2和表3所示,2个品种的CAR与MDA含量间均达极显著负相关(P<0.01,下同)。对于姹紫嫣红菊花品种,CHLA与Pro含量呈显著负相关;CHLB含量与CAT活性呈极显著正相关;CAR含量与REC呈显著负相关;REC与MDA含量呈极显著正相关(表2)。

表2 姹紫嫣红菊花品种叶片生理指标相关分析Table 2 Correlation analysis of physiological indexes of chrysanthemum variety Chazi Yanhong
对于金龙腾云菊花品种,CHLB与CAR含量呈极显著正相关,与MDA含量呈显著负相关;SOD与CAT活性呈极显著负相关;REC与Pro含量呈显著正相关(表3)。因此,植物受到低温胁迫后,其生理变化是错综复杂的,单一化的指标并不能揭示植物的抗寒性本质。
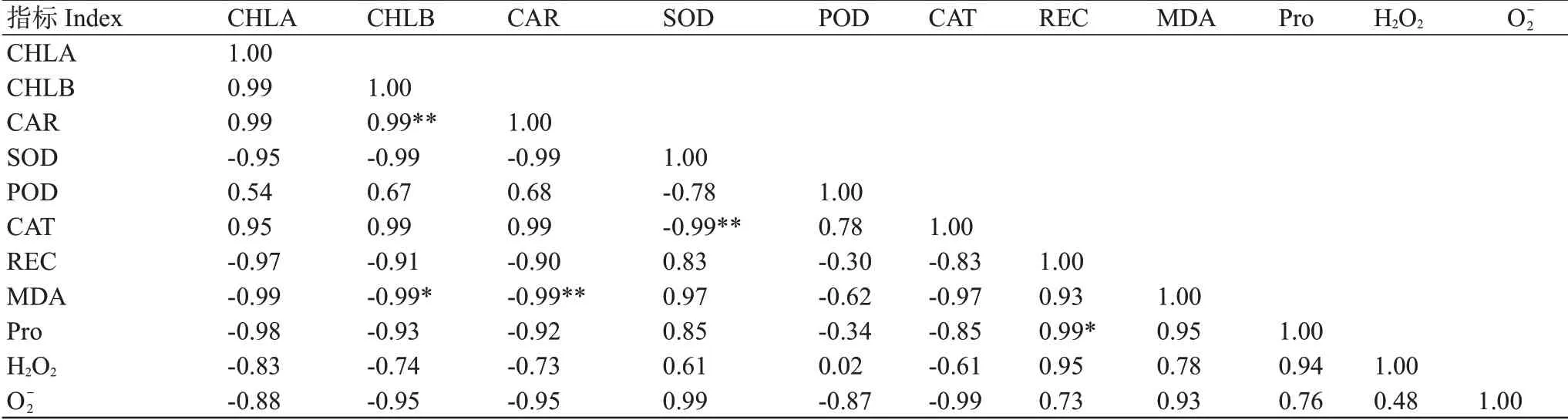
表3 金龙腾云菊花品种叶片生理指标相关分析Table 3 Correlation analysis of physiological indexes of chrysanthemum variety Jinlong Tengyun
2.8 2个菊花品种耐冷性综合评价
如果通过单一指标对低温胁迫下2个菊花品种的耐冷性进行评价,则显得不够全面,再加上不同指标值的单位不同,数值大小和变异程度也不同,因此对耐冷性系数进行无量纲化处理,消除单一指标的片面性,用隶属函数法将各品种的各耐冷指标扩展到[0,1]。姹紫嫣红和金龙腾云的各项生理指标在不同处理中的耐冷系数、隶属函数值及综合排名见表4。T1和T2处理下,隶属值平均得分均为金龙腾云>姹紫嫣红。其中,金龙腾云在T2处理下的耐冷性表 现 优 于T1处理,其隶属值为T2(0.54)>T1(0.48)。姹紫嫣红在T2处理下的耐冷性表现劣于T1处理,其隶属值为T2(0.44)<T1(0.45)。对于姹紫嫣红菊花品种来言,T1处理更能更加提高其耐冷性,对于金龙腾云而言,则以T2处理的效果更好。

表4 各项指标耐冷系数、隶属函数值及综合排名Table 4 Cold tolerance coefficient,membership function value and comprehensive ranking of each index
3 讨论
当植物受到胁迫时可能会发生一系列的生理生化反应,一些与胁迫相关的生理生化指标也会发生相应的改变(魏霞等,2015;曹群阳等,2022)。例如当温度降到-14℃时,菊花的脚芽均不能恢复生长(许瑛和陈发棣,2008)。因此,本研究中在冷胁迫处理下,通过测定分析2个菊花品种主要生理指标的变化情况,意在明确低温驯化对不同品种菊花低温胁迫的影响;通过试验,低温驯化可提高菊花的耐寒性,对比姹紫嫣红和金龙腾云在相关指标上各有优劣,总体表现上金龙腾云>姹紫嫣红,其较强的耐寒性对菊花耐寒栽培和扩大种植范围具有一定的指导作用,但是对于低温驯化后菊花的植株生长、植株叶片、花期、花色的影响还有待于进一步的研究,尤其是对于秋冬季自然状态下的低温与低温驯化后影响区别还需要深入研究。在低温驯化下叶绿素合成受阻,抑制各种光合酶活性,使得光合速率下降(郁万文,2008);自然温度条件下,姹紫嫣红和金龙腾云2个菊花品种叶片CHLA、CHLB和CAR含量的差异并不显著,而低温驯化下2个品种叶绿素含量随着温度的降低表现出下降趋势,这与前人的研究结果(赵鹏飞,2019)一致。
植物在正常的生长发育过程中产生的活性氧(ROS)量与清除ROS量相平衡;而在低温驯化下,这种动态平衡将会被打破,ROS量累积过度会对细胞造成毒害,甚至会造成膜脂过氧化,影响细胞的正常生长发育(Guo et al.,2012;王凯月等,2022)。有研究表明,SOD可清除O-2,并产生O2和H2O2;CAT能将H2O2转化为H2O和O-2;而POD不仅能清除H2O2,还与细胞的抗病能力有关(Song et al.,2014;于波,2017)。本研究中,各处理下,姹紫嫣红的叶片SOD活性均高于金龙腾云,表明姹紫嫣红本身较金龙腾云有较强的耐寒性;姹紫嫣红的叶片POD活性也均高于金龙腾云,同时H2O2的清除能力与此表现一致。随着低温胁迫程度加剧,2个品种的CAT活性随着温度降低呈现出逐渐降低趋势,且差异显著。
REC的变化可反映出细胞膜的完整性及细胞受到损伤的程度,而细胞膜的稳定性则与植物的抗逆性呈正相关关系;随着胁迫程度的加深和胁迫时间的持续延长,不同品种的植物膜相对透性逐渐增大;不同的低温胁迫对凤剑1号叶片REC明显升高(曹群阳等,2022)。本研究中,REC随着冷胁迫处理的增加而逐渐增加,姹紫嫣红和金龙腾云2个品种经过低温驯化其叶片REC显著低于低温处理,说明低温驯化降低了菊花细胞质膜受伤害的程度,对菊花具有一定的保护作用。
MDA是一种重要的膜脂过氧化作用产物,其含量用来反映膜的损伤程度。不同大叶女贞品种幼苗叶片处理时间延长,会提升MDA和可溶性糖含量(林艳等,2012)。本研究表明,随着温度的降低,姹紫嫣红和金龙腾云2个菊花品种的MDA含量则会显示出一定的升高趋势,究其原因是由于低温驯化后细胞膜系统受到一定的伤害;经过低温驯化的MDA含量均明显低于低温处理,说明低温驯化在一定程度上能降低菊花受伤害的程度,进而提高了其对低温的抵御能力。
Pro是蛋白质的组成成分之一(余琼芳,2018)。Pro不仅可作为渗透的调节物质,而且能对膜结构产生保护,防止膜脂发生过氧化现象,并能提高植物的抗逆性(Hasanuzzaman et al.,2014)。本研究中姹紫嫣红的叶片Pro含量上升幅度高于金龙腾云,从而可推断姹紫嫣红菊花品种由于Pro含量的增加,降低了水势,使植物体内的水分保持平衡,植物的抗寒性得到了提高。
当植物体在遭受到低温驯化时,植物体内会产生大量的活性氧,由于活性氧积累量的增加使得氧化胁迫在植物体内发生,与此同时就会导致植物体受到严重的氧化损伤甚至是植株死亡,而活性氧则包括H2O2和O-2等(张腾国等,2019;郭树勋等,2021)。本研究中姹紫嫣红和金龙腾云的叶片H2O2和O-2含量均根据不同温度处理而有所变化,随着温度的降低2个指标均表现出下降的趋势,说明低温驯化诱导ROS的积累,为了稳定生物膜系统,SOD与POD活性则会有所上升,与前人的研究结果一致(张续周等,2021;郭扬,2022)。
植物耐低温胁迫指标种类多样,而单一化的指标很难真实反映植物的耐低温性实质。只有通过多指标全方面解读才能确定植物的耐低温性,本研究通过对叶绿素含量、抗氧化酶活性、REC、MDA、Pro及ROS等生理指标进行相关分析,结果发现,植物耐低温性是受多种因素控制的综合性状,不同品种的耐低温机制可能不同。通过采用隶属函数法,对姹紫嫣红和金龙腾云2个菊花品种进行分析,其中以金龙腾云耐冷性表现较好,且在T2处理下表现最好,反映低温驯化处理对菊花叶片的损伤小,能起到一定的保护作用。
4 结论
低温驯化后,2个菊花品种生理特性均优于低温处理,金龙腾云比姹紫嫣红更耐冷,低温驯化对菊花叶片的机械损伤能起到一定的保护作用,降低了菊花细胞质膜受伤害的程度,进而提高菊花对低温的抵御能力。

