八角茴香水提物调控宿主免疫反应抗石斑鱼虹彩病毒的机制研究
李梦梦,韦红玲,刘明珠,3,黄帅帅,4,王太霞,黄琳*,李鹏飞,3*
(1河南师范大学生命科学学院,河南新乡 453007;2广西科学院/广西水产生物技术与现代生态养殖重点实验室/广西渔业重大疫病防控与高效健康养殖产业技术工程研究中心,南宁 530007;3广西海洋天然产物与组合生物合成化学重点实验室,广西南宁 530007;4北部湾大学海洋学院/广西北部湾海洋生物多样性养护重点实验室,广西钦州 535011)
0 引言
【研究意义】我国水域资源丰富,为渔业经济快速发展奠定了基础。2020年我国海洋渔业经济生产总值超过6.75千亿元(农业农村部渔业渔政管理局等,2021)。据统计,全球70多亿人口的动物蛋白摄入来源中15%以上是来自水产品。与畜禽动物相比,水产动物肉质更鲜嫩,且脂肪含量少,更有利于人体健康。石斑鱼作为我国与东南亚地区的大宗名贵海水养殖鱼类,其肉质细腻、蛋白含量高、脂肪含量低,具有极高的经济价值(肖贺贺等,2021)。2020年我国石斑鱼养殖产量已超过19万t,但随着养殖规模的扩大,水体养殖环境污染严重,导致病毒性疾病暴发率不断上升,严重制约着石斑鱼养殖产业的可持续发展(农业农村部渔业渔政管理局等,2021)。石斑鱼虹彩病毒(Singapore grouper iridovirus,SGIV)是一种高致病性鱼类传染性病毒,是危害石斑鱼养殖产业的主要病原之一(余庆等,2020)。SGIV在不同种类鱼群间传播迅速且致死率极高(余庆等,2019),对鱼类造血器官和组织的破坏极其严重,可使感染的鱼体出现贫血及多器官衰竭症状而死亡。因此,研发出有效抑制SGIV感染的药物对促进石斑鱼养殖产业健康发展具有重要意义。【前人研究进展】目前,抗生素等化学药物仍大量用于防治水产细菌性病害,但大量使用抗生素不仅极易造成药物残留及耐药性等问题,还会影响鱼体的免疫机能(耿毅和汪开毓,2004)。因此,迫切需要研发出绿色、健康、高效且环境友好的渔用药物。药物防治仍是控制水产疫病最主要、有效的手段(李鹏飞等,2018),已有研究证实药用植物提取物对水生病毒具有显著的抗病毒效果,且安全无害,对环境友好(李鹏飞等,2021a)。紫花地丁(Viola yedoensisMakino)为双子叶植物纲堇菜属多年生草本药用植物,其花色一般呈紫堇色或淡紫色,主产于我国广西、贵州及云南等地。紫花地丁不仅具有食用价值和观赏价值,还具有抗病毒、抗菌及抗氧化等药用价值(崔雪等,2020)。已有研究证实,紫花地丁水提物可通过干扰SGIV对宿主细胞的吸附、侵入与复制过程,而发挥抗SGIV感染的功效(Yu et al.,2019)。桑叶(Morus alba)为桑科桑属植物,其叶片一般呈卵形、宽卵形、心形等,在我国南北地区均有种植,具有抗病毒、抗菌等多种生物活性(张倩和张立华,2020)。李鹏飞等(2021b)研究表明,桑叶水提物及桑叶主要活性成分异槲皮苷能有效抑制SGIV感染,其抑制率高达99%。莪术[Curcuma zedoaria(Christm.)Rosc]为芭蕉目姜科姜黄属植物,在我国台湾、福建、江西、广东、广西、四川及云南等地均有分布,含有莪术醇、莪术二醇和姜黄素等多种天然活性成分,具有抗肿瘤、抗病毒及抗菌等药理作用(黄云峰等,2020),其有效活性成姜黄素在细胞水平及活体水平均具有良好的抗SGIV感染效果(Liu et al.,2020a)。八角茴香(Illicium verumHook.f.)为木兰科八角属的天然药用植物,主产于我国广西西部和南部地区,其果实为由八枚骨突果集成的聚合果,果皮肥厚,单瓣果实前端钝或钝尖(陈瑞生等,2011);八角茴香含有黄酮类、多糖类、萜类等天然化合物,具有抑菌、抗病毒、抗氧化、镇痛及免疫调节等药理作用(黄丽贞等,2015;Yu et al.,2018;吴玲等,2019;Hu et al.,2021)。八角茴香也是开发成天然抗氧化剂的重要资源(赵二劳等,2019)。谢冬惠(2012)、赵二劳等(2019)研究发现,八角茴香提取物具有抗氧化活性,是一种理想的天然抗氧化剂;Peng等(2016)研究表明,八角茴香提取物可激活获得性免疫反应;Yu等(2018)、Liu等(2020b)研究证实,八角茴香主要成分——槲皮素具有抗SGIV活性。【本研究切入点】至今,有关八角茴香药理作用及其抗病毒活性的研究已有较多报道(Cai et al.,2013;黄丽贞等,2015;Khan et al.,2018;Yu et al.,2018;Hu et al.,2021),但鲜见从免疫应答角度探究八角茴香抗SGIV感染的作用机制。【拟解决的关键问题】从免疫应答角度探析八角茴香水提物(IVE)调控宿主免疫反应而发挥抗SGIV的作用机制,以期为八角茴香应用于石斑鱼健康养殖产业及开发绿色、健康、高效渔用药物提供理论依据。
1 材料与方法
1.1 试验材料
供试药材八角茴香购自广西南宁一心大药房;石斑鱼脾脏细胞系(Grouper spleen cell line,GS)由广西渔业重大疫病防控与高效健康养殖产业技术工程研究中心保存提供;SGIV分离自广西人工养殖的珍珠龙胆石斑鱼(肖贺贺等,2019)。
1.2 IVE制备
将八角茴香粉碎成粉末,称取25 g浸泡于500 mL超纯水中,4℃浸泡过夜,次日将八角茴香浸泡液及药包置于锅中煎煮至100 mL,定容得到250 mg/mL的八角茴香水提物母液。经12000 r/min离心10 min,0.22 μm滤膜过滤即得到IVE,-20℃保存备用。
1.3 细胞安全浓度确定
将1×105个GS细胞接种于96孔板中,置于28℃培养箱中培养18 h。以无任何处理的GS细胞为对照组,加入不同浓度IVE为试验组,每组均设3个平行。分别在用药后24和48 h通过光学显微镜观察各组细胞的形态变化,并于48 h后弃细胞培养上清液,以磷酸缓冲液(PBS)清洗细胞,向各孔细胞中加入10 μL CCK-8溶液。室温避光孵育4 h后,采用酶标仪检测各组细胞在波长450 nm处的吸光值,计算细胞存活率。存活率计算公式如下:
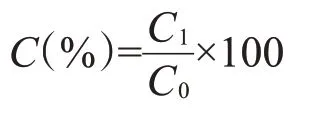
式中,C为细胞存活率(%),C1为试验组细胞吸光值,C0为对照组细胞吸光值。
1.4 IVE预处理GS细胞激活细胞免疫反应
将8×105个GS细胞接种于12孔板中,28℃培养箱培养18 h。将IVE在培养基中稀释至安全浓度后接入GS细胞中,以无任何处理的GS细胞为对照组,在28℃培养箱中继续培养,分别在用药后2和4 h收集细胞,提取总RNA。200 ng总RNA经反转录获得cDNA,然后以cDNA为模板、β-actin为内参基因,采用实时荧光定量PCR检测干扰素基因(IFN)、蛋白激酶基因(IKKα)、干扰素调节因子IRF3、转录激活因子(STAT1),以及干扰素刺激因子STING、PKR和ISG15的表达水平。实时荧光定量PCR扩增引物见表1。

表1 实时荧光定量PCR扩增引物序列信息Table 1 Information of sequence of real-time fluorescence quantitative PCR amplification primers
1.5 光学显微镜观察IVE抗SGIV效果
将8×105个GS细胞接种至12孔板中,28℃培养18 h。设2个对照组,对照组1:GS细胞不进行任何处理;对照组2:将L15培养基接入GS细胞孵育2 h后移除培养液,接入0.4 µL SGIV(106TCID50/mL)孵育2 h,然后移除培养液,以L15培养基清洗细胞2次并加入新的L15培养基。试验组GS细胞进行如下处理:以L15培养基将IVE稀释至安全浓度,接入细胞后28℃培养2 h,移除培养液,以L15培养基清洗2次,接入0.4 µL SGIV(106TCID50/mL)孵育2 h,移除培养液并以L15培养基清洗2次,再加入L15培养基。各组细胞在28℃下继续培养,分别于病毒感染后24和48 h采用光学显微镜观察各组细胞形态变化。
1.6 实时荧光定量PCR检测IVE抗SGIV活性
将8×105个GS细胞接种至12孔板中,28℃培养18 h。试验组细胞中加入以培养基稀释至安全浓度的IVE孵育2 h(对照组加入等体积的L15培养基),以L15培养基清洗细胞2次并接入0.4 µL SGIV(106TCID50/mL)孵育2 h,移除培养基,以L15培养基清洗2次,再加入L15培养基。各组细胞在28℃下继续培养,分别于病毒感染后24和48 h收集细胞,提取总RNA,200 ng RNA经反转录获得cDNA。以cDNA为模板、β-actin为内参基因,利用实时荧光定量PCR检测SGIV的MCP基因表达情况,检验IVE抗SGIV活性。每组样品均设3个平行。
1.7 IVE体外激活宿主细胞抗病毒免疫反应
采用实时荧光定量PCR检测IVE体外激活宿主细胞抗病毒免疫反应,具体操作方法同1.6。分别在病毒感染后24和48 h收集各组细胞,提取总RNA,200 ng总RNA经反转录获得cDNA。以cDNA为模板、β-actin为内参基因,利用实时荧光定量PCR检测干扰素相关基因IFN、STING、PKR、IKKα、ISG15、IRF3及STAT1的表达情况。每组样品均设3个平行。
1.8 活体水平检测IVE抗SGIV活性情况
经预试验得出IVE腹腔注射石斑鱼的安全工作浓度为4 mg/尾。选取30尾体长、体质量相近的石斑鱼,随机分为3组分别暂养于3个30 L的水缸内。对照组石斑鱼腹腔注射50 μL SGIV(106TCID50/mL),试验组石斑鱼腹腔同时混合注射4 mg/尾的IVE和50 μL SGIV。SGIV感染后24和48 h,分别采集石斑鱼脾脏组织提取总RNA,200 ng总RNA经反转录获得cDNA。以cDNA为模板、β-actin为内参基因,利用实时荧光定量PCR检测MCP基因相对表达量,分析IVE在活体水平的抗SGIV活性。每组样品均设3个平行。
1.9 统计分析
验数据使用Excel 2020对进行处理,采用SPSS 22.0的单因素方差分析比较组间差异,并以Graph-Pad Prism 7制图。
2 结果与分析
2.1 IVE细胞安全工作浓度
不同浓度IVE与GS细胞孵育48 h后,观察细胞形态变化。由图1-A可看出,与无任何处理的GS细胞相比,当IVE浓度≤0.50 mg/mL时,GS细胞正常生长,细胞形态正常;当IVE浓度≥1.25 mg/mL时,GS细胞出现不同程度的脱落、皱缩、变圆等细胞病变效应(Cytopathic effects,CPEs)。CCK-8检测结果(图1-B)与光学显微镜观察结果一致,因此确定IVE细胞水平的安全工作浓度≤0.50 mg/mL。

图1 不同浓度IVE对GS细胞的影响Fig.1 Effects of different concentrations of IVE on GS cells
2.2 IVE预处理激活宿主细胞免疫反应
IFN是一种具有免疫调节、抗病毒功能的细胞因子,在宿主抗病毒感染的先天性免疫中发挥重要作用(刘颖等,2012;张辉等,2014)。因此,在确定IVE细胞安全工作浓度后,进一步研究其对干扰素相关免疫基因表达的影响。实时荧光定量PCR检测结果(图2)显示,与对照组GS细胞相比,IVE孵育2 h后可显著(P<0.05,下同)或极显著(P<0.01,下同)上调干扰素相关基因IFN、STAT1、PKR、IKKα、IRF3及STING的表达,仅ISG15基因的表达无显著变化(P>0.05,下同);IVE孵育4 h后STING、STAT1和IRF3基因的相对表达量呈下调趋势,但仍极显著高于对照组,IFN、ISG15和PKR基因的相对表达量与对照组间无显著差异。由于IVE孵育2 h的干扰素相关基因表达量较高,故选择药物孵育2 h进行病毒感染试验。
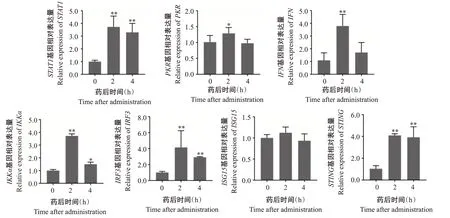
图2 IVE对GS细胞干扰素相关基因表达的影响Fig.2 Effects of IVE on expression of IFN-related genes of GS cells
2.3 IVE体外抗SGIV活性分析结果
光学显微镜观察结果(图3-A)显示,与仅接种SGIV的对照组GS细胞相比,经IVE预处理再加入SGIV感染的试验组细胞病变效应明显减少。实时荧光定量PCR检测结果(图3-B)表明,与仅接种SGIV的对照组GS细胞相比,试验组GS细胞中SGIV的MCP基因相对表达量极显著降低,故推测IVE通过抑制MCP基因表达而实现抗SGIV感染的效果。
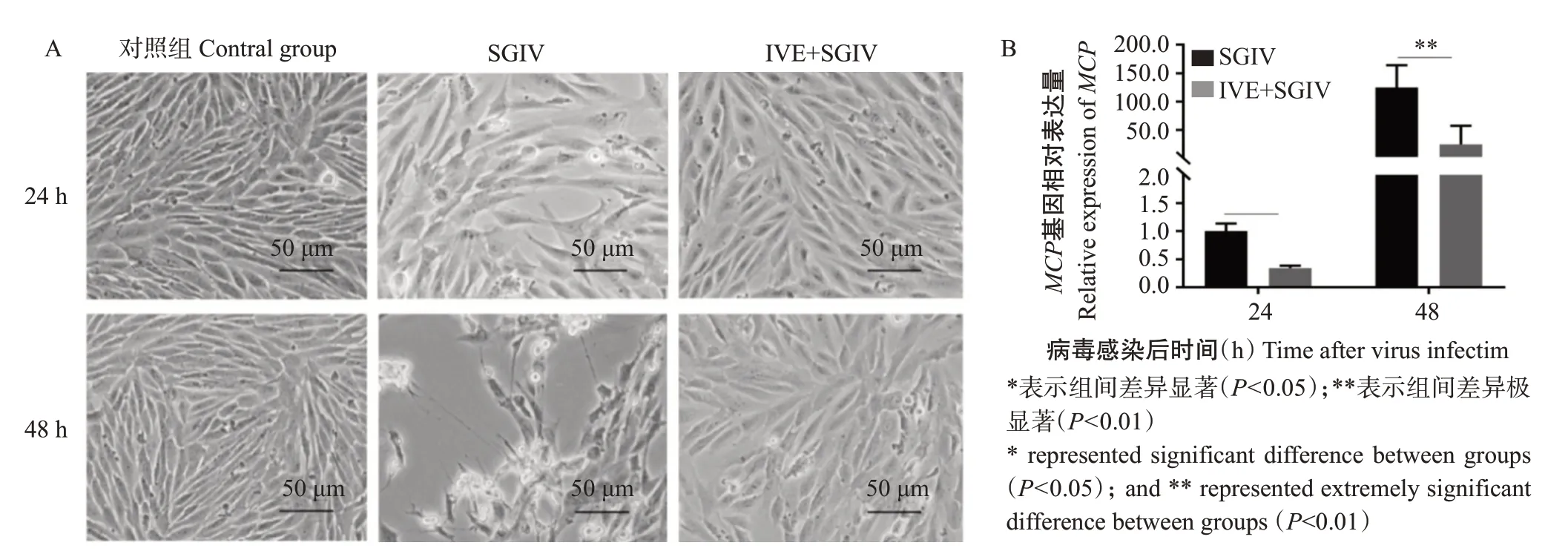
图3 IVE细胞水平抗SGIV感染的效果Fig.3 SGIV infection effects of IVE level of cells
2.4 IVE激活宿主细胞抗病毒免疫反应
为探究IVE在病毒感染时是否影响细胞免疫因子表达,采用实时荧光定量PCR检测IVE体外激活宿主细胞抗病毒免疫反应,结果如图4所示。与仅孵育SGIV的GS细胞相比,试验组GS细胞中干扰素相关基因IFN、STAT1和IRF3在病毒感染后24 h极显著上调,但至病毒感染后48 h无显著差异;PKR、IKKα、ISG15和STING基因在病毒感染后24和48 h均呈显著或极显著上调趋势。说明IVE可增强SGIV感染GS细胞中干扰素相关基因的表达。

图4 IVE调控宿主细胞抗SGIV的免疫反应Fig.4 Immune response of IVE to regulate cells of host against SGIV
2.5 IVE在石斑鱼活体中的抗SGIV效果分析
2.5.1 石斑鱼活体用药安全浓度确定石斑鱼腹腔注射不同剂量IVE后观察鱼体1周内的死亡情况,结果(图5)发现,腹腔注射10 mg/尾IVE的石斑鱼存活率为40%,注释8 mg/尾的存活率为60%,注释6 mg/尾的存活率为70%,注射剂量≤4 mg/尾的石斑鱼进食正常且无死亡,因此确定石斑鱼活体的IVE用药安全浓度≤4 mg/尾。

图5 IVE注射剂量对石斑鱼存活率的影响Fig.5 Effects of different concentrations of IVE on grouper vability rate
2.5.2 IVE在石斑鱼活体中的抗SGIV活性.如图6所示,与对照组仅注射SGIV的石斑鱼相比,试验组石斑鱼脾脏组织中的MCP基因相对表达量在病毒感染后24和48 h均极显著降低,说明IVE在活体水平也能有效抑制SGIV感染。

图6 IVE在石斑鱼活体中的抗SGIV活性Fig.6 Anti-SGIV activity of IVE against grouper in vivo
3 讨论
SGIV是危害石斑鱼养殖产业的主要病原之一,致死率极高,因此亟待研发出能有效抑制SGIV感染的药物。与抗生素等化学药物相比,药用植物具有诸多优点,包括活性化合物成分多、绿色无药残及成本低等(季本安等,2017)。已有研究证实,一些药用植物具有抗菌、抗病毒功能活性。如黄连水提物具有一定的抑菌功效,具备研发成高效抗水产病害中药制剂的潜力(刘明珠等,2019)。桑叶有效成分——异槲皮苷可通过破坏SGIV粒子结构,干扰病毒粒子对宿主细胞的吸附、侵入及复制过程而发挥抗SGIV感染作用(李鹏飞等,2021b)。八角茴香富含槲皮苷、β-谷甾醇等多种活性成分,具有抗菌、抗氧化、抗病毒及免疫调节等多种药理作用,药效显著、用途广泛。姚莉韵和王丽平(1999)研究发现,八角茴香水溶性成分Ⅱ槲皮素-3-O-β-呋喃葡萄糖甙对单纯疱疹病毒1型(HSV-1)有明显的抑制作用;Liu等(2020b)研究证实,八角茴香主要活性成分具有抑制SGIV感染的效果,其中槲皮素可通过干扰SGIV与宿主靶细胞结合而影响SGIV侵入宿主细胞。至今,鲜见从细胞免疫应答角度阐述IVE抗SGIV感染的研究报道,为此本研究探究IVE对宿主细胞免疫应答的影响,旨在阐明其抗病毒机制。
固有免疫是机体在系统发育和进化过程中形成的天然免疫防御功能,是机体抵御病原微生物感染的第一道屏障(Boraschi et al.,2017)。宿主可通过免疫细胞模式识别受体(Pattern recognition receptors,PRRs),包括病毒双链DNA(dsDNA)、双链RNA(dsRNA)、单链RNA(ssRNA)等病原相关分子模式(Pathogen-associated molecular patterns,PAMPs),启动特异性级联信号转导,然后诱导I型IFN表达,产生非特异性免疫反应以抵抗病原感染(Akira et al.,2006)。近年来,诸多研究表明STING基因在先天免疫中发挥重要作用(Ishikawa and Barber,2008;Liu et al.,2015),作为细胞质DNA传感器,STING可通过激活胞质激酶IκB kinase(IKK)及转录因子κB(NF-κB),而诱导IFN产生(Ran et al.,2014;Chow et al.,2015)。IFN与细胞表面受体结合,通过激活JAK-STAT信号转导调控具有抗病毒活性的干扰素刺激基因(Interferon stimulated genes,ISGs),包括ISG15、PKR、ISG56基因的表达而发挥抗病毒作用(Schneider et al.,2014;Xin et al.,2020)。此外,有研究报道药物可通过调控IFN表达而达到抗病毒效果。如甘草素可通过调控I型IFN信号通路而发挥抗新冠肺炎作用(Zhu et al.,2020);α-硫辛酸可促进IRF3、IRF7、Viperin、ISG15、IFN1和PKR基因表达而抑制病毒性出血性败血症病毒(VHSV)感染(Zhang et al.,2021);香豆素衍生物7-[(4-aminophenyl)diazenyl]-4-methyl-coumarin(AMC)可通过上调IFN1、MxI、EF1和MDA5基因表达,抑制传染性造血器官坏死病病毒(IHNV)在感染过程中的复制(Hu et al.,2021)。本研究结果与前人的研究结果相似,IVE处理GS细胞可有效上调IFN、STAT1、PKR、IKKα、IRF3和STING等干扰素相关基因表达,故推测IVE可通过激活GS细胞中的干扰素相关基因表达,诱导宿主细胞建立抗病毒状态而间接发挥抗病毒功能。
近年来,IFN在鱼体免疫中的重要作用已受到广泛关注。Purcell等(2012)研究发现IFN系统的预激活可显著抑制鱼弹状病毒复制;刘镭(2018)研究表明香豆素可通过促进HO-1表达,触发IFN产生从而发挥抗鲤春病毒血症病毒作用;Zhang等(2021)研究发现,α-硫辛酸可通过抑制VHSV依赖的氧化应激反应和上调抗病毒基因Viperin和ISG15,进而发挥抗VHSV感染的作用。STING基因能通过识别DNA分子,而启动免疫反应产生I型IFN,在抗病毒感染过程中发挥极为重要的作用(欧阳婷等,2018)。本研究发现,经IVE预处理后可有效抑制SGIV感染GS细胞,且能影响IFN、ISG15、STING、PKR、STAT1和IRF3等干扰素相关基因的表达;石斑鱼活体抗病毒试验进一步证实IVE在石斑鱼活体内具有抑制SGIV感染的效果。SGIV是一个正二十面体的双链DNA病毒,STING基因在天然免疫中能识别病毒DNA及药用植物可调控干扰素信号通路(秦启伟和黄晓红,2019)。因此,推测IVE是通过诱导细胞内STING基因表达,增强其对SGIV的识别,同时进一步诱导干扰素相关基因表达,激活宿主细胞建立抗病毒状态(图7)而发挥抗病毒功能。
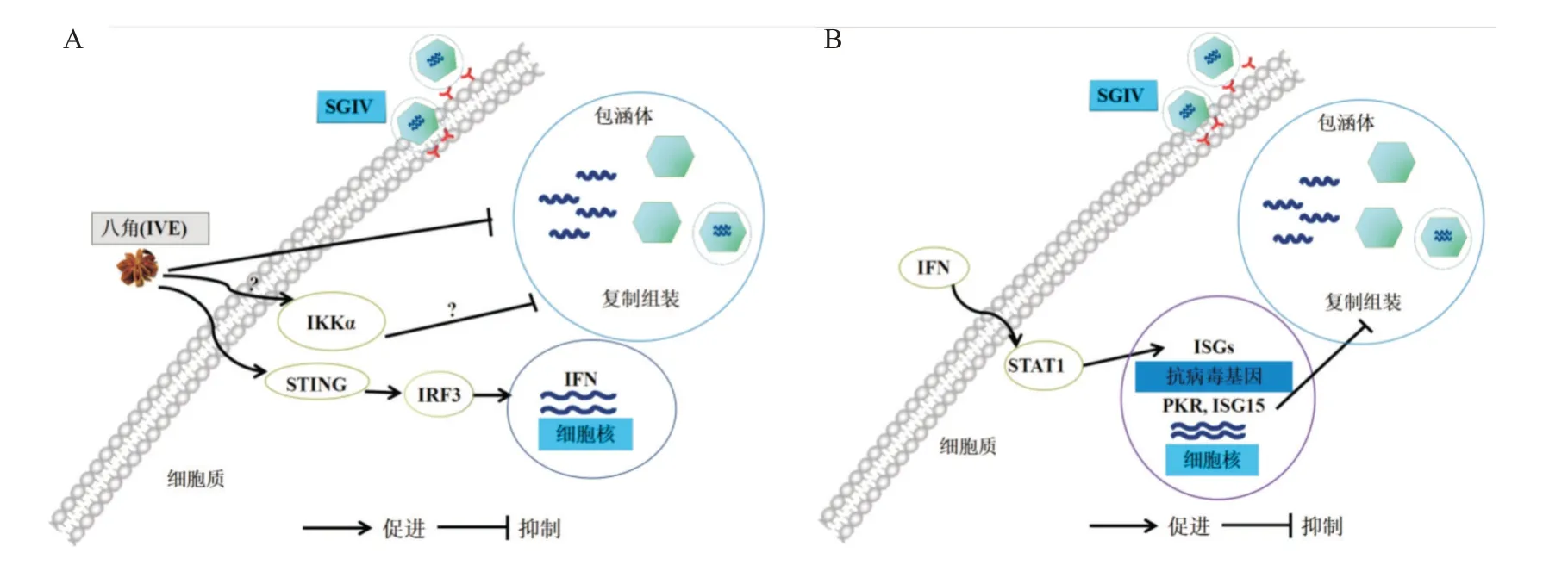
图7 IVE抗SGIV感染的作用机制示意图Fig.7 Schematic diagram of anti-SGIV mechanism of IVE
4 结论
IVE具有抑制SGIV感染的生物功能,其作用机制可能是通过诱导干扰素相关基因表达而激活宿主的抗病毒状态,从而发挥间接抗SGIV效果;也说明八角茴香在水产疫病防控中具有研发成渔用抗病功能制剂的潜力。

