不同浓度血清对猪瘟兔化弱毒株感染滴度的影响
潘晓梅,王遵宝,候 凤,周 涛,张慧敏,侯红娟,毛丽萍,贺 笋
(天康生物制药有限公司,新疆 乌鲁木齐 830032)
猪瘟是由猪瘟病毒 (classical swine fever virus,CSFV)引起的一种急性、高度接触性、致死性疾病,是世界动物卫生组织(OIE)规定必须报告的动物疫病,在我国属于一类动物传染病,在世界许多国家、地区均有发生,给世界养猪业造成了巨大损失[1-6]。目前,猪瘟疫苗接种仍然是控制和预防猪瘟的主要手段。猪瘟病毒(LPC株)疫苗(中国C株)、细胞弱毒疫苗(日本GPE株和法国Thiwerval株)和中国台湾的猪瘟病毒(LPC株)(兔体传800代致弱,LPC株)仍被广泛用于猪瘟的预防和控制[7]。猪瘟病毒可在多种细胞上增殖,包括ST细胞、PK-15细胞等,并且具有可以连续收毒的特点,但是猪瘟病毒一般不引起细胞病变[7-11]。
猪瘟疫苗的质量是决定免疫效果,乃至猪瘟防控成效的关键因素。而疫苗中有效病毒含量是决定疫苗质量的重要指标。在病毒常规培养中,由于血清中存在一些非特异性抑制因子,能抑制某些病毒的生长及增殖,所以病毒维持液内胎牛血清含量一般不超过2%,或不加血清[12-13]。目前,国内外猪瘟病毒感染细胞的维持液常用的血清浓度为2%,有的可达3%~5%。目前,尚无不同浓度血清对猪瘟病毒感染力影响的比较研究。由于不同浓度血清对细胞的生长影响不同,可能会影响病毒感染力,因此本研究就不同浓度血清对猪瘟兔化弱毒株 (hog cholera lapinized virus,HCLV)在PK-15细胞上的感染力进行比较,并探讨猪瘟兔化弱毒感染PK-15细胞的适宜血清浓度。
1 材料与方法
1.1 细胞株和病毒株
PK-15细胞由天康生物制药有限公司传代与保存。猪瘟病毒HCLV株由天康生物制药有限公司保管和供应。
1.2 细胞培养基和血清
DMEM培养基、胰蛋白酶TRYPSIN0.25%(1×)及胎牛血清购自Hyclone公司。
1.3 主要试剂
猪瘟阳性血清购自中国兽医药品监察所;兔抗猪FITC标记IgG购自Sigma公司;甲醛、磷酸盐等为国产分析纯。
1.4 仪器和设备
8道微量移液器、二氧化碳培养箱、核酸浓度测定仪和离心机购自 Thermo Fisher Scientific;荧光倒置显微镜购自Leica;荧光定量PCR仪购自Bio-Rad;Tguide核酸自动提取仪和T-EASY自动化移液工作站购自TIANGEN;涡旋混匀器购自IKA。
1.5 引物信息
参考文献[6]中猪瘟病毒特异性引物由Invitrogen公司合成荧光定量RT-PCR引物及探针,目的片段为121bp,探针 5′标记 FAM 荧光报告基团,3′标记TAMRA淬灭基团。
CSFV-F:5′-TACAGGACAGTCGTCAGTAGTTCGA-3′;
CSFV-R:5′-CCGCTAGGGTTAAGGTGTGTCT-3′;
CSFV-P:5′-CCCACCTCGAGATGCTATGTGGACGA-3′。
1.6 试验方法
1.6.1 病毒液的制备。PK-15细胞长成单层后,将猪瘟病毒按照10%的体积比接种于生长良好的单层PK-15细胞,置于37℃含5% CO2的培养箱中感作1h。倒去感作的液体,加入分别含有0%、2%、6%和10%血清浓度的维持液,每个血清浓度设1个平行对照,置37℃含5% CO2的培养箱中培养。96h后第1次收获(称为一收)细胞方瓶中病毒液,再向培养瓶补充等体积含有不同血清浓度的维持液。如此反复可以再收获病毒5次。将平行对照的两个方瓶的病毒液混合后收获,分装保存于-70℃以下环境中备用。
1.6.2 病毒含量的测定。间接免疫荧光法(IFA)。在-70℃下取出待测的猪瘟病毒,用无血清的MEM培养基进行 10-1、10-2、10-3、10-4、10-5、10-6和 10-77 个浓度稀释。取培养好的PK-15细胞,弃去培养基,将上述的每个稀释度病毒接种到96孔板中,设阴性对照,然后将96孔板置于37℃含5%的CO2培养箱中培养。取出培养3d的细胞板,将病毒液倒入含有NaOH的废弃桶中,经PBST洗涤后加入丙酮固定,再经PBST洗涤后加入稀释好的阳性血清,37℃反应1~2h。经PBST洗涤后加入稀释后的FITC标记的兔抗猪的IgG,37℃反应 1~2h。用 PBST洗涤后加入少量PBST,于倒置荧光显微镜下判读猪瘟兔化弱毒株含量,以Reed-Muench方式计算病毒含量,以TCID50/mL表示。每个样品设5个重复。
荧光定量PCR法(qPCR)。以猪瘟病毒HCLV株核酸为模板,扩增获得目的基因,切胶回收,用pMD®19-T Simple Vector进行载体连接,并将连接产物加入感受态细胞中转化,在含有Amp的LB培养基上筛选获得含有目的基因的单个菌落。取菌液用QIAGEN® Plasmid Plus Midi Kit试剂盒提取质粒,并用Quawell Q5000测定核酸浓度及纯度;将质粒核酸连续10倍梯度稀释后作为荧光定量RT-PCR的标准品,绘制荧光定量PCR标准曲线。用自动核酸提取仪提取病毒样品的核酸,反转录后进行qPCR检测,根据标准曲线计算病毒的起始拷贝数。
反转录程序:反应混合液 37 ℃反应20min,85℃ 20s灭活反转录酶。反应液组分:反应缓冲液2 μL、反转录酶0.5 μL、Oligo dT 引物 0.5 μL、随机引物2 μL、总RNA5 μL。
荧光定量PCR程序:95℃预变性30s;95℃变性5s;55.7℃退火30s,收集荧光信号;共扩增40个循环。反应液组分:荧光定量PCR反应预混液12.5μL,上、下游引物及探针各0.5μL,cDNA模板2μL,双蒸水9μL。
1.7 统计学分析
用SPSS统计学软件的多因素方差分析比较在不同收获时间、血清添加量条件下病毒毒价及病毒核酸含量的差异,从而确定收获次数及血清浓度对病毒含量的影响。
2 结果
2.1 不同浓度血清培养条件下PK-15细胞的生长情况
收获病毒后,将方瓶的细胞置倒置显微镜下观察PK-15细胞的生长情况。随着血清浓度的升高,PK-15细胞的密度越来越高。在0%的血清浓度条件下,细胞不能正常生长,大部分细胞脱落后死亡。在2%血清浓度条件下,细胞能形成致密单层,未见脱落死亡的细胞。在6%血清浓度条件下,细胞形成致密单层,部分细胞因密度过高形成少量的聚集体,未见脱落死亡细胞。在10%血清浓度条件下,细胞形成致密单层,大部分细胞因密度过高形成大量的聚集体,未见脱落死亡细胞(图1)。
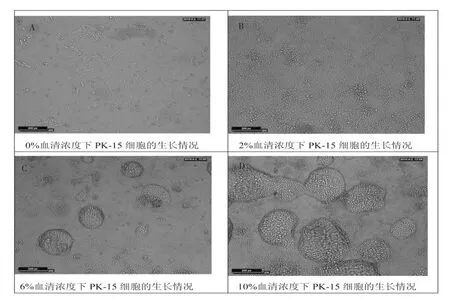
图1 不同浓度血清培养条件下PK-15细胞的生长情况
2.2 不同浓度血清对病毒含量的影响
2.2.1 病毒毒价测定结果。用间接免疫荧光方法测定了猪瘟兔化弱毒株的病毒含量,发现猪瘟兔化弱毒免疫荧光均匀分布于细胞浆,呈绿色,阴性对照无荧光信号(图2),阳性对照、阴性对照均成立。检测结果如表1所示,2%、6%和10%血清浓度组的病毒毒价极显著高于0%血清浓度组(P<0.01);一收、二收和三收组2%血清组病毒毒价显著低于6%、10%血清组(P<0.05);同时,在二收和三收中6%、10%2个血清组的病毒毒价无显著差异(P>0.05);四收时2%、6%和10%血清组无显著差异(P>0.05);但在五收时,6%血清组的病毒毒价显著高于2%和10%血清组(P>0.05)。说明血清对猪瘟兔化弱毒株感染PK-15细胞的能力有影响。
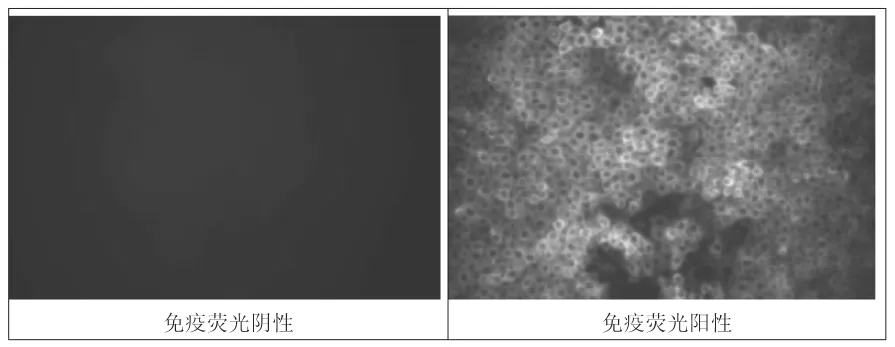
图2 免疫荧光阴性和免疫荧光阳性图

表1 不同浓度血清培养条件下病毒毒价测定结果(Log10TCID50/mL,Mean±SD)
2.2.2 荧光定量PCR测定结果。用qPCR法对不同浓度血清在同一收获时间获得的病毒含量进行了统计分析。结果显示,0%血清组病毒含量极显著低于其他试验组(P<0.01),一收和二收组2%血清组病毒含量显著低于6%、10%血清组(P<0.05), 6%、10%2个血清组的病毒含量差异不显著(P>0.05);三收和四收组2%血清组病毒含量显著低于10%血清组(P<0.05);五收时2%、6%和10%血清组无显著差异(P>0.05)。以上结果表明,血清对猪瘟兔化弱毒株感染PK-15细胞的能力影响较大,综合成本考虑,6%血清浓度适合猪瘟兔化弱毒株在PK-15细胞上的扩繁(表2)。

表2 不同浓度血清培养条件下病毒核酸含量测定结果(Log10Copies/mL,Mean±SD)
2.3 相关性分析结果
IFA方法(采用细胞培养法)是猪瘟病毒含量检测的经典方法,能真实反映种毒的感染能力即活病毒的含量。Real-time PCR方法具有快速便捷、高适应性和可靠性、试验结果稳定、重复性好及特异性更高的优势,是实验室快速检测的有效方法。以上两种方法均能有效反应病毒增殖情况,采用两种方法对待测样品进行了检测,并分析了两种检测方法的相关性。结果显示,两种检测方法获得的病毒含量呈显著正相关(γ=0.9957),用一般线性模型(general linear model,GLM)拟合了病毒含量与病毒核酸含量的线性方程,见图3。
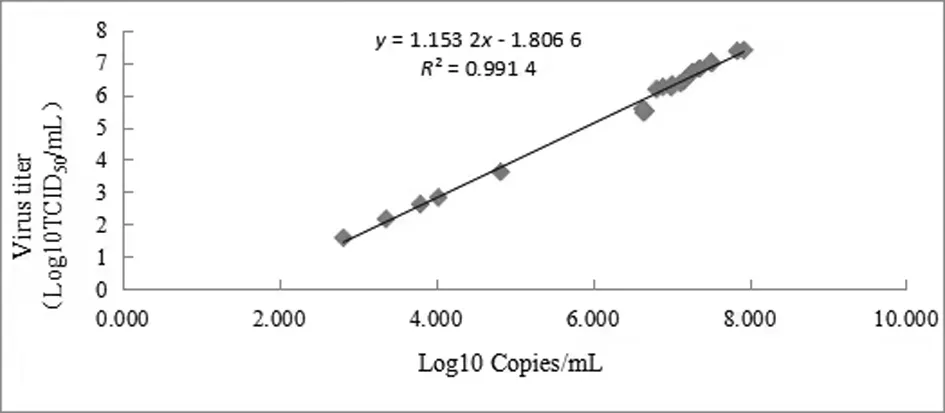
图3 病毒含量与病毒核酸载量的拟合曲线
3 讨论
在动物疫苗生产中,为了降低生产成本,降低生物制品纯化损失,减少由于不确定蛋白或血清组分带来干扰或差异的风险,提高生物制品的安全性,大多数采用无血清培养基[14-15]。但在使用过程中,有些病毒如口蹄疫病毒,有时会出现细胞生长良好,但病毒产量不高的问题。为了克服这一现象,许多厂家在病毒生产过程中,还是要加入1%~3%的低浓度血清[16]。血清中含有10多种氨基酸,还有促进细胞生长以及贴壁的成分。但是,血清中存在一些非特异性抑制因子,能抑制某些病毒的生长及增殖,经56℃ 30min不能被灭活。所以常规病毒维持液内血清含量一般不超过2%,或不加血清[12-13],如培养水貂传染性肠炎病毒以及鸡传染性法氏囊病病毒等不加血清。但对同步接毒的病毒细胞培养,如细小病毒的培养则必须加入适量血清[12,17]。
在生物制品中,使用无血清培养基,可提高生物制品的质量、纯度,方便产物的分离纯化,减少由血清带来的污染机会,减少过敏原,同时也降低了成本,便于在生物反应器中进行代谢流分析,实现在线监控,精准投料。对于生产抗体的CHO细胞、Vero细胞和杂交瘤细胞,确实有优势[18-20]。但是对于多数病毒性疫苗来说,会出现病毒产量低的情况[16],如本研究中的猪瘟兔化弱毒株。
本文的研究结果表明,与其他3种浓度的培养基相比,用含6%胎牛血清的培养基进行病毒感染培养,在相同的培养时间内,所测得的病毒含量相对较高,说明在含6%血清的培养基中,猪瘟兔化弱毒株感染力较强,更利于病毒的增殖,在感染相同时间后,此浓度培养条件下细胞所含病毒量更多,毒力更强。

