赤霉素对盐胁迫下绿宝糯黍子幼苗根生长及渗透调节的影响
王金香 王艳芝 幸丽璇 刘建霞 王润梅
(山西大同大学农学与生命科学学院/设施农业技术研发中心,037009,山西大同)
黍子(Panicum miliaceum L.)是我国北方地区的一种特色农作物。它具有抗干旱、耐贫瘠等显著特点,适合在干旱、半干旱地区生长。山西北部属季风性干旱地区,土壤贫瘠,纬度高、湿度低、昼夜温差大,独特的地理、土壤和气候环境形成了黍子特有的营养成分和口感,黍子成为晋北地区极富特色且营养价值极高的一种小杂粮作物[1]。
干旱和土壤盐渍化是影响农作物生长的主要逆境因子。土壤盐渍化可以分为轻度(含盐量在0.1%~0.3%)、中度(0.4%~0.6%)和重度(大于0.6%),3种不同程度的土壤盐渍化在山西均有分布,其中轻度盐渍化面积占比最大,中度次之,重度最小[2]。Na+、Cl–和SO42–是多数盐渍区土壤的主要盐分类型[3]。土壤盐渍化对农作物组织与器官的生长和分化有抑制作用,使植株发育缓慢、衰老加速,进而造成农作物减产甚至发生大面积死亡[4]。盐分升高对农作物造成的主要危害与生理干旱、离子失衡、氧化应激及随后产生的严重营养胁迫有关[5]。如高浓度的盐会使环境水势降低,幼苗叶片水势、渗透势、压力势和相对含水量均明显下降,出现生理干旱现象,形成对细胞的渗透胁迫[6]。同时,环境中Na+过度摄入会干扰细胞对其他离子的吸收和分布,根、茎和叶中K+、Mg2+、Ca2+等离子浓度会因Na+过度进入细胞而明显下降,造成细胞离子失衡和离子毒害[5]。逆境胁迫下,维持细胞内渗透平衡、确保植物细胞吸水是植物提高抗逆性、实现个体生存和发展的早期适应性反应。
赤霉素(gibberellin,GA3)是一种植物激素,具有促进植物生长和增产的作用。研究[7]显示,GA3能显著缓解盐胁迫对水稻种子萌发的抑制作用,在此过程中,类异黄酮还原酶和葡萄糖磷酸变位酶等与GA3提高水稻耐盐性有关。对甜玉米的研究[8]显示,在盐胁迫条件下,幼苗鲜重、叶绿素含量、过氧化氢酶(CAT)及超氧化物歧化酶(SOD)活性均降低,在盐胁迫条件下对其进行外源GA3的叶面喷施,可使幼苗的鲜重、叶绿素含量及2种酶活性得到恢复。
目前,我国耕地面积逐年缩小,而土壤盐渍化程度和面积却有不断扩大趋势,有效耕地面积减少已成为制约我国农业发展的一个重要因素。如何充分利用盐碱土地、提高盐渍化土壤的生产力、促进粮食增产是亟待解决的问题。选用抗盐农作物品种或添加外源性物质提高作物抗盐性是有效利用轻度及中度盐碱土地进行农业生产的一种有效措施。绿宝糯是口感好、营养品质优良的黍子品种,该品种是否适合在干旱盐碱化的晋北地区种植以及适合在哪种盐碱土壤种植还未见报道,能否利用GA3提高绿宝糯黍子的抗盐性,扩大品种种植范围也需要做进一步研究。本试验以绿宝糯黍子为材料,研究该品种幼苗期对盐胁迫的耐受性,探究GA3对盐胁迫下幼苗生长及渗透调节的作用,为合理利用盐碱土地进行农业生产(增产增收)提供更多的理论依据。
1 材料与方法
1.1 试验材料与设计
黍子品种为金谷绿宝,购买于山西省晋中市太谷县。
盐胁迫处理:挑选籽粒饱满、大小一致的种子,用NaClO消毒冲洗后将种子均匀铺在育苗盘中(育苗盘中铺一层纱布)并放入25℃恒温培养箱中水培萌发生长,待种子萌发后进行盐胁迫处理。试验共设4个处理,CK:对照组,用蒸馏水进行培养;T1:用0.1%NaCl溶液进行培养;T2:用0.2%NaCl溶液进行培养;T3:用0.3%NaCl溶液进行培养,每组设3个重复。每天更换培养液,萌发后第3天开始测量幼苗的根长和芽长,连续统计6d。生长至第8天取幼苗根,观察结构,测定渗透调节物质含量及根系活力。
GA3缓解处理:种子萌发后以水培为对照(CK),以0.2%NaCl溶液进行盐胁迫处理(T2),0.2%NaCl溶液处理同时外施60、80、100、120和150mg/L GA3水溶液进行缓解处理,分别记为T2+GA60、T2+GA80、T2+GA100、T2+GA120 和T2+GA150,筛选出合适浓度的GA3水溶液,在第5天测量根长与芽长,连续统计4d,研究GA3的缓解作用。
1.2 测定项目与方法
1.2.1 根长和芽长 先用一根细线量取根基部到根尖的长度并做好标记,再将该段细线拉直用直尺测量其长度,即为根长;测量芽长时,用细线量取芽基部到幼芽尖端的长度并做好标记,再将细线拉直测量其长度。
1.2.2 根尖细胞显微结构观察 幼苗生长至第8天时,取根尖(距根最前端2~3mm的部分),制作临时装片。具体操作如下:将根尖放入解离液(15%HCl和95%乙醇1:1)中室温下解离30min,蒸馏水漂洗后用龙胆紫(0.01g/mL)染色2min,用蒸馏水冲洗后将根尖放在载玻片并盖上盖玻片,用拇指轻压盖玻片,使细胞分散开来,制成临时装片,在显微镜下观察拍照。对伸长区细胞纵向长度和横向长度进行显微测量,伸长区细胞纵横比(纵向长度/横向长度)表示细胞的伸长水平。
1.2.3 渗透调节物质含量 采用蒽酮比色法[9]测定可溶性糖含量,采用考马斯亮蓝染色法[10]测定可溶性蛋白含量,采用酸性茚三酮比色法[11]测定游离脯氨酸(Pro)含量。
1.2.4 根系活力 利用TTC法测定根系活力,具体参照《植物生理学实验指导》[11]。
1.3 数据处理
利用SPSS 21.0软件分析处理数据,结果用3次试验平均值±S.E.表示。
2 结果与分析
2.1 盐胁迫对绿宝糯黍子幼苗生长、根尖细胞结构与渗透调节的影响
2.1.1 盐胁迫对幼苗生长的影响 从图1a可以看出,对照组(CK)幼苗生长旺盛,根系发达,幼根长且须根多,地上部分生长快速,芽长明显。盐胁迫处理后的幼苗纤细矮小,幼根短且须根少或没有,幼芽生长减缓,长度明显变短;盐浓度越高对幼苗生长抑制作用越明显。由图1b可见,CK组幼苗的根不断伸长,生长趋势明显;盐胁迫处理后根的生长明显减缓。盐胁迫5d内3个处理组幼根生长速度显著低于CK组,盐浓度越大幼根生长速度越慢;5d后3个盐处理组幼根停止生长;在第8天,T1、T2和T3处理组的根长比CK组分别低49.70%、54.07%和63.65%;在盐胁迫后期幼根的生长已被完全抑制。与对根的抑制作用不同,芽在整个盐胁迫过程中一直生长但生长缓慢,低于CK组,生长至8d时,在3个盐浓度组(由低到高)芽长分别比CK组降低了11.11%、18.28%和34.77%(图1c)。上述结果表明,盐胁迫不仅抑制根的生长,同时对地上部分芽的生长也产生显著抑制作用,且盐胁迫对根生长的抑制作用大于芽;盐浓度越高对幼苗的伤害越大,抑制作用越明显。
2.1.2 盐胁迫对幼苗根尖伸长区细胞生长的影响
如图2所示,CK组伸长区细胞明显伸长(图2a),细胞纵向长度约为横向长度的6倍(图2b);而在盐胁迫下,细胞的伸长明显受到抑制,T1处理组伸长区细胞纵向长度约是横向长度的3.6倍;T2处理组细胞的纵横比约为2.0;T3处理组细胞纵横比为1.8(图2a和2b)。盐胁迫对幼苗根尖伸长区细胞生长产生了明显的抑制作用,制约了根的纵向生长并最终影响根的生长及对营养物质的吸收。
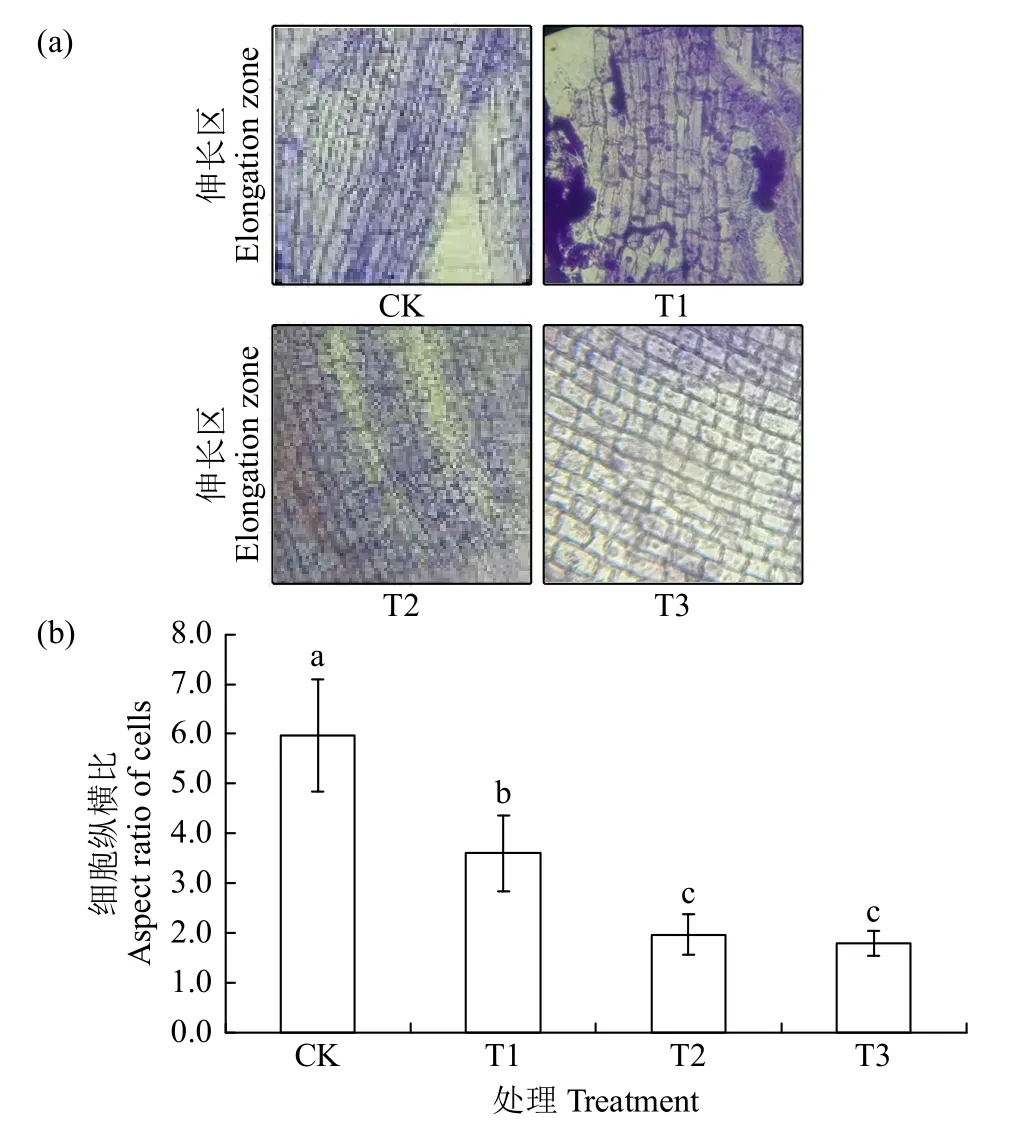
图2 盐胁迫对绿宝糯黍子幼苗根尖伸长区细胞生长的影响Fig.2 Effects of salt stress on cell growth in root tip elongation zone of Lübaonuo broomcorn millet seedling
2.1.3 盐胁迫对幼苗根中渗透调节物质的影响 由图3a可知,CK组可溶性糖含量为0.03μg/g,盐胁迫后根中可溶性糖含量略有升高,T3处理组胁迫下可溶性糖含量最高,是CK组的1.26倍,但无显著差异。如图3b所示,CK组可溶性蛋白含量为0.72μg/g,盐胁迫处理后根中可溶性蛋白含量比CK组明显增多,T1、T2和T3处理组的含量分别是CK组的1.24、1.47和1.46倍。CK组游离Pro含量为13.53μg/g;T1处理组游离Pro含量增加,但与CK组比无显著差异;随着盐浓度的增加,根中Pro含量显著升高,T3处理组Pro含量为CK组的3.94倍(图3c)。

图3 盐胁迫对绿宝糯黍子幼苗根中可溶性糖、可溶性蛋白和游离Pro含量的影响Fig.3 Effects of salt stress on the contents of soluble sugar,soluble protein and proline in roots of Lübaonuo broomcorn millet seedling
2.1.4 盐胁迫对幼苗根系活力的影响 根系活力是根生理功能的一项综合性指标,根系越发达,活力越高,根的吸收功能越强,生命力越旺盛。由图4可知,盐胁迫严重影响幼根的正常生长和发育,根吸收功能降低,根系活力显著下降。CK组根系活力最高,幼苗根系发达,不仅具有生长旺盛的主根系,还有较多的须根。盐胁迫处理根系活力明显降低,与CK组相比,T1和T2处理组幼苗根系活力分别下降了10.6和13.2mg/(g·h),T3处理组对根产生极显著影响,根系受损程度高,根系活力下降了19.2mg/(g·h)。
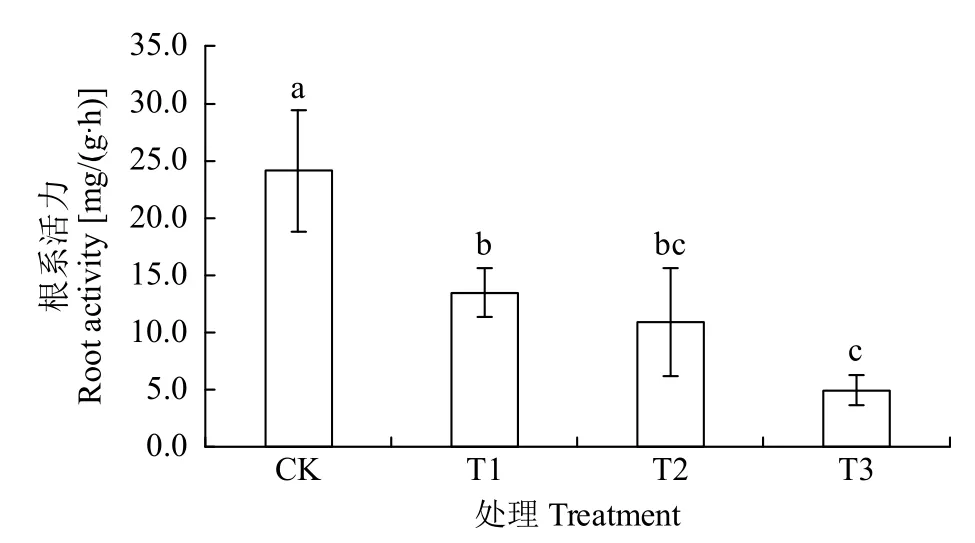
图4 不同浓度盐胁迫对绿宝糯黍子幼苗根系活力的影响Fig.4 Effects of salt stress on root activity of Lübaonuo broomcorn millet seedling
2.2 GA3对盐胁迫下绿宝糯黍子幼苗生长、根尖细胞伸长与渗透调节物质含量的影响
2.2.1 GA3对盐胁迫下幼苗生长的影响 图5显示了GA3对黍子盐胁迫的缓解作用。图5a浓度效应显示,GA100和GA120处理组对盐胁迫的缓解作用较好,且GA120处理组对根的缓解作用明显。由图5b可知,CK组幼苗生长旺盛,幼根发达,根长且须根多,整个根部为白色,未出现发黄、发褐色的氧化现象;盐胁迫处理幼苗矮小,生长缓慢甚至停滞,根长与芽长均低于CK组,须根少且根系发黄,有明显的氧化现象;T2+GA120处理组对幼苗生长会产生非常明显的缓解作用,与T2处理组相比,T2+GA120处理组幼根的长度略有增加,幼芽的长度明显增加。施加GA3处理后,幼根的长度大于T2处理组,生长至第8天,根长是T2处理组的138%,但仍明显低于CK组(图5c)。如图5d所示,GA3对幼芽的缓解作用更加明显,T2+GA120处理组幼苗地上部分生长迅速,在第8天时幼芽长度是T2处理组的159%,高于CK组。上述结果表明,添加GA3能够显著缓解盐胁迫对幼苗生长的抑制作用,促进幼苗在轻度盐碱环境中的生长。

图5 GA3对盐胁迫下绿宝糯黍子幼苗生长的影响Fig.5 Effects of application of GA3on the growth of Lübaonuo broomcorn millet seedlings under salt stress
2.2.2 GA3对盐胁迫下幼苗根尖伸长区细胞生长的影响 如图6所示,CK组伸长区细胞明显伸长,细胞纵横比为6.0;而T2处理组根尖伸长区细胞体积较小,纵向伸长现象不明显,细胞纵横比为2.0。T2+GA120处理组伸长区细胞的纵向长度明显增加,细胞纵横比为4.8(图6)。GA3可以促进伸长区细胞的伸长,缓解盐胁迫对根细胞生长的抑制作用,促进根的纵向生长。

图6 GA3对盐胁迫下绿宝糯黍子幼苗根尖伸长区细胞生长的影响Fig.6 Effects of application of GA3on cell growth in root tip elongation zone of Lübaonuo broomcorn millet seedlings under salt stress
2.2.3 GA3对盐胁迫下幼苗根渗透调节作用的影响 与CK组相比,T2处理组根中可溶性糖含量增加但无显著差异,T2+GA120处理组可溶性糖含量较单独盐胁迫处理降低,略高于CK组,但3个试验组间无显著差异(图7a)。T2处理组根中可溶性蛋白含量明显升高,T2+GA120处理组可溶性蛋白含量显著降低,与CK组含量接近(图7b)。根中游离Pro含量在T2处理组显著增加,T2+GA120处理组游离Pro含量比T2处理组略有降低,但比CK组仍显著升高(图7c)。上述结果说明,游离Pro含量的升高是绿宝糯黍子幼苗对抗盐胁迫引发的渗透胁迫的主要适应方式。
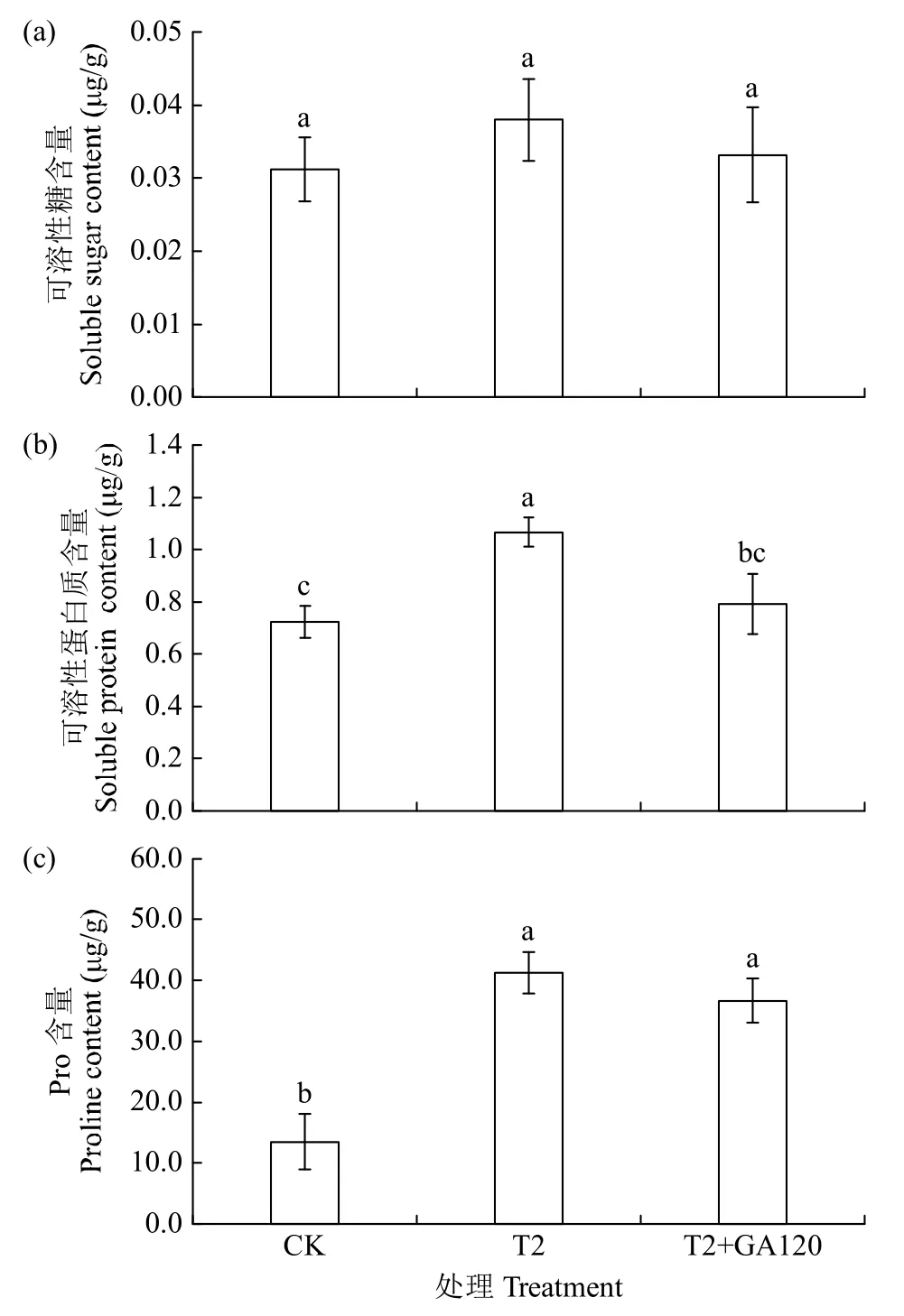
图7 GA3对盐胁迫下绿宝糯黍子幼苗根中可溶性糖、可溶性蛋白和游离Pro含量的影响Fig.7 Effects of application of GA3on the contents of soluble sugar,soluble protein and free proline in roots of Lübaonuo broomcorn millet seedling under salt stress
2.2.4 GA3对盐胁迫下幼苗根系活力的影响 由图8可知,CK组根系活力为24.1mg/(g·h),T2处理组根系活力显著降低,是CK组的45%;T2+GA120处理组幼苗根系活力明显升高,是T2处理组的217%,是CK组的98%,趋于正常水平。这一结果表明,GA3可以缓解盐胁迫对绿宝糯黍子幼苗根系的损伤,提高幼苗的根系活力及抗轻度盐胁迫的能力。

图8 GA3对盐胁迫下绿宝糯黍子幼苗根系活力的影响Fig.8 Effects of application of GA3on root activity of Lübaonuo broomcorn millet seedling under salt stress
3 讨论
北方地区春季多风少雨、气候干燥、土壤盐渍化的环境使大部分农作物难以生存,但黍子是适合北方地区种植的一种粮食作物,具有明显的地区优势和生产优势。研究[12]表明,宁糜16号幼苗能忍受1.6%盐浓度,晋黍8号和陇糜8号可分别忍受0.8%和0.4%盐溶液,而内糜5号和宁糜14号的抗盐性较低。本试验对绿宝糯黍子的抗盐性研究发现,盐浓度超过0.3%时,幼苗生长受到严重抑制,而且对根的抑制作用尤为明显。这表明该品种对盐敏感,在幼苗期对轻度盐胁迫有一定的抗性,但在中度及重度盐胁迫时难以生长。
根尖伸长区细胞的纵向生长是根伸长的一个重要原因,与根的向下生长乃至整个植株的生长息息相关。细胞的生长依赖于细胞内水分和营养物质的积累,而盐胁迫减弱了细胞对水分的吸收(渗透胁迫)、降低叶片中Mg2+含量(离子胁迫),使叶绿素合成受阻、光合作用减弱,甚至造成严重营养胁迫,无法满足细胞生长所需物质基础[5]。另外,盐胁迫可通过根冠细胞内淀粉体数量明显减少引起根生长在垂直方向的偏离及生长停止[13]。本试验结果表明,轻度盐胁迫(0.1%~0.3%)对绿宝糯黍子幼根的生长产生明显的抑制作用,根尖细胞显微观察和数据的统计显示,伸长区细胞纵横比显著降低,说明盐胁迫抑制了伸长区细胞伸长且抑制作用与盐浓度呈正相关性。
土壤盐渍化对植物造成的危害之一就是渗透胁迫。盐胁迫对根系产生毒性作用的同时也促发了大量代谢反应的进行,包括抗逆蛋白、抗氧化酶、热激蛋白和渗透调节相关蛋白的合成,提高细胞渗透调节能力[14]。Pro具有较强的吸水能力和持水能力,在保持体内外渗透平衡、膜系统完整性和抗渗透胁迫中有重要作用。盐胁迫信号可快速催化Pro的合成并累积到足以调节渗透作用的量,Pro含量的增加有效减少了水分的丢失和蛋白的变性,从而增加幼苗对胁迫的抗性[15]。缓解盐胁迫的主要途径包括改变代谢途径和积累溶质来进行渗透调节[5]。可溶性糖、可溶性蛋白及Pro与植物渗透调节相关,小麦幼苗在受到NaCl胁迫后上述3种物质含量较对照都显著升高[16]。在本研究中,绿宝糯黍子幼苗受到盐胁迫后根中可溶性糖含量并没有发生显著提高,但可溶性蛋白和游离Pro含量明显升高。可见,绿宝糯黍子幼苗在受到盐胁迫时主要通过根系中Pro和可溶性蛋白的积累降低细胞的水势,维持细胞内外渗透平衡。由于盐胁迫抑制了幼苗的生长,幼根弱小且缺少须根,根对水分和无机盐的吸收能力减弱,根系活力的下降,而且盐浓度越大,根系活力越低,根的损伤越大。
GA3是一种植物内源性激素,在根尖或叶尖合成,其最突出的作用是加速细胞的伸长,进而促进植物的生长发育。已有试验[17-18]证明,根的生长依赖于GA3对根尖分生区和伸长区细胞的调控,而过量盐分诱导ABA增加,抑制了根尖生长素和GA3的合成,引起伸长区细胞中DELLA蛋白积累并通过限制细胞的增殖和伸长抑制根的生长发育。在盐胁迫下,施加GA3能够促进玉米[19]、番茄[20]和黄芪[21]等幼苗的生长。本试验选取0.2% NaCl同时施加GA3联合处理,结果显示,外施GA3对盐胁迫下幼苗生长是有利,主要表现为它加速了伸长区细胞生长,有效促进了根的延伸,保证了Pro对渗透胁迫的调节作用,根系活力显著提高;而且根的生长发育促进了地上部分的生长,显著缓解了盐胁迫对幼苗生长的抑制作用。外施GA3缓解盐胁迫的原因在于:(1)盐胁迫影响GA3合成,抑制种子萌发和幼苗的生长,而外施GA3解除了内源GA3缺乏,促进根尖伸长区细胞生长;(2)外施GA3可抑制盐胁迫引起的根冠细胞中淀粉体的分解,在一定程度上解除了盐胁迫对细胞生长的抑制作用,促进根的向下生长;(3)GA3促进根和芽的快速生长,起到了稀盐作用,间接降低了机体内盐的浓度及对细胞的危害,有利于作物生长;(4)外施GA3后高水平Pro的积累足以调控细胞的渗透调节作用,促进细胞对水分的吸收,进而缓解盐对绿宝糯黍子的渗透胁迫。
4 结论
绿宝糯黍子是一种对盐敏感的植物,低盐胁迫抑制幼苗根的生长发育,根系活力显著下降,并且盐浓度越高抑制作用越明显;在应对盐产生渗透胁迫时,幼苗的根部主要通过提高游离Pro和可溶性蛋白含量提高细胞渗透势,降低盐的危害;添加GA3能显著缓解盐胁迫对根生长的抑制作用,促进根和幼苗的生长;幼苗快速生长稀释机体中盐浓度,同时细胞通过调节Pro含量增加细胞渗透势,提高作物对盐胁迫的适应性,促进绿宝糯黍子在低盐碱环境的生长。适度添加GA3可促进绿宝糯黍子在轻度盐渍化土壤的种植。

