水稻RIL群体高密度遗传图谱的构建及苗期耐热性QTL定位
刘进,胡佳晓,马小定,陈武,勒思,Jo Sumin,崔迪,周慧颖,张立娜,Shin Dongjin,黎毛毛,韩龙植,余丽琴
水稻RIL群体高密度遗传图谱的构建及苗期耐热性QTL定位
刘进1,2,胡佳晓1,马小定2,陈武1,勒思1,Jo Sumin3,崔迪2,周慧颖1,张立娜1,Shin Dongjin3,黎毛毛1,韩龙植2,余丽琴
1江西省农业科学院水稻研究所/江西省农作物种质资源研究中心,中国南昌 330200;2中国农业科学院作物科学研究所,中国北京 100081;3韩国农村振兴厅粮食科学院南部作物部,韩国密阳 627-803
【目的】随着全球气候变暖,高温严重威胁粮食安全,发掘耐热基因资源是培育耐高温新品种和消除高温危害最直接的绿色生态途径,也是阐明耐热生理生化和分子遗传机理的基础。【方法】构建苗期耐热性鉴定评价方法,以热敏感品种周南稻和强耐热品种赣早籼58号杂交衍生的重组自交系(recombinant inbred lines,RIL)群体为研究材料,利用高通量测序技术对亲本和RIL群体进行全基因组测序;依据171个家系的基因型数据,利用滑动窗口法将SNP信息转换成Bin基因型,预测染色体上的重组断点,构建RIL群体高密度BinMap遗传图谱,结合耐热表型数据,运用QTL IciMapping软件完备复合区间ICIM的作图方法,进行高温胁迫下幼苗存活率和耐热等级QTL分析。【结果】构建了一张包含3 321个Bin标记高密度遗传图谱,各染色体Bin标记数为159—400个,标记间平均物理距离为106 kb;利用逐步高温胁迫方式鉴定亲本和RIL家系幼苗耐热表型,高温胁迫下,幼苗存活率和耐热等级存在极显著负相关性,且幼苗存活率与籼型基因频率存在显著正相关性,籼型基因频率越高,耐热性越好,RIL群体表型性状呈现双峰连续分布,苗期耐热性可能受少数几个主效QTL调控;共检测到12个苗期耐热性相关的QTL,其中,调控幼苗存活率和耐热等级的QTL分别有8和4个,幼苗存活率和耐热等级相关QTL存在遗传重叠现象,形成调控耐热性的主效QTL簇、和,三者在调控苗期高温抗逆中具有重要作用,其中,为新发现主效QTL,对增强苗期耐热性具有较强的功效。【结论】构建了一张包含3 321个Bin标记的高密度分子遗传图谱,解析了耐热品种赣早籼58号苗期耐热基因,鉴定出3个苗期耐热调控关键QTL簇,发掘了一个新主效QTL簇,基于高密度遗传图谱高效获取目标区段及候选基因,筛选出8个苗期耐热性调控的关键目标基因。
水稻;高密度图谱;苗期;耐热性;QTL定位
0 引言
【研究意义】随着全球气候变暖,在水稻、小麦、玉米等主要粮食作物生产中,因受高温危害导致减产问题日益凸显[1-3]。水稻起源于低纬度地区,具有较强的喜温特性,但当外界温度超过水稻植株生长发育所需温度的上限时,植株生长发育、产量和品质的形成将会受到高温胁迫的不利影响[4-6]。中国长江流域稻作区早稻灌浆-成熟期、中稻抽穗-开花期期和晚稻移栽-返青期均受到不同程度的高温危害,其中,双季晚稻秧苗移栽正值夏秋高温时段,移栽-返青期高温危害导致幼苗存活率下降、生长势弱,移栽返青后恢复生长慢,高温胁迫导致分蘖与生物量形成不足已成为双季晚稻(尤其是双季晚粳)高产优质化的关键限制因素[7-8]。发掘耐热种质与基因资源是培育耐热水稻新品种并解决高温危害的关键有效途径,也是阐明耐热生理生化和分子遗传机理的基础,已成为分子生物学与遗传育种学研究的热点之一[9]。【前人研究进展】水稻耐热性属于典型的数量性状,受多基因控制,易受环境的影响,存在明显的基因型与环境互作效应[9-10]。近年来,有关水稻耐热性研究报道较多,鉴定的耐热性相关QTL达165个,少数几个耐热主效基因被精细定位或克隆,这为阐明水稻耐热性相关生理生化与分子遗传机制奠定了良好基础[11-12]。目前,水稻耐热性研究多关注于产量和品质直接相关的抽穗-灌浆期耐热调控机制的解析,而有关芽期和苗期等水稻营养生长期耐热性研究报道偏少,其耐热性调控分子遗传机理不甚清楚[9, 13-14]。水稻移栽返青期“早生快发”特性对产量和品质形成存在明显的影响,适宜环境下移栽返青后水稻幼苗迅速恢复生长,高效获取光温水肥资源,促进分蘖与生物量形成,为高产、优质奠定良好的物质基础,而高温环境下热敏感水稻品种幼苗移栽后生长缓慢,这将限制随后的生长发育及产量的形成。【本研究切入点】近年来,长江中下游稻区(如江西、安徽、湖北和浙江等省市)逐步开始发展“籼改粳”或“早籼晚粳”生产模式,移栽-返青期高温危害成为该区域粳稻高产优质的主要限制因子[15-17]。同时,以往多数耐热QTL研究常采用SSR、Indel等标记构建传统遗传图谱,其多态性标记数量和覆盖度相对较少;虽然已获得了一些耐热相关的QTL,但置信区间大,未能有效获取目标区域内关键候选基因,可应用于分子标记辅助育种的位点相对较少,而基于全基因组测序技术构建的高密度遗传图谱在关键QTL发掘中具有明显的优势,便于高效获取目标基因[18-20]。【拟解决的关键问题】本研究以周南稻(热敏品种)和赣早籼58号(耐热品种)杂交衍生RIL群体为试验材料,采用全基因组测序技术获取高密度Bin遗传图谱,鉴定高温胁迫下幼苗存活率与耐热等级,发掘耐热性调控关键QTL及候选基因,以期为水稻苗期耐热性遗传改良提供基因资源。
1 材料与方法
1.1 试验材料及田间试验
利用热敏感粳稻周南稻(Junambyeo,JNB)和强耐热籼稻赣早籼58号(Ganzaoxian58,GZX58)杂交获取F1。周南稻为韩国粳稻品种,赣早籼58号为江西省早籼稻品种。从F2开始采用单粒传法构建RIL群体(F8),包含171个家系。田间试验于2019年在江西省宜春市江西省农业科学院高安综合试验基地进行,种植RIL群体和2个亲本。5月9日播种,6月7日移栽,每个家系种植3行,每行8穴,每穴1苗,行株距为20 cm×16.5 cm。抽穗期取代表性单株挂牌,取剑叶叶片,-80℃保存;成熟后收获挂牌单株的全部稻穗,脱粒晾干,破除休眠后用于后续试验。
1.2 水稻苗期耐热性鉴定评价
利用研究团队前期构建的阶梯式逐步高温胁迫方法,参照刘进等[12]鉴定方法评价水稻苗期耐热性。选取120粒饱满的水稻种子,采用4%次氯酸钠溶液消毒,清水冲洗2—3次,置于培养皿中浸种、催芽36 h。选取芽长长势均匀一致的种子种植于96孔PCR板上,每个家系种植3行,每孔放入1粒芽谷,每行8粒(株),设2个随机重复小区。出苗后间隔3—4 d更换一次营养液(Yoshida),培养幼苗生长至2叶1心或3叶期,剔除长势较弱的幼苗。正常培养和恢复培养条件:28℃光照14 h/24℃黑暗10 h,相对湿度为75%;高温处理采用阶梯式逐步升温和降温方式,高温预处理条件:38℃ 4 h,40℃ 6 h,光照;高温处理条件:45℃光照14 h/40℃黑暗10 h,持续60—72 h;高温递降处理条件:40℃ 6 h、38℃ 4 h,光照,相对湿度均设置为75%;高温处理结束后恢复培养7 d,调查幼苗存活率和耐热等级。幼苗存活率以高温胁迫下存活幼苗数与处理苗数的百分比表示,耐热等级评价依据幼苗存活率、叶绿素含量和新叶、新根生长等情况判定,具体判定标准见表1。设3次独立重复试验,取均值作为统计单元。
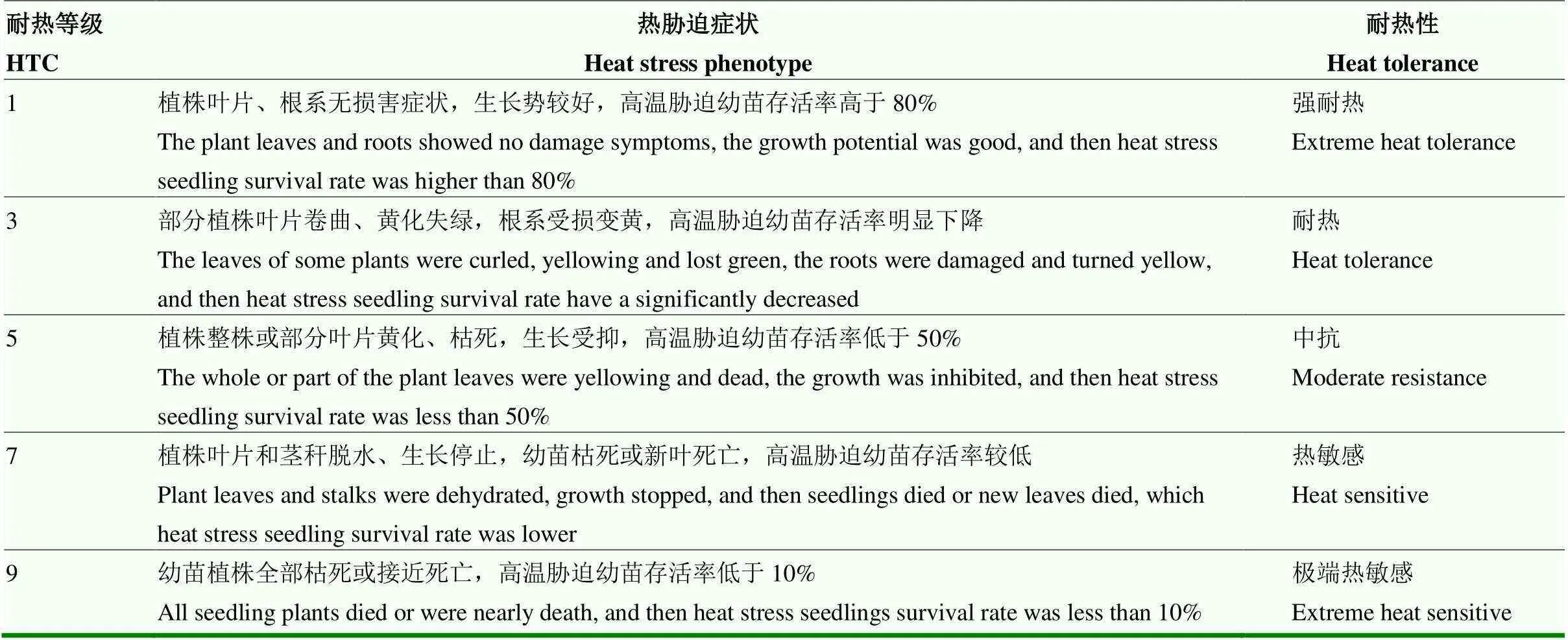
表1 水稻苗期耐热等级判定标准
1.3 RIL群体基因型鉴定与高密度遗传图谱构建
利用Plant Genomic DNA Kit(TIANFEN)试剂盒提取DNA,具体操作过程参考试剂盒说明。配制1%琼脂糖凝胶检测提取DNA质量,并用NanoDrop 2000c DNA检测仪测定DNA浓度,检测合格的DNA用于后续测序分析。本研究基因组测序工作委托北京诺禾致源科技股份有限公司完成。测序和数据初步处理过程如下:(1)高质量DNA样品通过Covaris超声波破碎仪随机打断,末端修复、加A尾、加测序接头、纯化;(2)PCR扩增制备文库,通过Illumina测序仪进行文库测序,并检验建文库质量,将不同文库按有效浓度和目标下机数据量的需求进行pooling分析;(3)利用Illumina HiSeq/MiSeq测序仪进行测序获取原始数据,经过测序接头去除、缺失比率过滤、碱基测序质量检验等过程,提取完善的测序数据用于后续分析。
参考Huang等[21]“滑动窗口”方法寻找交换点,将所有样本中紧密连锁、不发生重组的若干个SNP视为一个整体(Bin标记),以Bin标记起点确定其所在物理位置;根据基因型采用最大似然函数计算重组率,并利用Kosambi作图函数将其转换为遗传距离,采用Jionmap 4.0软件以LOD=6.0为阈值将所有Bin进行连锁群划分,基于三点测验法对连锁群内标记进行排序,并利用最优AIC值确定标记最佳位置。
1.4 QTL分析
基于全基因组测序构建的高密度遗传图谱,采用Wang等[22]QTL ICI Mapping 4.2的完备区间作图(ICIM)方法进行加性效应QTL分析,LOD的阈值设为2.50,当实际求得的LOD值大于LOD阈值时,判定该区段存在1个QTL,同时估算每个QTL的加性效应值和贡献率大小。QTL的命名遵循McCouch[23]原则。
为了进一步验证本试验定位结果的准确性,同时评价筛选到的主效QTL累加效应,利用姜树坤等[24]“选择作图”策略进行QTL验证和累加效应分析。首先将控制苗期耐热性的其他QTL位点根据分子标记数据进行非增效基因的固定,以此来避免其他QTL对后续分析的影响,然后在RIL群体中筛选目标QTL区间的关键重组交换单株,进而对QTL进行验证和累加效应分析。
2 结果
2.1 水稻RIL群体苗期耐热性表型鉴定
高温环境下,对2个亲本与RIL群体各家系进行幼苗存活率和耐热等级鉴定表明,赣早籼58号的苗期耐热性较强,幼苗存活率较高,耐热等级为1.67级,高温胁迫下植株表型基本不受影响;而周南稻对高温胁迫敏感,耐热等级为8.33级,高温处理后幼苗基本全部死亡(图1和图2)。RIL群体中不同家系间耐热性存在明显差异,幼苗存活率和耐热等级均呈现非正态分布的连续分布,水稻苗期耐热性受QTL调控,呈现不明显的双峰分布,可能存在主效QTL作用(图2)。幼苗存活率与耐热等级存在极显著负相关性,相关系数达-0.890,耐热性越强的家系,其幼苗存活率越高,其耐热等级越小;RIL群体家系呈现偏籼型分布,耐热性与籼型频率呈现极显著正相关关系,相关系数为0.516,偏籼家系苗期耐热性明显强于偏粳家系(图3)。
2.2 遗传连锁图谱构建
对亲本和RIL群体171个家系进行DNA测序,测序深度平均值为8.65×。获取高质量多态性SNP位点717 414个,过滤和去除低质量标记后得到318 339个有效SNP标记,提取多态性标记位点基因型。采用滑动窗口策略、步移长度为1检测RIL群体重组断点,将SNP转换为3 321个Bin标记,划分为12个连锁群;利用极大似然法和Kosambi函数对Bin标记进行排序和遗传距离计算;遗传总图距为1 703.09 cM,染色体平均遗传距离为195.3 cM,染色体平均包含276.8个Bin,标记间平均遗传距离为0.51 cM,标记间平均物理距离约为106 kb(图4-A—B和表2)。各连锁群标记遗传图距与物理图距Spearman相关系数均值为0.997,表明遗传标记与基因组存在极显著的共线性关系(图4-C)。各个连锁群bin标记数量、总图距、平均图距等基本信息如表2所示,其中,第3染色体Bin标记数最多,第12染色体Bin标记数最少。
2.3 苗期耐热性QTL定位及候选基因分析
共检测到12个控制苗期耐热性的QTL,分布于第2、3、4、6、7、8、9和12染色体上,LOD值介于2.52—6.52,表型贡献率为5.25%—18.88%,加性效应值介于-17.86%—9.44%(表3和图5)。检测到8个与高温胁迫下幼苗存活率相关的QTL,相关QTL联合贡献率达60.93%,其中,、和被定位在100—178 kb区间,、和被定位在300—409 kb区间,和定位区间相对较大,分别为889和571 kb;被定位在第7染色体Block11026—Block11067区间,物理位置为2 023 438— 2 912 508 bp,贡献率和效应值相对较大,增效等位基因来自赣早籼58号,可显著提升高温胁迫下幼苗存活率。

A:常温培养群体表型;B:高温胁迫处理群体表型;C:高温胁迫处理后2个亲本表型比较;D:RIL群体高温胁迫后不同耐热等级的典型家系表型
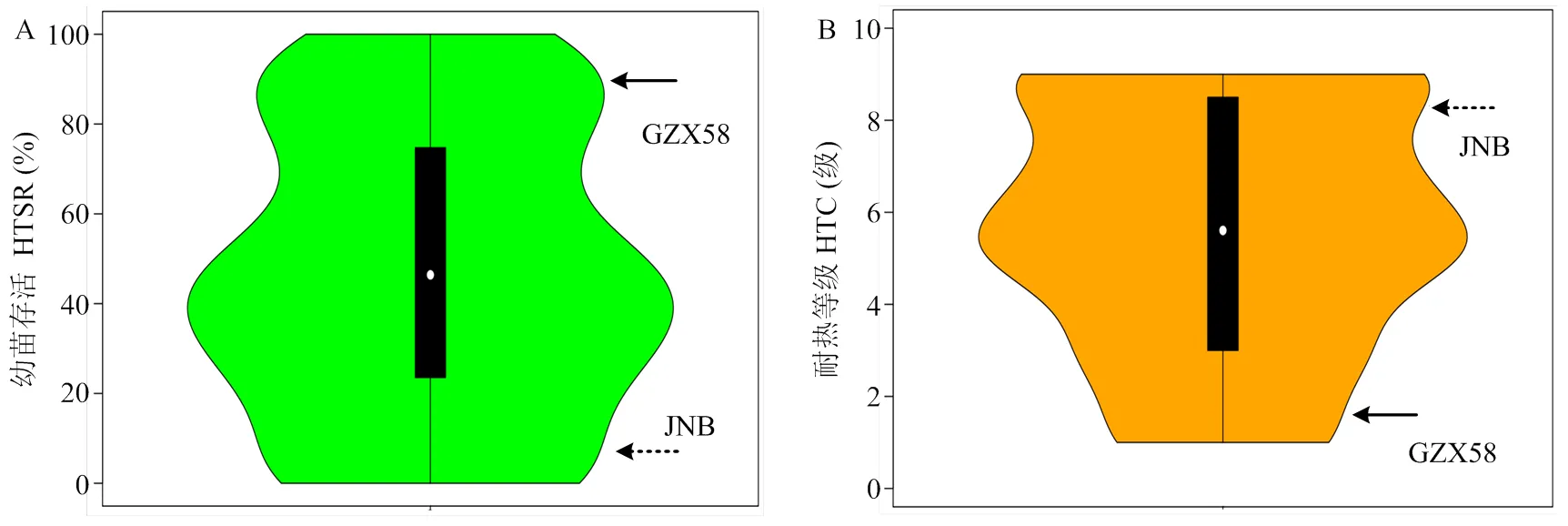
A:高温幼苗存活率HTSR表型分布;B:耐热等级HTC表型分布
共检测到4个调控耐热等级的QTL,分布于第2、7和8染色体上,相关QTL联合贡献率达45.13%,和分别被定位在标记Block4364-4396和Block12456-12597之间,物理距离分别为409和571 kb,和被定位于标记Block3098-3136和Block11026-11067之间。其中,主效QTL贡献率为18.88%,被定位在第7染色体2 023 438— 2 912 508 bp(889 kb),增效等位基因来自赣早籼58号,具有较强调控耐热等级的效应。比较分析还发现,幼苗存活率和耐热等级存在遗传重叠现象,即和、和、和位于相同染色体区域,形成调控耐热的主效QTL簇、和,其中,被定位在第7染色体Block11026-11067区间的主效QTL簇,贡献率和效应值较大,具有明显调控耐热等级和幼苗存活率的功能。
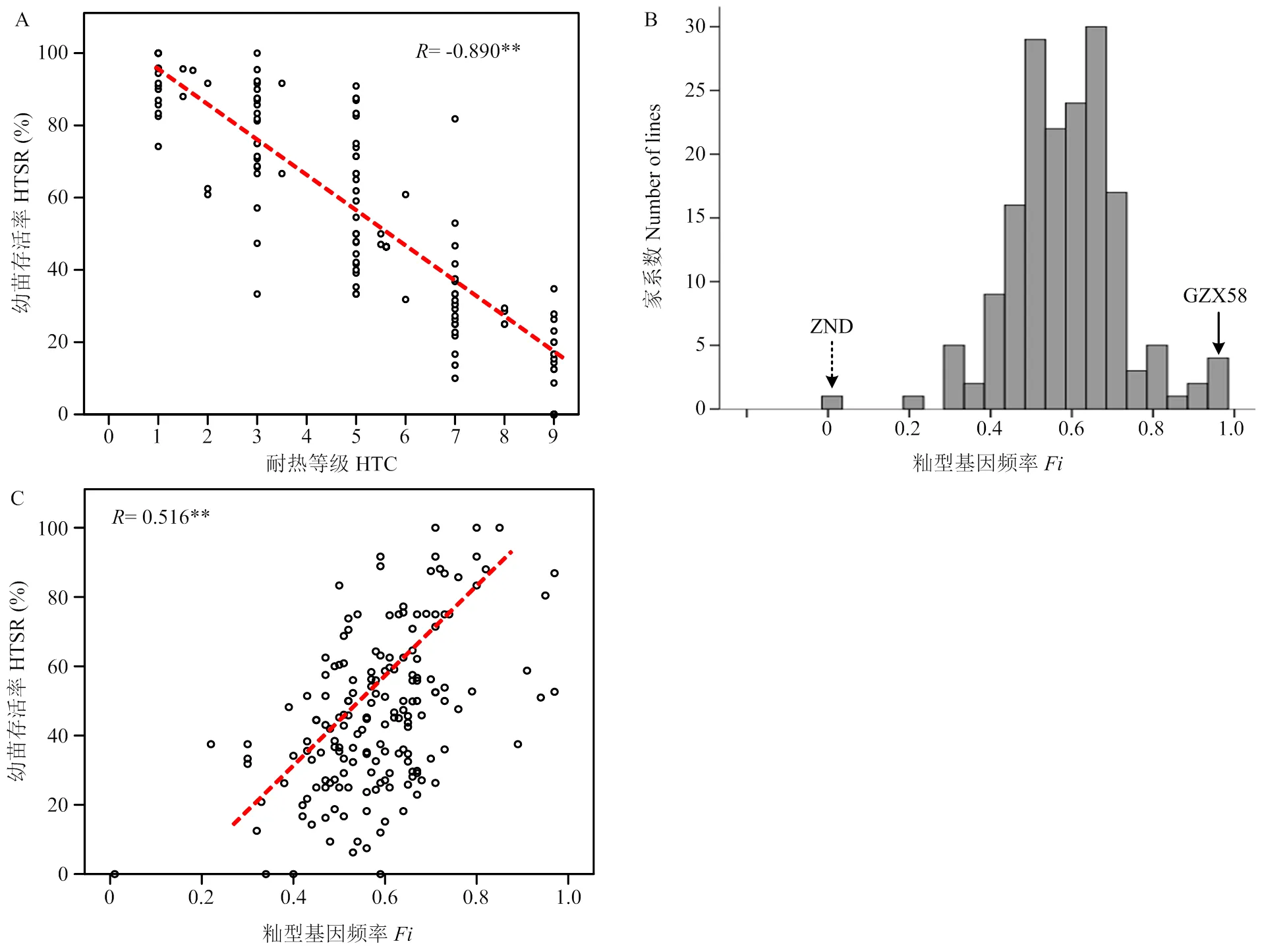
A:幼苗存活率和耐热等级相关关系;B:RIL群体籼型基因频率分布;C:幼苗存活率与籼型基因频率相关分析。**表示极显著相关性
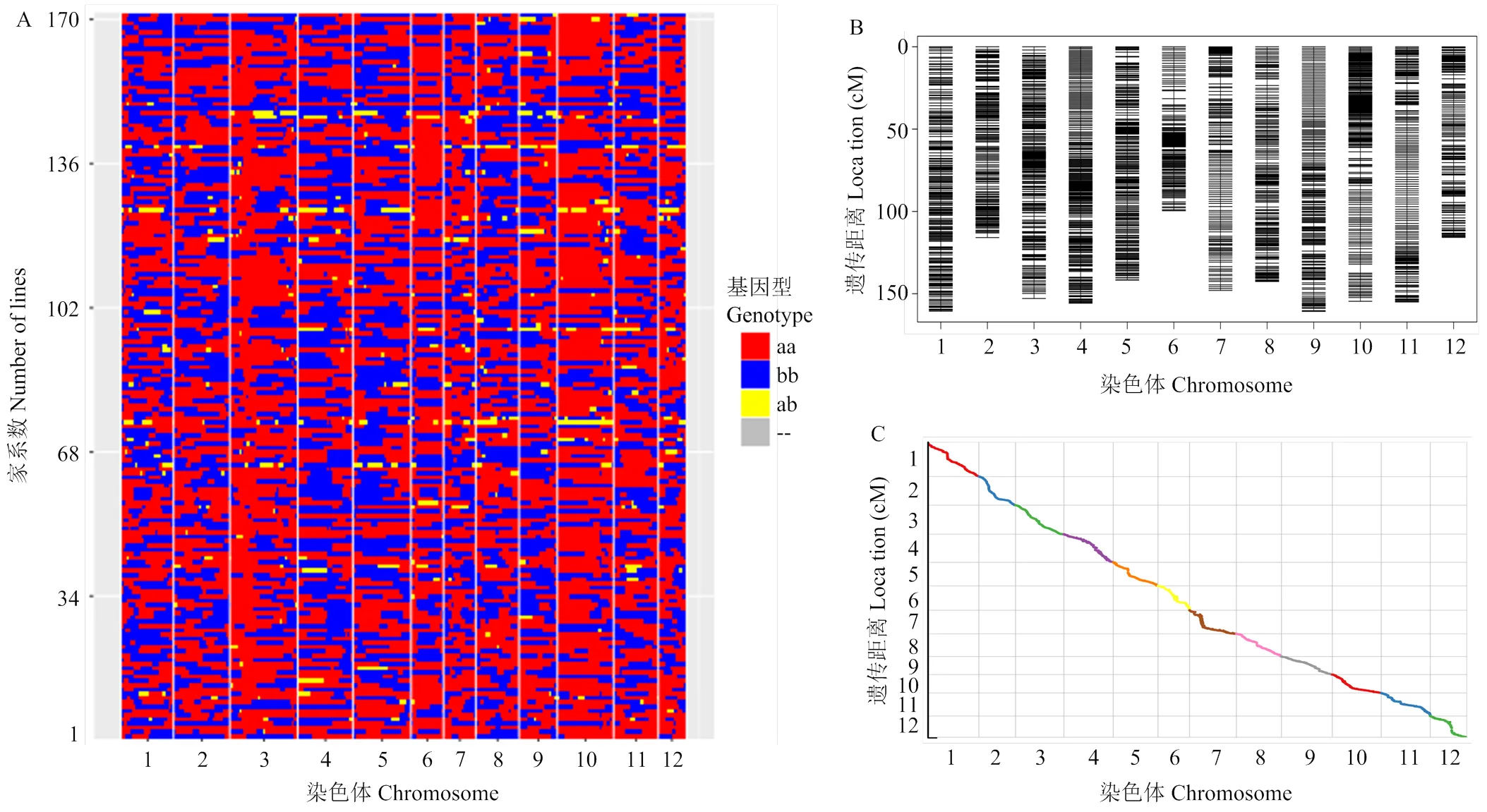
A:高密度Bin标记RIL群体各家系的基因型;B:高密度Bin标记染色体分布;C:连锁群标记遗传图谱与物理图谱相关性
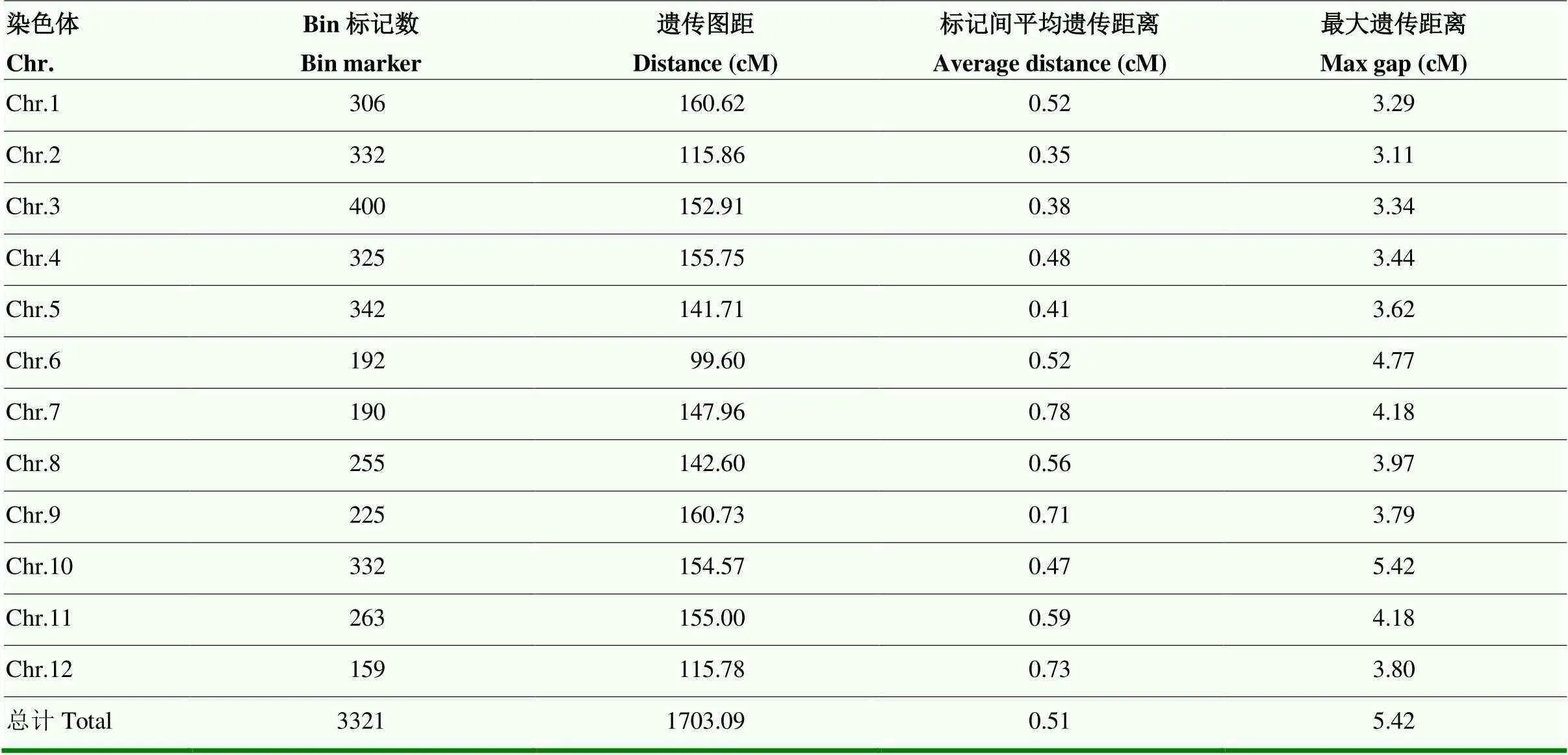
表2 水稻RIL群体遗传连锁图染色体标记分布
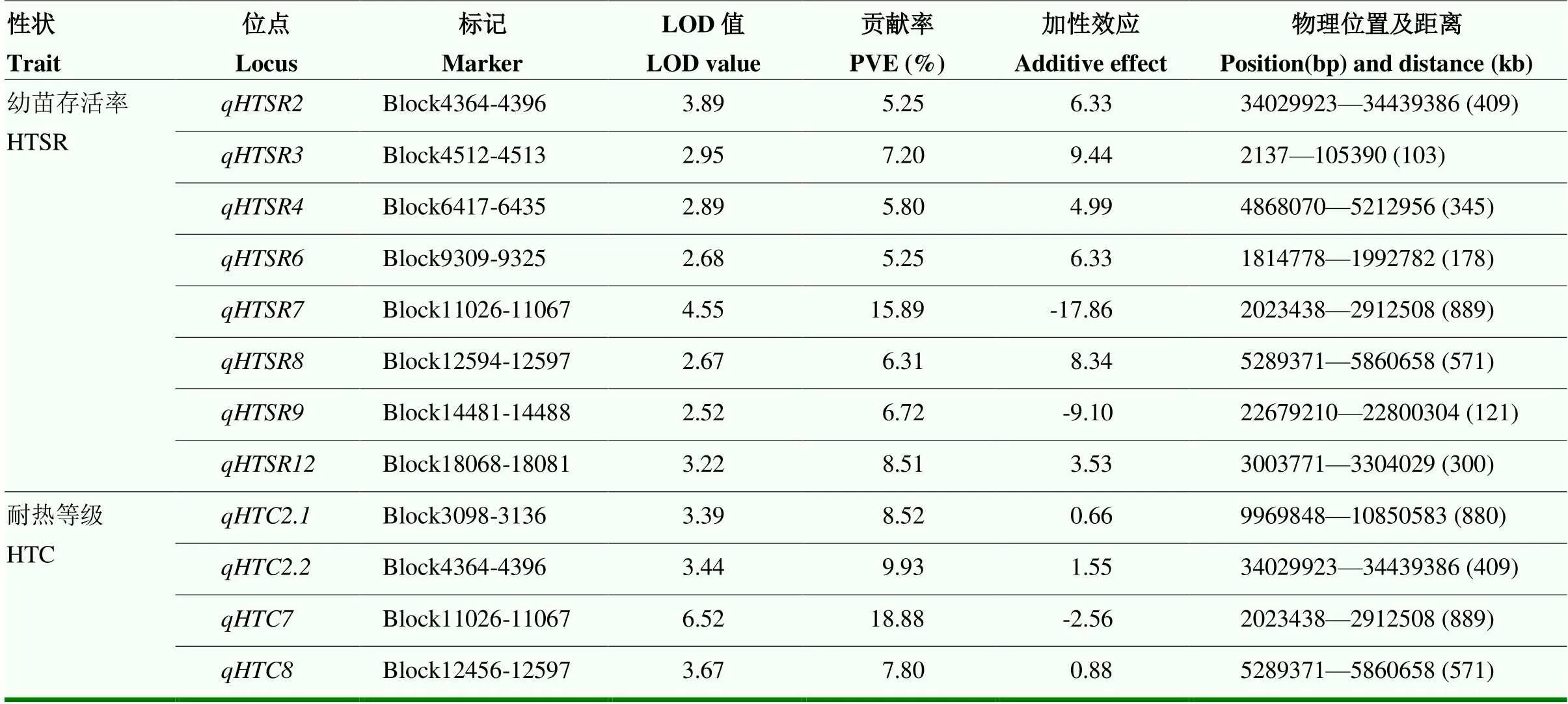
表3 水稻苗期耐热性QTL分析
利用The Rice Annotation Project(RAP)网站对已定位的3个主效QTL簇定位区间开展相关候选基因查询,在定位区间发现95个注释基因,筛选到6个可能与苗期耐热性相关候选基因,分别为、、、、和,其中,编码一个水稻单半乳糖甘油二酯合酶基因,参与耐淹、耐低温和耐旱性胁迫响应,参与光合作用,影响植物生长发育与产量;编码一个热休克蛋白Hsp40分子伴侣,DnaJ结构域含蛋白;编码一个核糖核苷酸还原酶,叶绿体生物合成。定位区间包含112个注释基因,筛选出8个与苗期耐热性相关候选基因,分别为、、、、、、和,其中,编码一个NAC转录因子、ABA诱导的叶片衰老和分蘖,编码一个光敏色素相互作用的bHLH因子,冷诱导的的选择性剪接变体,光与应激信号之间互作,编码一个转录因子,与耐冷胁迫响应相关。定位区间包含了85个注释基因,筛选到8个可能影响苗期耐热性相关的候选基因,分别为、、、、、、和,其中,编码一个乌头酸酶,热胁迫响应基因,编码一个乙二醛酶I,参与非生物应激响应,编码NAC转录因子,参与抗旱性调控,这些抗逆相关的预测基因可能是与水稻苗期耐热性相关主效QTL簇的关键候选基因(表4)。
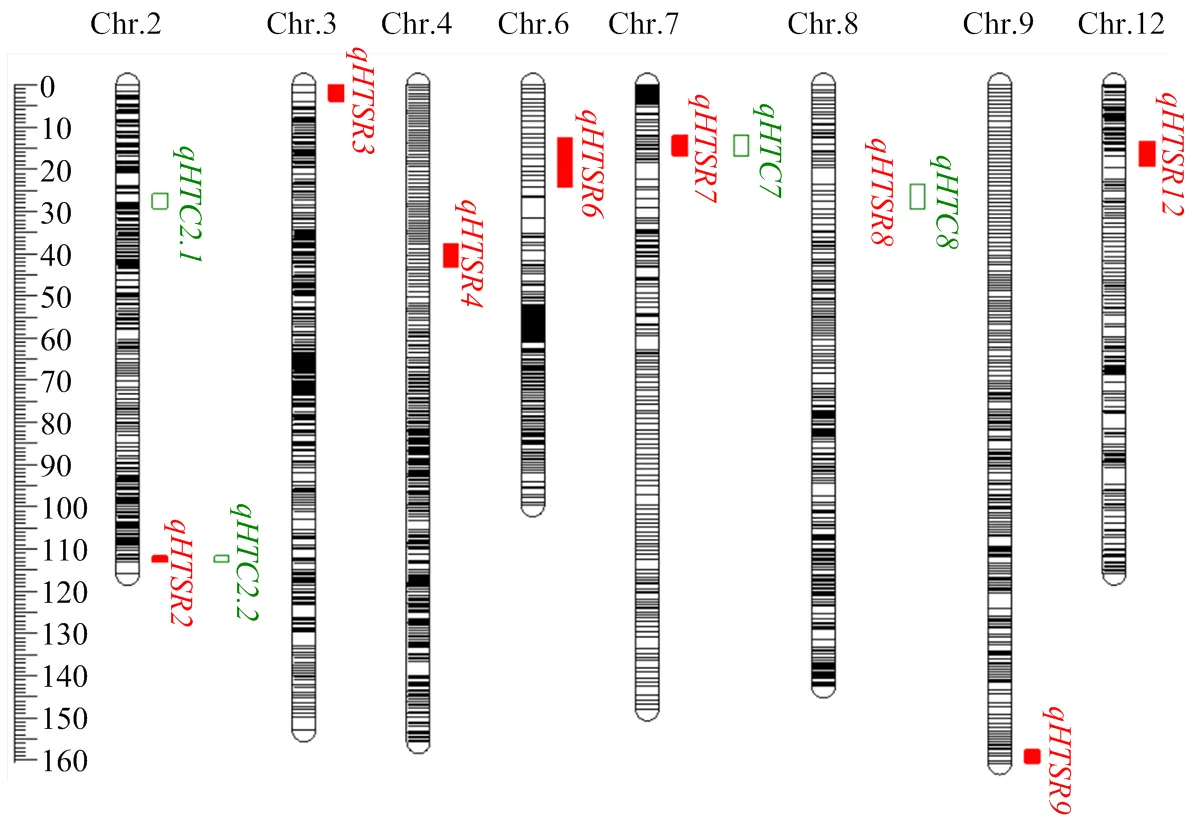
红色实心和绿色条框分别表示幼苗存活率和耐热等级QTL Red solid and green box indicate the QTL for HTSR and HTC, respectively
2.4 苗期耐热性主效QTL累加效应及功能验证分析
利用姜树坤等[24]“选择作图”策略进行主效QTL的验证与累加效应分析。研究表明,不含苗期耐热主效QTL簇的周南稻和家系在高温胁迫下幼苗存活率分别为(5.20±1.20)%和(1.00±0.10)%,高温胁迫下耐热等级均为9级,为极端热敏感型种质(图6和图7);同时含有、和的赣早籼58号和家系在高温处理下幼苗存活率分别为(78.32±5.36)%和(78.00±12.00)%,耐热等级为1级或3级,耐热性极显著强于周南稻和其他基因型家系,为强耐热型种质;含有3个主效QTL簇中任一位点的家系高温处理下幼苗存活率为11.25%—46.32%,幼苗存活率明显高于不含主效QTL簇的家系,耐热等级为3—5级,属于中间型材料;基因型为+、+的家系在高温处理下幼苗存活率显著高于含单一主效QTL簇的家系,耐热等级为1—3级,为耐热型种质,且和效应明显强于(图6和图7)。表明3个主效QTL簇在RIL群体聚合时主要表现为累加效应,包含2个或3个主效QTL簇的家系耐热性较强。
3 讨论
3.1 水稻苗期耐热相关QTL比较
随着全球气候变暖,水稻生产面临的非生物逆境越来越多,包括干旱、高温、低温和盐碱胁迫等,其中,高温危害已成为影响水稻生长发育、产量和品质形成的重要瓶颈,耐热优异种质和主效QTL鉴定发掘已成为分子生物学和育种研究关注的热点之一[25-27]。水稻耐热性属于数量性状,受多基因调控,存在明显的环境互作效应,高效规范的鉴定方法是获取准确的表型数据和发掘主效QTL的重要保证[28-30]。国内外一些研究者利用不同类型遗传群体,发掘了165个耐热相关QTL,精细定位或克隆了10个耐热关键基因,水稻耐热性调控遗传机制研究取得较大进展,但有关水稻苗期耐热性鉴定和QTL定位研究相对较少,其分子遗传机制尚不清楚[9, 31-32]。LI等[33]利用染色体片段替换系,定位到5个耐热相关QTL,并克隆了一个控制苗期耐热性的;Liu等[34]鉴定了一个苗期耐热基因,该基因编码一个E3泛素连接酶,通过促进H2O2诱导气孔关闭来提高水稻耐热性;Wang等[35]鉴定了一个高温敏感的矮化突变体,编码一个温度介导和节律调控的DEAD-BoxRNA解旋酶,表达受高温胁迫诱导,调控细胞增殖和植株生长发育;KAN等[36]在热带粳稻鉴定了一个耐热性基因,该基因编码一个G蛋白γ亚基,当功能缺失时将增强水稻营养生长期和生殖生长期的耐热性,当功能正常时,呈现出热敏感表型,呈现出耐热表型;Zhang等[37]定位到一个控制水稻高温抗性的QTL,含有的非洲栽培稻CG14具有较强的耐高温性,随后研究表明,耐热性基因存在2个相互拮抗的基因和,其中,正调控抗性,而负调控抗性,且位于遗传上游发挥功能。本研究团队前期构建了水稻苗期耐热性快速鉴定的技术方法,利用耐热型中优早8号和高温敏感型龙稻5号杂交衍生的RIL群体为试验材料,共检测到12个控制苗期耐热性的QTL,相关QTL成簇分布于第1、4、5和8染色体,并利用剩余杂合体验证了主效QTL簇的功能[12]。本研究利用高温敏感型周南稻与耐热型赣早籼58号杂交构建RIL群体,基于全基因组测序构建高密度遗传图谱,共鉴定到12个耐热性相关QTL,比较分析发现/与Ravikiran等[38]定位的,与Ye等[39]和刘进等[12]鉴定的、,与Chen等[32]鉴定的,与Ravikiran等[38]定位的、所在染色体区域相近,这些QTL在不同群体中重演性较好,具有较强的调控水稻耐热性的效应,而、、、和为新发现的5个QTL。高温胁迫下幼苗存活率与耐热等级存在显著相关性,检测到的QTL存在明显的遗传重叠现象,形成3个苗期耐热性调控主效QTL簇(和)、(和)和(和),具有调控耐热等级和幼苗存活率的多效性功能,其中,主效QTL的LOD值、贡献率和效应值较大,为新发现的苗期耐热性调控位点。
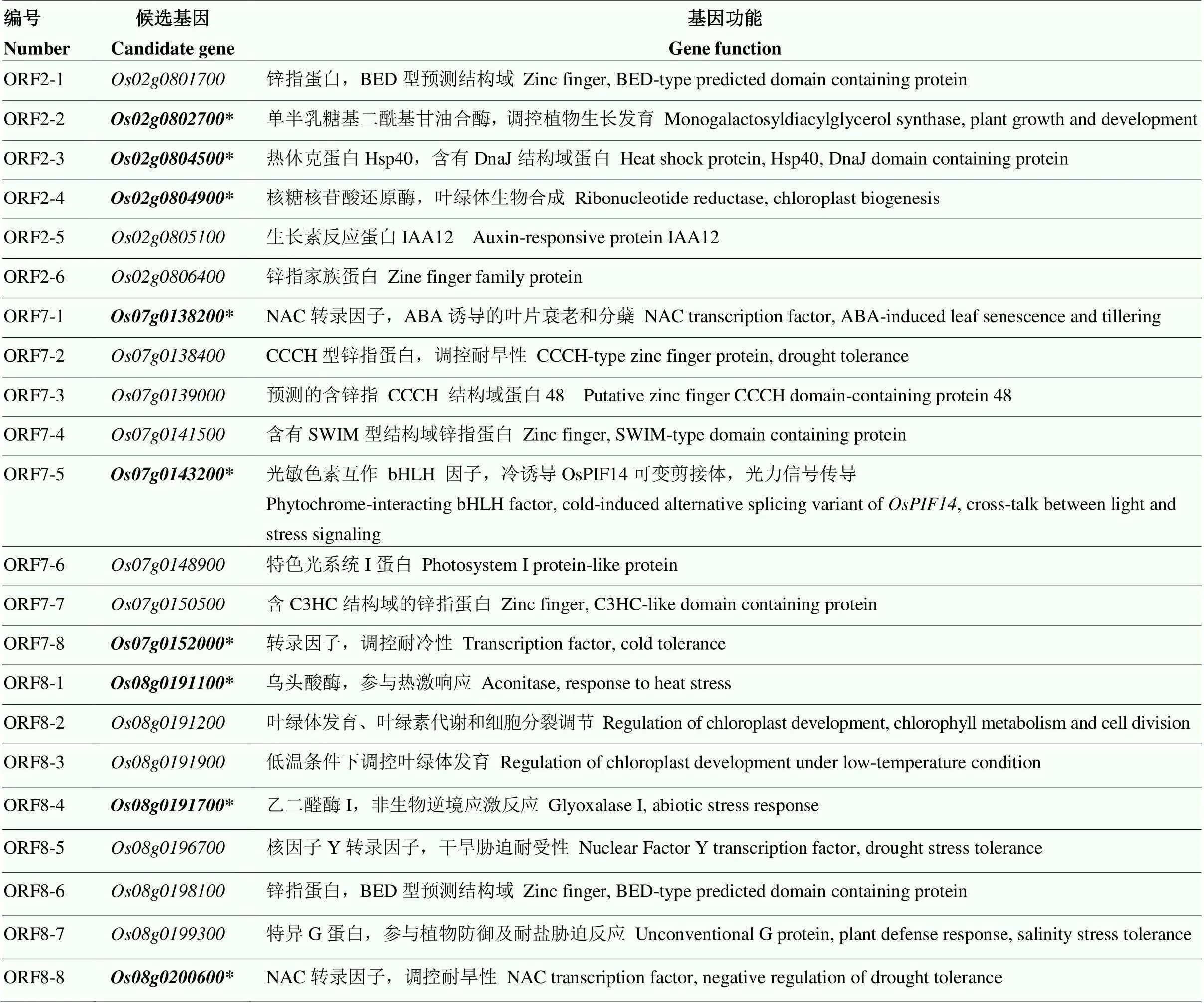
表4 主效QTL簇定位区间关键候选基因分析
加粗与*表示苗期耐热显著关联候选基因Bold and * indicate candidate genes for significant association of heat tolerance at seedling stage
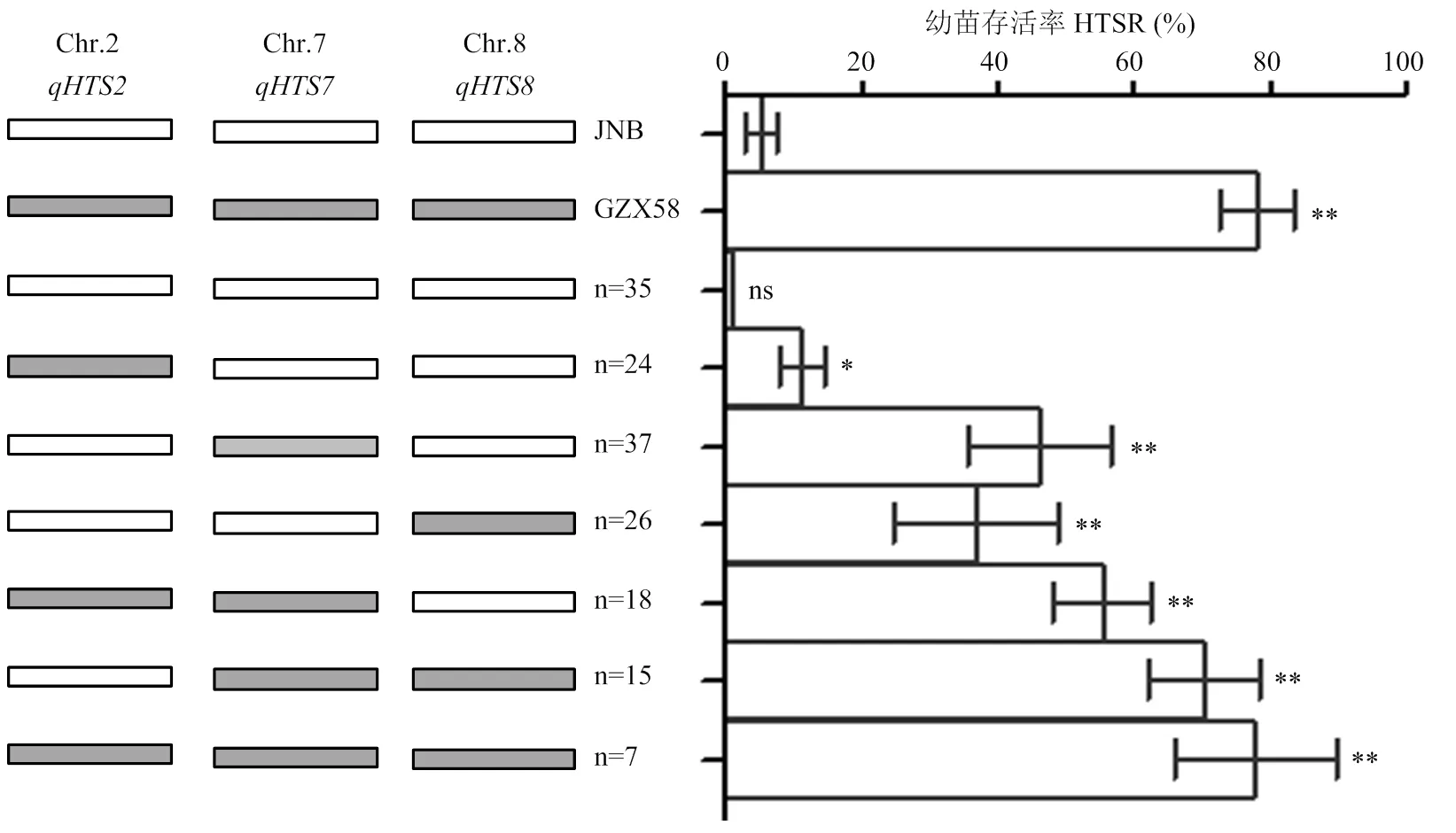
*和**分别表示在0.05和0.01水平差异显著,ns表示无显著差异。n:某一基因型家系数量,共计171个家系,9个家系基因型杂合或缺失

A和C为亲本赣早籼58号和周南稻苗期高温胁迫表型,赣早籼58号包含主效QTL簇qHTS2、qHTS7和qHTS8,周南稻不含正效应主效QTL,为—基因型;B和D为不同类型基因聚合效果,R162、R93、R102、R61、R67和R20基因型分别为qHTS7+qHTS8、qHTS2+qHTS7、qHTS7、qHTS8、qHTS2和—;A和B为水培环境下高温胁迫表型,C和D为土培环境下高温胁迫处理表型
3.2 高密度遗传图谱发掘QTL优势
以往传统QTL定位中,遗传图谱常采用RFLP、SSR、InDel等分子标记构建完成,受多态性遗传标记的数量、覆盖密度限制,定位区间一般较大,不能有效地压缩定位区间和筛选目标基因,后期精细定位工作量较大,且许多QTL仍未被发现[40-41]。近年来,随着高通量测序技术的发展及成本的不断降低,高通量测序可获取大量多态性SNP标记,具有高通量、全覆盖、省时省力等优势,有利于高效、精确定位主效QTL和发掘候选基因,已成为作物高密度遗传图谱构建及重要性状基因快速、高效发掘的关键技术[42-44]。高密度遗传图谱包含数量巨大的SNP标记,可采用连锁分析、QTL-seq、QTL-BSA和生物信息学等技术相结合促进关键基因的发掘[24, 45-47]。董骥驰等[48]基于高密度Bin标记的遗传图谱,在4个环境下共定位到14个影响水稻抽穗期的QTL,其中为稳定表达的置信区间为28.15—28.65 Mb,包含33个注释基因,其中,、和功能与抽穗期紧密相关且存在多个变异位点;张健等[41]利用GBS测序技术构建高密度遗传图谱,检测到5个QTL簇、、、和,基于较小的高密度遗传图谱定位QTL区间,结合功能注释和数据库表达谱信息在和定位区间分别筛选到7个籽粒大小候选基因,最终将和确定为目标基因;赵凌等[49]构建了包含12 328个Bin标记的高密度遗传图谱,不同环境下共检测到19个抽穗期叶绿素含量相关QTL,其中,和在不同环境下稳定表达,通过物理位置比对和功能注释及亲本间序列差异分析,在定位区间发现2个叶绿素含量相关目标基因,分别为天冬氨酸氨基转移酶基因()和叶面斑点相关蛋白基因()。本研究采用全基因组测序技术构建的高密度Bin图谱,获取318 339个SNP,简并成3 321个Bin标记,标记间遗传距离为0.51 cM,标记间平均物理距离为106 kb,12个主效QTL所定位区段的物理距离为103—889 kb,QTL定位目标区间相对较小,可利用目标区段物理位置快速筛选候选基因,这与以往利用传统SSR等标记图谱初步锁定的5—10 cM的QTL候选区间存在明显差异[3, 50]。因此,高密度遗传图谱有助于高效精准获取关键QTL的目标区段,也为分子标记辅助选择育种奠定良好的基础。同时,主效QTL簇、和分别被定位在Chr.2:34 029 923—34 439 386 bp(409 kb)、Chr.7:2 023 438—2 912 508 bp(889 kb)和Chr.8:5 289 371—5 860 658 bp(571 kb)区域内,候选区域内分别筛选到95个、112个和85个注释基因,目标候选区域与候选基因数量与董骥驰等[48]、赵凌等[49]利用高密度遗传图谱鉴定结果存在较大差异,基于基因注释功能最终筛选出22个抗逆性相关的基因作为关键候选基因,这为继续开展水稻耐热性候选基因的功能研究提供了数据基础。
以往研究中RIL群体数量一般为200—250个株系,进行适度基因型选择使目标群体有效株系的基因充分重组,提高全基因组水平QTL作图的精度,为QTL精细定位和克隆提供支撑[18, 51]。本研究将主效QTL的目标区域锁定在3—6个标记之间,候选区域为400—700 kb,这导致预测的候选基因相对较多,较难精准筛选出关键目标基因,主要原因可能是所构建的RIL群体家系偏少,仅含171个家系,且群体遗传组分偏向籼稻,导致定位目标区域内基因重组不充分,难以成功压缩定位区间;若遗传群体(F2和RIL等)具有足够数量的遗传个体,主效QTL有可能被精细定位在2个标记间,目标区域可精确到100 kb以内,目标候选基因也将被高效精准筛选,这将为目标QTL的精细定位和生物学功能解析奠定基础。
4 结论
构建了周南稻与赣早籼58号杂交衍生的RIL群体的高密度遗传图谱,该图谱包含3 321个Bin标记,总图距1 703.09 cM,相邻2个Bin标记间的平均遗传图距为0.51 cM;构建优化水稻苗期耐热鉴定方法,以高温胁迫下幼苗存活率和耐热等级为指标,共检测到12个苗期耐热性相关的QTL,相关位点在染色体上成簇分布,发现3个效应明显的主效QTL簇(、和),其中,为新发现的效应明显的主效QTL,定位区段内共有112个注释基因,仅有8个注释基因与抗逆性相关,、和0为调控苗期耐热性的关键候选基因;同时,利用Bin标记鉴定RIL群体不同家系主效QTL的基因型,结合耐热表型性状初步验证了主效、和在苗期高温胁迫响应中的生物学功能。
[1] 杨沈斌, 申双和, 赵小艳, 赵艳霞, 许吟隆, 王主玉, 刘娟, 张玮玮. 气候变化对长江中下游稻区水稻产量的影响. 作物学报, 2010, 36(9): 1519-1528.
Yang S B, Shen S H, Zhao X Y, Zhao Y X, Xu Y L, Wang Z Y, Liu J, Zhang W W. Impacts of climate changes on rice production in the middle and lower reaches of the Yangtze River. Acta Agronomica Sinica, 2010, 36(9): 1519-1528. (in Chinese)
[2] IPCC. Climate change 2013: The physical science basis contribution of working group I to the fifth assessment report of the inter governmental panel on climate change. Cambridge: Cambridge University Press, 2013: 1-36.
[3] 张桂莲, 廖斌, 唐文帮, 陈立云, 肖应辉. 稻米垩白性状对高温耐性的QTL分析. 中国水稻科学, 2017, 31(3): 257-264.
Zhang G L, Liao B, Tang W B, Chen L Y, Xiao Y H. Identifying QTLs for thermo-tolerance of grain chalkiness trait in rice. Chinese Journal of Rice Science, 2017, 31(3): 257-264. (in Chinese)
[4] 段骅, 唐琪, 剧成欣, 刘立军, 杨建昌. 抽穗灌浆早期高温与干旱对不同水稻品种产量和品质的影响. 中国农业科学, 2012, 45(22): 4561-4573.
Duan H, Tang Q, Ju C X, Liu L J, Yang J C. Effect of high temperature and drought on grain yield and quality of different rice varieties during heading and early grain filling periods. Scientia Agricultura Sinica, 2012, 45(22): 4561-4573. (in Chinese)
[5] 王小波, 关攀锋, 辛明明, 汪永法, 陈西勇, 赵爱菊, 刘曼双, 李红霞, 张明义, 逯腊虎, 魏亦勤,刘旺清,张金波,倪中福,姚颖垠,胡兆荣,彭惠茹,孙其信. 小麦种质资源耐热性评价. 中国农业科学, 2019, 52(23): 4191-4200.
Wang X B, Guan P F, Xin M M, Wang Y F, Chen X Y, Zhao A J, Liu M S, Li H X, Zhang M Y, Lu L H, Wei Y Q, Liu W Q, Zhang J B, Ni Z F, Yao Y Y, Hu Z R, Peng H R, Sun Q X. Evaluation of heat tolerance in wheat germplasm resources. Scientia Agricultura Sinica, 2019, 52(23): 4191-4200. (in Chinese)
[6] 姜树坤, 王立志, 杨贤莉, 迟力勇, 李忠杰, 李明贤, 张喜娟, 赵茜, 李锐, 姜辉, 李文华. 不同生育时期增温对寒地水稻产量和品质的影响. 中国农业科技导报, 2021, 23(6): 130-139.
Jiang S K, Wang L Z, Yang X L, ChI L Y, Li Z J, Li M X, Zhang X J, Zhao Q, Li R, Jiang H, Li W H. Effect of increasing temperature in different growth stages on rice yield and quality in cold regions. Journal of Agricultural Science and Technology, 2021, 23(6): 130-139. (in Chinese)
[7] 于江辉, 赵森, 周浩, 孟秋成, 蒋建雄, 肖国樱. 分期播种对耐高温东北粳稻农艺性状的影响及耐热性评价. 中国生态农业学报, 2012, 20(8): 1037-1042.
Yu J H, Zhao S, Zhou H, Meng Q C, Jiang J X, Xiao G Y. Effect of interval sowing on agronomic traits and thermo-tolerance of japonica rice from Northeast China. Chinese Journal of Eco- Agriculture, 2012, 20(8): 1037-1042. (in Chinese)
[8] 花劲, 周年兵, 张军, 张洪程, 霍中洋, 周培建, 程飞虎, 李国业, 黄大山, 陈忠平, 陈国梁, 戴其根, 许轲, 魏海燕, 高辉, 郭保卫. 双季稻区晚稻“籼改粳”品种筛选. 中国农业科学, 2014, 47(23): 4582-4594.
Hua J, Zhou N B, Zhang J, Zhang H C, Huo Z Y, Zhou P J, ChenG F H, Li G Y, Huang D S, Chen Z P, Chen G L, Dai Q G, Xu K, Wei H Y, Gao H, Guo B W. Selection of late rice cultivars of japonica rice switched from indica rice in double cropping rice area. Scientia Agricultura Sinica, 2014, 47(23): 4582-4594. (in Chinese)
[9] 杨军, 章毅之, 贺浩华, 李迎春, 陈小荣, 边建民, 金国花, 李翔翔, 黄淑娥. 水稻高温热害的研究现状与进展. 应用生态学报, 2020, 31(8): 2817-2830.
Yang J, Zhang Y Z, He H H, Li Y C, Chen X R, Bian J M, Jin G H, Li X X, Huang S E. Current status and research advances of high-temperature hazards in rice. Chinese Journal of Applied Ecology, 2020, 31(8): 2817-2830. (in Chinese)
[10] 刘鸣, 李玉花, 解莉楠. 水稻非生物胁迫相关QTL研究进展. 植物生理学报, 2013, 49(12): 1301-1308.
Liu M, Li Y H, Xie L N. Progress in QTL research for abiotic stress in rice. Plant Physiology Journal, 2013, 49(12): 1301-1308. (in Chinese)
[11] 曹志斌, 李瑶, 曾博虹, 毛凌华, 蔡耀辉, 吴晓峰, 袁林峰. 非洲栽培稻垩白粒率耐热性QTL的定位. 中国水稻科学, 2020, 34(2): 135-142.
Cao Z B, Li Y, Zeng B H, Mao L H, Cai Y H, Wu X F, Yuan L F. QTL mapping for heat tolerance of chalky grain rate of. Chinese Journal of Rice Science, 2020, 34(2): 135-142. (in Chinese)
[12] 刘进, 崔迪, 余丽琴, 张立娜, 周慧颖, 马小定, 胡佳晓, 韩冰, 韩龙植, 黎毛毛. 水稻苗期耐热种质资源筛选及QTL定位. 中国水稻科学, 2022, 36(3): 259-268.
Liu J, Cui D, Yu L q, Zhang L N, Zhou H Y, Ma X D, Hu J X, Han B, Han L Z, Li M M. Screening and QTL mapping of heat-tolerant rice (L.) germplasm resources at seedling stage. Chinese Journal of Rice Science, 2022, 36(3): 259-268. (in Chinese)
[13] 赵凌, 赵春芳, 王建, 陈涛, 赵庆勇, 姚姝, 王才林. 20个水稻引进资源的花药开裂及苗期耐热性评价. 植物遗传资源学报, 2017, 18(5): 968-973.
Zhao L, Zhao C F, Wang J, Chen T, Zhao Q Y, Yao S, Wang C L. Analyzing of length dehiscence at basal part of thecae and heat resistance during seedling stage of 20 introduced rice germplasms. Journal of Plant Genetic Resources, 2017, 18(5): 968-973. (in Chinese)
[14] 冯活仪, 江浩林, 王孟, 唐湘如, 段美洋, 潘圣刚, 田华, 王树丽, 莫钊文. 不同香稻品种苗期耐高温的形态生理响应. 中国水稻科学, 2019, 33(1): 68-74.
Feng H Y, Jiang H L, Wang M, Tang X R, Duan M Y, Pan S G, Tian H, Wang S L, Mo Z W. Morphophysiological responses of different scented rice varieties to high temperature at seedling stage. Chinese Journal of Rice Science, 2019, 33(1): 68-74. (in Chinese)
[15] 许红云, 许为军, 谭学林. 高温对粳稻品种发芽及幼苗生长发育影响的研究. 西南农业学报, 2008, 21(3): 593-596.
Xu H Y, Xu W J, Tan X L. Effect of continuing high temperature on germination and seedling development ofjaponica rice. Southwest China Journal of Agricultural Sciences, 2008, 21(3): 593-596. (in Chinese)
[16] 张长海, 汪向东, 李立中, 方金旭. 常规粳稻在安徽沿江稻区的特征特性研究. 中国稻米, 2017, 23(4): 190-198.
Zhang C H, Wang X D, Li L Z, Fang J X. Study on characteristics of japonica rice in anhui area along the Yangtze River. China Rice, 2017, 23(4): 190-198. (in Chinese)
[17] 陈波, 周年兵, 郭保卫, 黄大山, 陈忠平, 花劲, 霍中洋, 张洪程. 南方稻区“籼改粳”研究进展. 扬州大学学报(农业与生命科学版), 2017, 38(1): 67-88.
Chen B, Zhou N B, Guo B W, Huang D S, Chen Z P, Hua J, Huo Z Y, Zhang H C. Progress of "indica rice to japonica rice" in southern China. Journal of Yangzhou University (Agricultural and Life Science Edition), 2017, 38(1): 67-88. (in Chinese)
[18] 李慧慧, 张鲁燕, 王建康. 数量性状基因定位研究中若干常见问题的分析与解答. 作物学报, 2010, 36(6): 918-931.
Li H H, Zhang L Y, Wang J K. Analysis and answers to frequently asked questions in quantitative trait locus mapping. Acta Agronomica Sinca, 2010, 36(6): 918-931. (in Chinese)
[19] Yang J, Sun K, Li D X, Luo L X, Liu Y Z, Huang M, Yang G L, Liu H, Wang H, Chen Z Q, Guo T. Identification of stable QTLs and candidate genes involved in anaerobic germination tolerance in rice via high-density genetic mapping and RNA-Seq. BMC Genomics, 2019, 20: 15.
[20] 张亚东, 梁文化, 赫磊, 赵春芳, 朱镇, 陈涛, 赵庆勇, 赵凌, 姚姝, 周丽慧, 路凯, 王才林. 水稻RIL群体高密度遗传图谱构建及粒型QTL定位. 中国农业科学, 2021, 54(24): 5163-5176.
Zhang Y D, Liang W H, He L, Zhao C F, Zhu Z, Chen T, Zhao Q Y, Zhao L, Yao S, Zhou L H, Lu K, Wang C L. Construction of high-density genetic map and QTL analysis of grain shape in rice RIL population. Scientia Agricultura Sinica, 2021, 54(24): 5163-5176. (in Chinese)
[21] Huang X, Feng Q, Qian Q, Zhao Q, Wang L, Wang A H, Guan J P, Fan D L, Weng Q J, Huang T, Dong G J, Sang T, Han B. High-throughput genotyping by whole-genome resequencing. Genome Research, 2009, 19(6): 1068-1076.
[22] Wang J K, Li H H, Zhang L Y, Meng L. QTL IciMapping Version 4.2. http://www.isbreeding.net, 2019.
[23] McCouch S R. Gene nomenclature system for rice. Rice, 2008, 1: 72-84.
[24] 姜树坤, 王立志, 杨贤莉, 李伟杰, 董世晨, 车韦才, 李忠杰, 迟力勇, 李明贤, 张喜娟, 姜辉, 李锐, 赵茜, 李文华. 基于高密度SNP遗传图谱的粳稻芽期耐低温QTL鉴定. 作物学报, 2020, 46(8): 1174-1184.
Jiang S K, Wang L Z, Yang X L, Li W J, Dong S C, Che W C, Li Z J, Chi L Y, Li M X, Zhang X J, Jiang H, Li R, Zhao Q, Li W H. Detection of QTLs controlling cold tolerance at bud bursting stage by using a high-density SNP linkage map in japonica rice. Acta Agronomica Sinca, 2020, 46(8): 1174-1184. (in Chinese)
[25] 田小海, 罗海伟, 周恒多, 吴晨阳. 中国水稻热害研究历史、进展与展望. 中国农学通报, 2009, 25(22): 166-168.
Tian X H, Luo H W, Zhou H D, Wu C Y. Research on heat stress of rice in China: Progress and prospect. Chinese Agricultural Science Bulletin, 2009, 25(22): 166-168. (in Chinese)
[26] 万丙良, 查中萍. 气候变暖对水稻生产的影响及水稻耐高温遗传改良. 中国农学通报, 2012, 28(36): 1-7.
Wan B L, Zha Z P. Effects of climate warming on rice production and genetic improvement for rice heat tolerance. Chinese Agricultural Science Bulletin, 2012, 28(36): 1-7. (in Chinese)
[27] 凌霄霞, 张作林, 翟景秋, 叶树春, 黄见良. 气候变化对中国水稻生产的影响研究进展. 作物学报, 2019, 45(3): 323-334.
Ling X X, Zhang Z L, Zhai J Q, Ye S C, Huang J L. A review for impacts of climate change on rice production in China. Acta Agronomica Sinica, 2019, 45(3): 323-334. (in Chinese)
[28] Jagadish S V K, Craufurd P Q, Wheeler T R. High temperature stress and spikelet fertility in rice (L.). Journal of Experimental Botany, 2007, 58(7): 1627-1635.
[29] 陈慧, 高梅, 熊方建, 杨毅. 水稻耐热性的鉴定方法研究. 四川大学学报(自然科学版), 2012, 46(6): 1331-1336.
Chen H, Gao M, Xiong F J, Yang Y. Study on method of rice heat tolerance. Journal of Sichuan University (Natural Science Edition), 2012, 46(6): 1331-1336. (in Chinese)
[30] Cao Z B, Li Y, Tang H W, Zeng B H, Tang X Y, Long Q Z, XF W u, Cai Y H, Yuan L F, Wan J L. Fine mapping of theQTL, which confers heat tolerance at the booting stage, using an. introgression line. Theoretical and Applied Genetics, 2020,133(4): 1161-1175.
[31] 唐婷, 陈艳艳, 杨洋, 杨远柱, 孟桂元, 周静. 水稻耐高温性研究进展. 分子植物育种, 2017, 15(9): 3694-3700.
Tang T, Chen Y Y, Yang Y, Yang Y Z, Meng G Y, Zhou J. Research progress of rice resistance to high temperature. Molecular Plant Breeding, 2017, 15(9): 3694-3700. (in Chinese)
[32] Chen L, Wang Q, Tang M, Zhang X, Pan Y, Yang X, Gao G, Lv R, Tao W, Jiang L, Liang T. QTL Mapping and identification of candidate genes for heat tolerance at the flowering stage in rice. Frontiers in Genetics, 2021, 11: 621871.
[33] Li X M, Chao D Y, Wu Y, Huang X H, Chen K, Cui L G, Su L, Ye W W, Chen H, Chen H C, Dong N Q, Guo T, Shi M, Feng Q, Zhang P, Han B, Shan J X, Gao J P, Lin H X. Natural alleles of a proteasome α2 subunit gene contribute to thermotolerance and adaptation of African rice. Nature Genetics, 2015, 47(7): 827-833.
[34] Liu J P, Zhang C C, Wei C C, Liu X, Wang M G, Yu F F, Xie Q, Tu J M. The RING finger ubiquitin E3 ligaseenhances heat tolerance by promotingH2O2-induced stomatal closure in rice. Plant Physiology, 2016, 170: 429-443.
[35] Wang D, Qin B X, Li X, Tang D, Zhang Y E, Cheng Z K, Xue Y B. Nucleolar DEAD-Box RNA helicaseregulates thermotolerant growth as aPre-rRNA chaperone in rice. PLoS Genetics, 2016, 12(2): e1005844.
[36] Kan Y, Mu X R, Zhang H, Gao J, han J X, Ye W W, Lin H X.controls rice thermotolerance through SCT1-dependent alteration of wax biosynthesis. Nature Plants, 2022, 8: 53-67.
[37] Zhang H, Zhou J F, Kan Y, Shan J X, Ye W W, Dong N Q, Guo T, Xiang Y H, Yang Y B, Li Y C, Zhao H Y, Yu H X, Lu Z Q, Guo S Q, Lei J J, Liao B, Mu X R, Cao Y J, Yu J J, Lin Y S, Lin H X. A genetic module at one locus in rice protects chloroplasts to enhance thermotolerance. Science, 2022, 376: 1293-1300.
[38] Ravikiran K T, Krishnan S G, Vinod K K, Dhawan G, Dwivedi P, Kumar P, Bansal V P, Nagarajan M, Bhowmick P K, Ellur R K, Bollinedi H, Pal M, Mithra A C R, Singh A K. A trait specific QTL survey identifies NL44, a NERICA cultivar as a novel source for reproductive stage heat stress tolerance in rice. Plant Physiology Reports, 2020, 25(4): 1-13.
[39] Ye C, Tenorio F A, Redona E D, Cortezano P S M, Cabrega G A, Jagadish K S V, Gregorio G B. Fine-mapping and validatingto increase spikelet fertility under heat stress at flowering in rice. Theoretical and Applied Genetics, 2015, 128: 1507-1517.
[40] 胡苗, 孙志忠, 孙学武, 谭炎宁, 余东, 刘瑞芬, 袁贵龙, 丁佳, 袁定阳, 段美娟. 利用高密度SNP标记定位水稻粒形相关QTL. 杂交水稻, 2015, 30(5): 54-58.
Hu M, Sun Z Z, Sun X W, Tan Y N, Yu D, Liu R F, Yuan G L, Ding J, Yuan D Y, Duan M J. Mapping of rice grain shape relevant QTLs using high-density SNP markers. Hybrid Rice, 2015, 30(5): 54-58. (in Chinese)
[41] 张健, 杨靖, 王豪, 李冬秀, 杨瑰丽, 黄翠红, 周丹华, 郭涛, 陈志强, 王慧. 基于高密度遗传图谱定位水稻籽粒大小相关性状QTL. 中国农业科学, 2020, 53(2): 225-238.
Zhang J, Yang J, Wang H, Li D X, Yang G L, Huang C H, Zhou D H, Guo T, Chen Z Q, Wang H. QTL mapping for grain size related traits based on a high-density map in rice. Scientia Agricultura Sinica, 2020, 53(2): 225-238. (in Chinese)
[42] 秦伟伟, 李永祥, 李春辉, 陈林, 吴迅, 白娜, 石云素, 宋燕春, 张登峰, 王天宇, 黎裕. 基于高密度遗传图谱的玉米籽粒性状QTL定位. 作物学报, 2015, 41(10): 1510-1518.
Qin W W, Li Y X, Li C H, Chen L, Wu X, Bai N, Shi Y S, Song Y C, Zhang D F, Wang T Y, Li Y. QTL mapping for kernel related traits based on a high-density genetic map. Acta Agronomica Sinica, 2015, 41(10): 1510-1518. (in Chinese)
[43] 刘凯, 邓志英, 李青芳, 张莹, 孙彩铃, 田纪春, 陈建省. 利用高密度SNP遗传图谱定位小麦穗部性状基因. 作物学报, 2016, 42(6): 820-831.
Liu K, Deng Z Y, Li Q F, Zhang Y, Sun C L, Tian J C, Chen J S. Mapping QTLs for wheat panicle traits with high density SNP genetic map. Acta Agronomica Sinica, 2016, 42(6): 820-831. (in Chinese)
[44] 王朝欢, 宋博文, 余思佳, 肖武名, 黄明. 基于全基因组测序构建水稻RIL群体遗传图谱. 华南农业大学学报, 2021, 42(2): 44-50.
Wang C H, Song B W, Yu S J, Xiao W M, Huang M. Construction of a genetic map of rice RILs based on whole genome sequencing. Journal of South China Agricultural University, 2021, 42(2): 44-50. (in Chinese)
[45] Zhang Y, Wang L, Xin H, Li D, Ma C, Ding X, Hong W, Zhang X. Construction of a high-density genetic map for sesame based on large scale marker development by specific length amplified fragment (SLAF) sequencing. BMC Plant Biology, 2013, 13: 141.
[46] Kong W L, Zhang C H, Zhang S C, Qiang Y L, Zhang Y, Zhong H, Li Y S. Uncovering the novel QTLs and candidate genes of salt tolerance in rice with linkage mapping, RTM-GWAS, and RNA-seq. Rice, 2021, 14: 93.
[47] Lei L, Zheng H L, Bi Y L, Yang L M, Liu H L, Wang J G, Sun J, Zhao H W, Li X W, Li J M, Lai Y C, Zou D T. Identification of a major qtl and candidate gene analysis of salt tolerance at the bud burst stage in rice (L.) using QTL-Seq and RNA-Seq. Rice, 2020, 13: 14.
[48] 董骥驰, 杨靖, 郭涛, 陈立凯, 陈志强, 王慧. 基于高密度Bin图谱的水稻抽穗期QTL定位. 作物学报, 2018, 44(6): 938-946.
Dong J C, Yang J, Guo T, Chen L K, Chen Z Q, Wang H. QTL mapping for heading date in rice using high-density Bin map. Acta Agronomica Sinica, 2018, 44(6): 938-946. (in Chinese)
[49] 赵凌, 张勇, 魏晓东, 梁文化, 赵春芳, 周丽慧, 姚姝, 王才林, 张亚东. 利用高密度Bin图谱定位水稻抽穗期剑叶叶绿素含量QTL. 中国农业科学, 2022, 55(5): 825-836.
Zhao L, Zhang Y, Wei X D, Liang W H, Zhao C F, Zhou L H, Yao S, Wang C L, Zhang Y D. Mapping of QTLs for chlorophyll content in flag leaves of rice on high-density Bin map. Scientia Agricultura Sinica, 2022, 55(5): 825-836. (in Chinese)
[50] 刘进, 姚晓云, 刘丹, 余丽琴, 李慧, 王棋, 王嘉宇, 黎毛毛. 不同生态环境下水稻穗部性状QTL鉴定. 中国水稻科学, 2019, 33(2): 124-134.
Liu J, Yao X Y, Liu D, Yu L Q, Li H, Wang Q, Wang J Y, Li M M. Identification of QTL for panicle traits under multiple environments in rice (L.). Chinese Journal of Rice Science, 2019, 33(2): 124-134. (in Chinese)
[51] Yan J B, TANG J H, MENG Y J, MA X Q, TENG W T, Subhash C, LI L, LI J S. Improving QTL mapping resolution based on genotypic sampling-A case using a RIL population. Acta Genetica Sinica, 2006, 33(7): 617-624.
Construction of High Density Genetic Map for RIL population and QTL Analysis of Heat Tolerance at Seedling Stage in Rice (L.)
Liu Jin1,2, Hu Jiaxiao1, Ma XiaoDing2, Chen Wu1, Le Si1, Jo Sumin3, Cui Di2, Zhou HuiYing1, Zhang Lina1, Shin Dongjin3, Li Maomao1, Han Longzhi2, Yu Liqin1
1Rice Research Institute, Jiangxi Academy of Agricultural Sciences/Research Center of Jiangxi Crop Germplasm Resources, Nanchang 330200, China;2Institute of Crop Sciences, Chinese Academy of Agricultural Sciences, Beijing 100081, China;3Department of Southern Area Crop Science, National Institute of Crop Science, Rural Development Administration, Milyang 627-803, South Korea
【Objective】With global warming, high temperature has an increasing impact on food crop safe. Excavation of heat tolerance gene resources is the most direct green ecological method to cultivate new varieties of heat resistance and eliminate the harm of high temperature, which also the basis for clarifying the physiological, biochemical and molecular genetic mechanism of heat tolerance.【Method】Establishing the identification and evaluation method of heat tolerance at seedling stage, a set of RIL populations was structured from the extreme heat-tolerance Ganzaoxian58(GZX58) and heat-sensitive Junambyeo (JNB), and then the high density genetic map was constructed using genotyping by resequencing technology. To converting SNP information into Bin genotype of the RIL population using sliding window method, which predicting the recombination breakpoints on the chromosomes, finally a high density BinMap genetic map was constructed. Based on the genotype and phenotype data of the 171 lines, QTL mapping of the high temperature seedling survival rate (HTSR) and heat tolerance class (HTC) was performed by ICIM method of the QTL IciMapping software.【Result】A high-density genetic map containing 3 321 Bin markers was constructed, the number of Bin markers for each chromosome between 159 and 400, the average physical distance two markers was about to 106 kb; heat tolerance of the parents and RIL populations was identified by stepwise heat stress at seedlings stage, there have a significant negative correlation between HTSR and HTC, in addition, there has a significant positive correlation between HTSR and indica gene frequency (), which the higher of the, the heat tolerance is better; the bi-modal continuous distribution of phenotype traits from the RIL population showed that the heat tolerance is regulated by few major QTL. A total of 12 QTL controlling with heat tolerance at seedling stage, there have 8 and 4 QTL regulating for HTSR and HTC, respectively. There has a significant genetic overlap from HTSR and HTC,,and, three major QTL cluster play an important role in regulating the heat tolerance at seedling stage. Among these QTL,was a novel major QTL cluster, which has a strong effect on enhancing the heat resistance at seedling stage. 【Conclusion】We constructed a high density genetic linkage map containing 3 321 Bin markers, which be used to analyzed the heat tolerance gene from the GZX58 at seedling stage, there have three key QTL cluster identified associated with the heat tolerance, a novel QTL clusterwas discovered, efficient acquisition of target segments and candidate genes based on high-density genetic mapping, eight key candidate genes were selected by bioinformatics for regulation of the heat tolerance.
rice; high-density genetic map; seedling stage; heat tolerance; QTL mapping

10.3864/j.issn.0578-1752.2022.22.001
2022-07-04;
2022-08-12
国家重点研发计划(2021YFD1200500,2021YFD1200501-7)、江西现代农业科研协同创新专项(JXXTCXQN202205,JXXTCX202101)
刘进,E-mail:riceliujin@163.com。通信作者韩龙植,E-mail:hanlongzhi@caas.cn。通信作者余丽琴,E-mail:lqyu480@163.com
(责任编辑 李莉)

