磁共振T2WI、DWI对直肠癌新辅助治疗疗效的评估价值
肖 欢,赵振华,周 莹,谢梦雨,刘启榆*
1.西南医科大学临床医学院,四川 泸州 646000;2.电子科技大学医学院附属绵阳医院/绵阳市中心医院,四川绵阳,621000
直肠癌近年来发病率逐年升高,由于直肠癌患者诊断时多数已处于中晚期导致手术无法切除,随着现代肿瘤治疗学的发展,新辅助治疗广泛应用于进展期直肠癌的术前治疗,新辅助治疗可以使局部进展期直肠癌出现不同程度的退缩,甚至达到病理上的完全缓解,但是由于患者个体差异,部分患者对于新辅助治疗并不敏感[1]。精准甄别新辅助治疗疗效,实现直肠癌患者的个体化治疗,以最小的放化疗毒性获取理想的治疗效果与远期生存一直是临床关注的热点,磁共振检查能够显示出病变肠段肿瘤特征表现,表现出肿瘤浸润肠壁各层信号变化,弥散加权成像可以对水分子扩散能力和运动方向进行显示,对细胞完整性与病理变化情况进行反映,但是目前磁共振检查应用于直肠癌新辅助化疗中的作用价值临床说法不一[2]。本研究分析了磁共振成像T2WI、弥散加权成像(DWI)在直肠癌新辅助治疗疗效的作用。
1 资料与方法
1.1 一般资料
选取直肠癌患者92例,时间范围:2019年1月至2021年1月。其中男性55例,女性37例;年龄27~72岁,平均年龄(53.40±8.91)岁。本次研究获得医院伦理委员会批准。纳入标准:在我院治疗,且经病理活检确诊;MRI检查前未行抗肿瘤治疗;单一病灶;患者及家属知情同意。排除标准:MRI图像运动伪影;未完成全程新辅助治疗;合并有其他系统恶性肿瘤者。
1.2 治疗方法
患者开展同期放化疗。放疗方案:放疗照射野上界在第5腰椎下缘,前后两侧范围超出真性骨盆边缘1 cm,以骶骨后方和股骨头中心为前后缘,下界至会阴下缘;靶区勾画:临床靶区(clinical target volume,CTV)包括瘤床、直肠系膜区、骶前区、闭孔区、髂内血管区;计划靶区(planning target volume,PVT)较CTV向外扩展,左右外扩5 mm,前后上下外扩10 mm。剂量:45~50.4 Gy,28次完成。化疗方案选择mFOLFOX6,放疗结束后6~8周开展手术治疗。
术后病理肿瘤退缩分级标准[3]:0级为肿瘤无退缩;1级为肿瘤小部分被纤维组织或血管病变取代;2级为肿瘤主体被纤维组织取代,内部残存少量肿瘤细胞或细胞团;3级为肿瘤基本被纤维组织取代,内部残存极少量肿瘤细胞,伴或不伴有黏液成分;4级为肿瘤完全被纤维组织取代,无肿瘤细胞残留。将2~4级作为治疗有效,0~1级作为治疗无效。
1.3 检查方法
仪器采用8通道阵列3.0T超导MRI扫描仪(Verio syngo,德国西门子生产)。患者均接受直肠动态对比增强MRI检查。轴位T2WI FRFSE序列,TR 3680 ms,TE 101 ms,FOV 260 cm×260 cm,矩阵256×320,层厚4 mm,层间距1 mm;轴位T1WI FSE序列:TR 600 ms,TE:Min Full ms,FOV 38 cm×38 cm,矩阵224×384,层厚6 mm,层间距2 mm;矢状位T2WI SSFSE序列:TR 3240 ms,TE 105 ms,FOV 260 mm×260 mm,矩阵256×320,层厚6 mm,层间距1 mm;轴位T1WI C+:TR 5.21 ms,TE 1.76 ms,矩阵 640×432,FOV 192 mm×192 mm,动态增强扫描30个期相,动态增强过程采用VIVE序列扫描,对比剂选择钆喷酸葡胺,3 mL/s速率注射,剂量0.1 mmol/kg,等剂量生理盐水冲洗,在120 s对比增强扫描,总扫描时间为300 s。DWI采用EPI-stir序列,扫描参数:TR 900 ms,TE 40.3 ms(b=50 s/mm2),TE 53.8 ms(b=400 s/mm2),TE 76.7 ms(b=800 s/mm2),层厚=7 mm,层距=1 mm,3次信号采集。通过测量计算,最终获得肿瘤绝对信号值(SIT)、肿瘤绝对信号值减低率(SITRR)、肿瘤相对信号值(SIT/M)、肿瘤相对信号值减低率(SIT/MRR),以及表观扩散系数(ADC)。
1.4 统计学处理
2 结果
2.1 治疗有效和无效患者临床资料比较
在年龄、TNM分期中,治疗无效和治疗有效患者差异有统计学意义(P<0.05);治疗有效和无效患者性别、肿瘤直径、病变部位比较差异无统计学意义(P>0.05)。见表1。
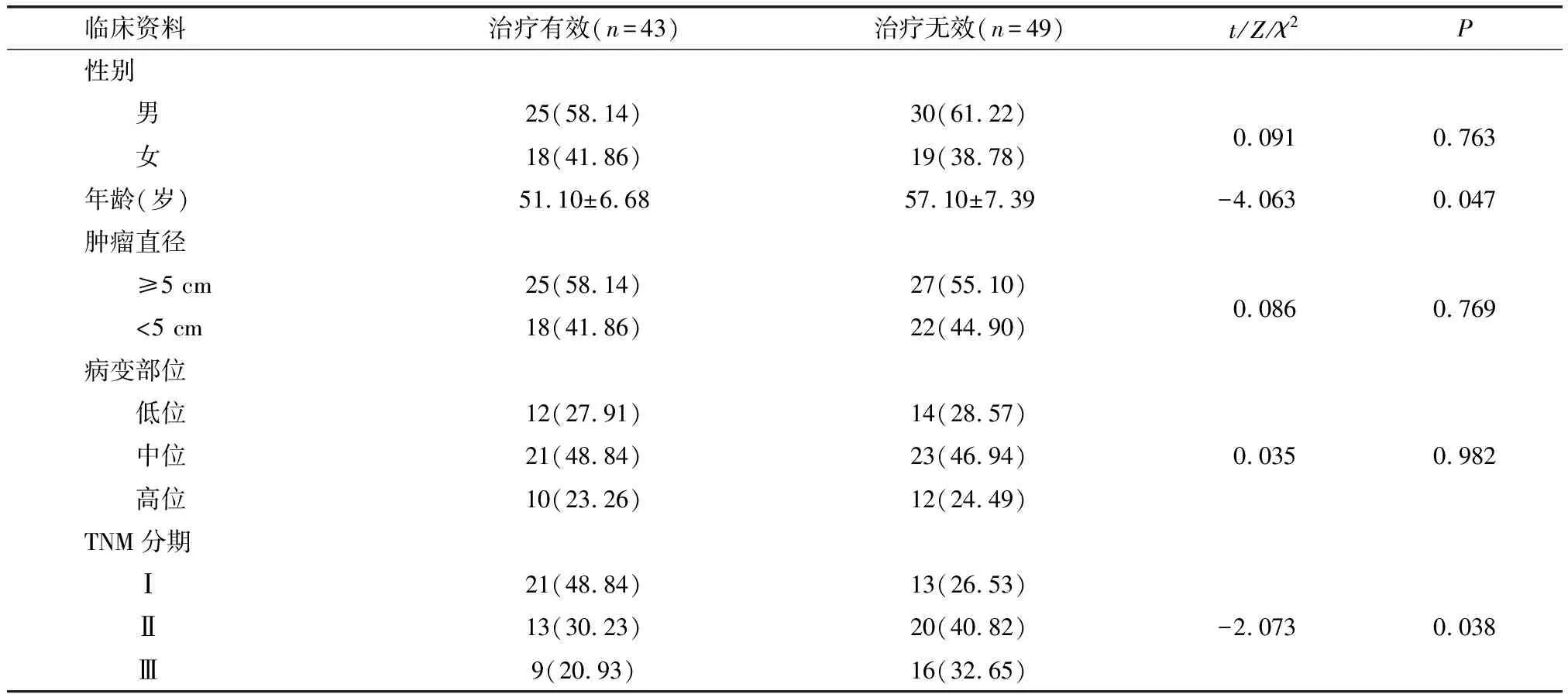
表1 患者临床资料比较
2.2 治疗有效和无效患者T2WI图像参数比较
治疗无效患者治疗后SIT明显高于治疗有效患者(P<0.05),而SITRR、治疗后SIT/M、SIT/MRR明显低于治疗有效患者(P<0.05);治疗有效和无效患者治疗前SIT、治疗前SIT/M比较差异无统计学意义(P>0.05)。见表2。
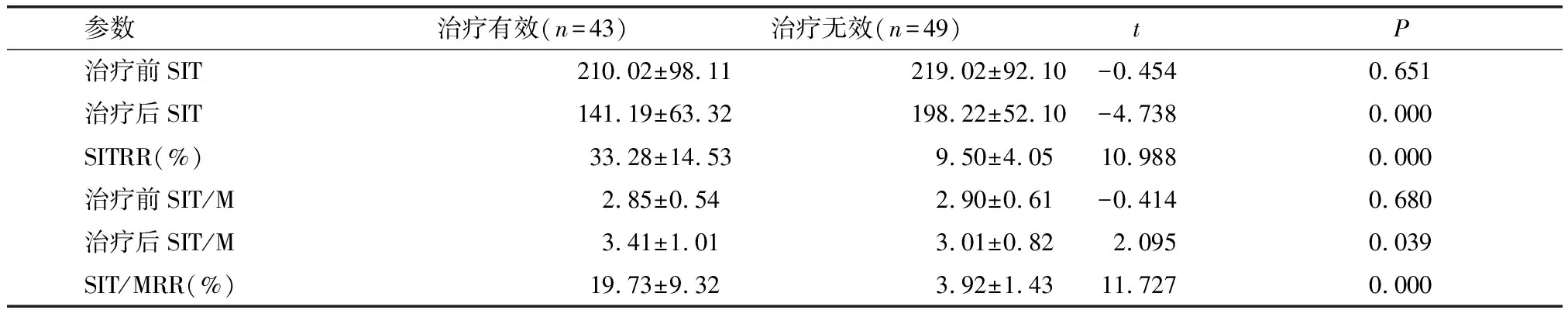
表2 T2WI图像参数比较
2.3 治疗有效和无效患者ADC值比较
治疗无效患者治疗后ADC值、ADC变化值明显低于治疗有效患者(P<0.05);治疗有效和无效患者治疗前ADC值比较差异无统计学意义(P>0.05)。见表3。

表3 患者ADC值比较
2.4 T2WI图像参数及ADC值的预测价值
治疗后SIT、SITRR、SIT/MRR预测治疗有效的ROC曲线下面积分别为0.671、0.950和0.879(P<0.05),治疗后SIT/M预测治疗有效的ROC曲线下面积为0.581(P>0.05)。见图1。治疗后ADC值、ADC变化值预测治疗有效的ROC曲线下面积分别为0.717和0.977(P<0.05)。见图2。
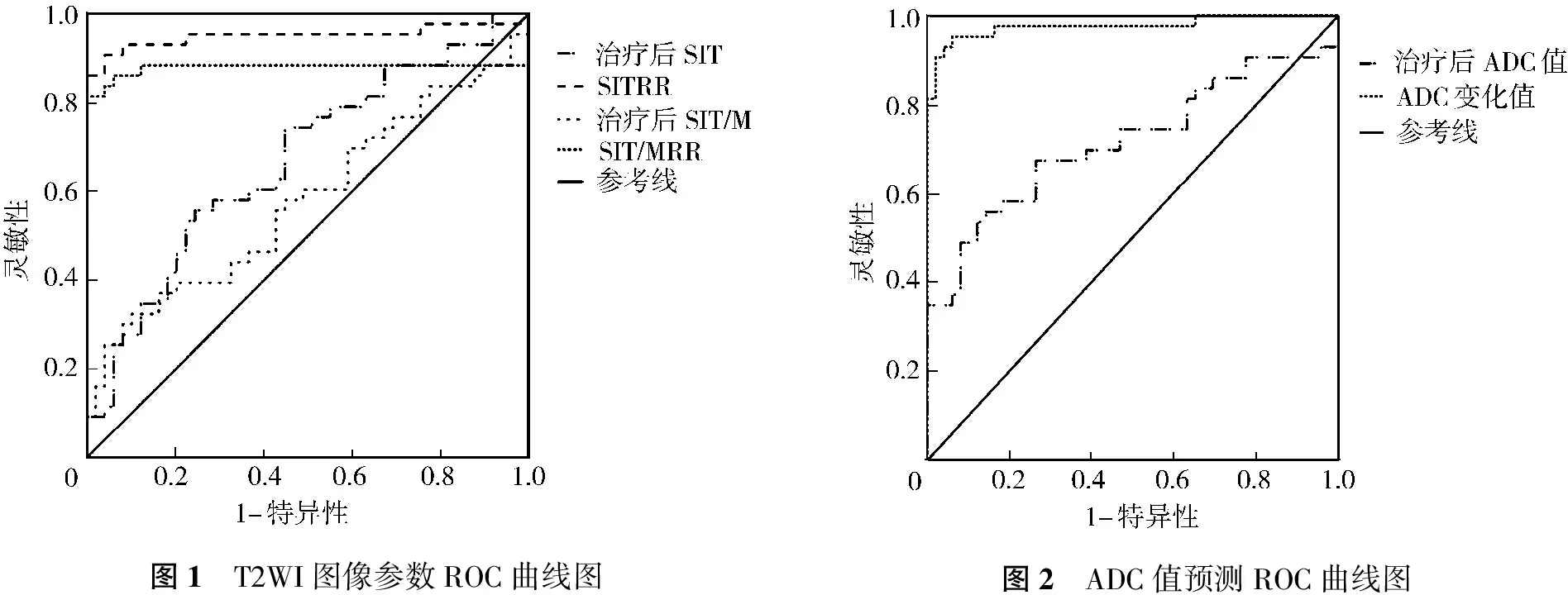
图1 T2WI图像参数ROC曲线图图2 ADC值预测ROC曲线图
3 讨论
直肠癌目前是世界范围内发病率第三位的恶性肿瘤,死亡率位居第五,长期以来中低位局部进展期直肠癌保肛率低、局部控制率差且长期生存率不佳,严重影响患者生存质量[3-4]。目前临床针对不同分期直肠癌患者治疗方案具有差异性,患者对于放疗和化疗存在个体化差异,因此对治疗方法的反应不一,早期明确治疗效果评价预后意义重大,但是传统的检查方法较多,却未能及时反映恶性肿瘤对直肠侵犯程度以及远处转移情况[5-6]。CT作为早期诊断的重要方法之一,敏感程度相对较高,但是在直肠癌患者分期上存在差异性[7-8]。
MRI能够进行多方位成像,特别是对软组织的分辨率更高,由于直肠在盆腔中蠕动相对缓慢,因此核磁对于直肠癌病变成像效果更好[9]。本研究分析了核磁共振T2WI图像参数在新辅助治疗前后患者变化情况,治疗无效患者治疗后SIT明显高于治疗有效患者,而SITRR、治疗后SIT/M、SIT/MRR明显低于治疗有效患者,提示核磁共振T2WI图像参数在不同疗效患者中存在图像参数变化,考虑经过放化疗后治疗有效患者肿瘤缩小,因此磁共振上表现出差异。新辅助治疗前病灶在T2WI图像表现为不均匀高信号,主要是由于肿瘤组织分布不均匀,当治疗后肿瘤病灶的血管结构及血液流速产生的信号呈现一致性增加,同时肿瘤发生缩小和纤维化过程,病变内的信号均匀程度增加,同本研究结果相似[10]。有学者分析放化疗后患者内部的肿瘤组织发生退化转变为纤维化成分,在T2WI图像上较治疗前信号减低,形成低信号的区域[11]。
本研究中还利用核磁共振弥散加权成像对新辅助治疗后患者疗效进行了分析,该方法通过测量施加扩散敏感梯度磁场前后组织发生的信号强度变化,对水分子扩散状态进行分析,能够间接反映组织微观结构特点与变化,弥散加权成像利用信号改变反映肿瘤水分子扩散是否受限,基于扩散加权成像的ADC值可以定量反映肿瘤内水扩散状况[12,13]。本研究中治疗无效患者治疗后ADC值、ADC变化值明显低于治疗有效患者,提示弥散加权成像ADC在直肠癌新辅助治疗有效患者中会升高,同以往研究结果一致[14]。
本研究发现,采用新辅助治疗无效患者年龄明显高于治疗有效患者,而TNM分期高于治疗有效患者,提示了年龄和肿瘤分期对于直肠癌新辅助治疗效果会存在一定的影响,同以往研究结果一致[15]。治疗后SIT、SITRR、SIT/MRR预测治疗有效的ROC曲线下面积分别为0.671、0.950和0.879,ADC值、ADC变化值预测治疗有效的ROC曲线下面积分别为0.717和0.977,提示采用磁共振T2WI图像参数、ADC在预测直肠癌新辅助治疗疗效具有一定的判断价值。
目前临床关于直肠癌影像学报道较多,一般用于评估肿瘤分期、疗效和预后,但是在新辅助治疗的疗效评价方面较少,本研究通过MRI多序列影像组学特征筛选出直肠癌新辅助治疗疗效评价的磁共振序列指标,目的是指导直肠癌个体化治疗,但是,由于本研究入组患者数量较少且全部来自同一家医院,可能导致结果存在一定偏颇,而且未能动态观察治疗过程期间ADC值变化和对患者预后进行分析,还需今后开展更深入、全面的探索。
综上,磁共振T2WI图像参数、ADC在预测直肠癌新辅助治疗疗效中有较高的应用价值。

