植物生长调节剂对海州常山种子萌发的影响
兰琳英,李以同,周 杰,徐艳芳,姚亚合,艾 叶,刘江枫
(1.福建农林大学园林学院,福建 福州 350002; 2.福建农林大学金山学院,福建 福州 350002; 3.福州市于山风景区管理处,福建 福州 350001;)
海州常山(Clerodendrumtrichotomum)为马鞭草科(Verbenaceae)大青属落叶灌木或小乔木,其自然分布区域通常在海拔2400 m以下的溪边、路旁和山坡[1]。海州常山花序大而艳丽,花香四溢,果形奇特,花期6—10月,果实成熟期9—11月,具有极高的观赏价值,是秋季观花、观果的优良树种[1-2]。海州常山还具有耐瘠薄、耐干旱、耐盐碱和抗污染等特点,是干旱瘠薄荒山、矿区废弃地植被恢复与重建及盐碱地绿化的优良树种[2-3]。此外,海州常山具有极高的药用价值,在降压、抗炎、抗氧化、镇痛、镇静等方面功效显著,叶片与嫩枝是民间治疗风湿病痛、半身不遂等疾病的常用药物[4]。
海州常山作为一种药食同源的野生植物,极具开发利用价值。海州常山种子具有休眠现象,自然条件下发芽率相对较低[5],不利于其栽培及开发利用。植物生长调节剂是一种人工合成或筛选的具有类似植物激素化学结构和生理活性的物质,能够打破种子休眠、促进种子萌发[6]。目前,已有较多关于植物生长调节剂对不同种子萌发影响的研究,且都取得了良好效果[7-10],然而关于植物生长调节剂对海州常山种子萌发影响的研究却鲜见报道。本试验旨在通过研究不同的植物生长调节剂及其不同浓度对海州常山种子萌发的影响,探索提高种子发芽率和发芽势的途径,以期为海州常山的播种育苗提供参考。
1 材料与方法
1.1 试验材料
供试材料:海州常山成熟果实采摘自福建省宁德市,选择健康无病虫害的果实。供试试剂:0.3%的高锰酸钾(KMnO4)溶液;植物生长调节剂:赤霉素(GA3)、吲哚乙酸(IAA)、萘乙酸(NAA)、6-苄基腺嘌呤(6-BA)、激动素(KT)。
1.2 试验方法
1.2.1 海州常山果实及种子形态观察与质量测定 鲜果百粒重测定:随机选取100粒海州常山新鲜果实为1组,重复称量10组果实,记录每组的质量,求取平均值,即为果实百粒重;鲜果形态观察与测量:随机选取海州常山果实20粒,测量果实的长、宽、高,根据测量数据,求取平均值,即为果实的大小;种子千粒重测定:随机选取100粒海州常山种子为1组,重复10组,测量种子百粒重后取平均值,推算其千粒重;种子形态观察与测量:随机选取20粒海州常山种子测量长、宽、高,求取平均值,即为种子的大小。
1.2.2 植物生长调节剂处理海州常山种子 将健康饱满的海州常山种子浸于0.3%的高锰酸钾溶液中消毒处理2 h,用蒸馏水洗净后再用吸水纸将种子表面的水分吸干,然后用不同浓度的GA3、IAA、NAA、6-BA、KT等5种植物生长调节剂进行浸种处理24 h。各植物生长调节剂的处理浓度见表1。每个处理随机选30粒种子为1组,放入1个铺有双层滤纸的培养皿内,每组3个重复,均以灭菌蒸馏水作为对照组(CK),把培养皿放入25 ℃培养箱中,定期向培养皿加入蒸馏水以保持湿润,日光照12 h。
1.3 指标测定与数据分析
每日12∶00对培养皿进行观察,记录下每个培养皿的发芽情况,发芽以下胚轴长度达0.2 mm为准。发芽势计算公式:发芽势(%)=(10 d发芽种子数/种子总数)×100%;发芽率计算公式:发芽率(%)=(25 d发芽种子数/种子总数)×100%。
采用Microsoft Excel 2010软件进行试验数据统计和图表的制作,用IBM SPSS Statistics 22.0软件进行单因素方差分析。
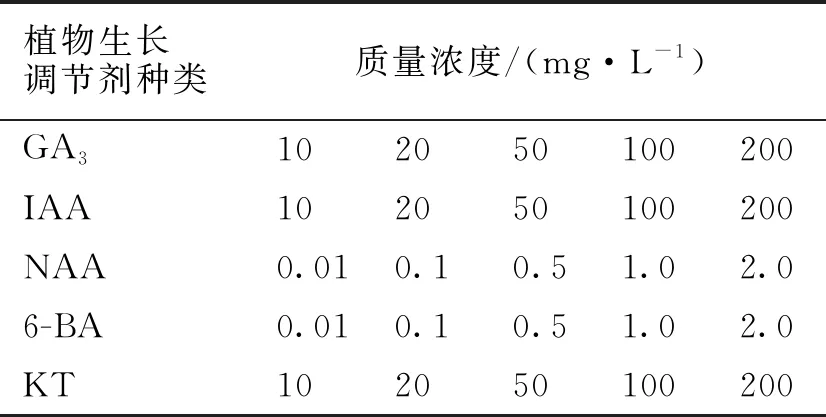
表1 植物生长调节剂处理浓度
2 结果与分析
2.1 海州常山果实与种子的形态学分析结果
海州常山果实成熟时外果皮蓝紫色,核果近球形(图1A),种子为红褐色小颗粒状(图1B)。经过分析测量可知,海州常山果实百粒重为(13.531±1.664) g,纵径为(6.93±0.86) mm,横径为(6.55±0.76) mm,高径为(6.74±0.78) mm;种子千粒重为(0.045+0.005) g,长为(0.35±0.05) mm,宽为(0.68±0.08) mm。
2.2 不同浓度GA3处理对海州常山种子萌发的影响
由表2可知,经不同浓度GA3处理的海州常山种子发芽势除了GA320 mg·L-1处理显著低于CK(灭菌蒸馏水)处理外,其它处理与CK均无显著差异(P>0.05),表明GA3对海州常山种子的发芽势无显著作用。与CK的发芽率相比,GA350~200 mg·L-1处理下种子发芽率均高于CK,而经GA310、20 mg·L-1处理的种子发芽率均低于CK。其中GA3200 mg·L-1处理的效果最好,发芽率高达到91.11%,比CK高出17.78%,与CK差异达到显著水平(P<0.05);发芽率最低的为GA320 mg·L-1处理,只有54.4%,与CK差异显著(P<0.05)。GA320 mg·L-1处理下种子发芽势和发芽率均显著低于其它处理(P<0.05),推测是由于试验误差导致。由此可知,对海州常山种子萌发作用较好的GA3质量浓度范围为50~200 mg·L-1,其中GA3200 mg·L-1对海州常山种子萌发的促进效果最好。
2.3 不同浓度IAA对海州常山种子萌发的影响
由表3可知,不同浓度IAA处理海州常山种子,发芽势与CK相比均无显著差异(P>0.05),表明IAA对海州常山种子的发芽速度无显著影响。在IAA 10~50 mg·L-1范围内,海州常山种子发芽势随着IAA浓度增大呈先降低后升高的趋势,其中IAA 50 mg·L-1处理组的发芽势最高,达到了44.44%,比CK高出6.66%;当IAA大于50 mg·L-1时,发芽势随IAA浓度的升高而降低,其中IAA 200 mg·L-1时发芽势最低,为34.44%,比CK低3.34%。在IAA的各处理组中,发芽率并无明显变化规律,IAA 50 mg·L-1时发芽率最高,为87.78%,比CK高出14.45%,且与CK差异达到显著水平(P<0.05);其它处理组发芽率与CK差异不显著(P>0.05)。由此可见,IAA 10~200 mg·L-1对海州常山种子萌发均有不同程度的促进作用,其中以IAA 50 mg·L-1处理组效果最佳。
2.4 不同浓度NAA对海州常山种子萌发的影响
由表4可知,经不同浓度NAA处理后,海州常山种子的发芽势和发芽率均随着NAA浓度增加呈先升高后降低的趋势。其中NAA 0.5 mg·L-1处理组的发芽势、发芽率均最高,分别比CK高出11.11%、5.55%,但与CK无显著差异(P>0.05);其余处理组的发芽势、发芽率与CK基本相同甚至比CK更低,NAA 0.01 mg·L-1处理组的发芽势最低,为2.22%,比CK低35.56%,与CK差异达到显著水平(P<0.05);NAA 2.0 mg·L-1处理组的发芽势、发芽率显著低于CK(P<0.05)。这可能是由于过低和过高浓度的NAA抑制了海州常山种子萌发。综上可知,NAA 0.5 mg·L-1对海州常山种子萌发具有促进作用,但其促进效果不显著,而其它处理浓度则表现不促进作用甚至起抑制作用。
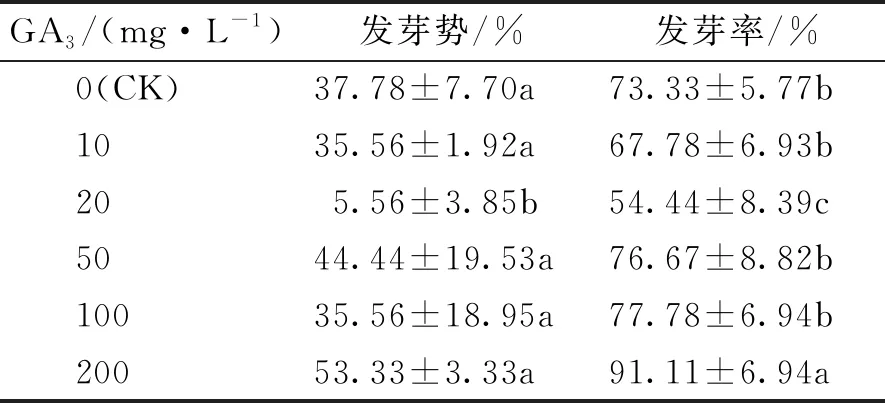
表2 GA3处理不同浓度对海州常山种子萌发的影响
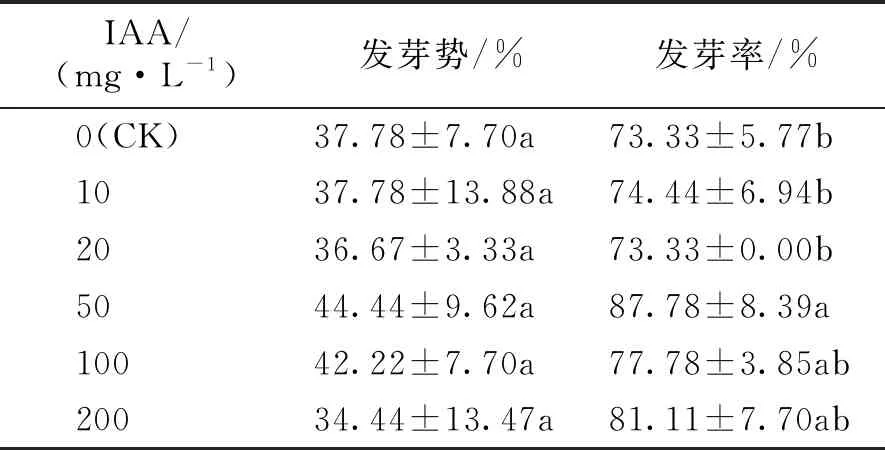
表3 不同浓度IAA对海州常山种子萌发的影响

表4 不同浓度NAA对海州常山种子萌发的影响
2.5 不同浓度6-BA对海州常山种子萌发的影响
由表5可知,与CK相比,除了6-BA 2.0 mg·L-1处理的海州常山种子发芽势与CK无显著差异(P>0.05),其它处理均显著低于CK(P<0.05),尤其是6-BA 0.01、1.0 mg·L-1处理的种子发芽势低至1.11%,表明该浓度下6-BA对海州常山种子的发芽势有着较明显的抑制作用。6-BA 0.5、2.0 mg·L-1对海州常山种子的发芽率有促进作用。当6-BA 0.5 mg·L-1时种子发芽率最高,比CK高出12.23%,但与CK并无显著差异(P>0.05);当6-BA 0.1 mg·L-1时种子发芽率最低,为34.44%,与CK差异显著(P<0.05)。由此可知,6-BA 0.5 mg·L-1对海州常山种子萌发的促进作用最好。
2.6 不同浓度KT对海州常山种子萌发的影响
由表6可知,随着KT浓度的增加,海州常山种子的发芽势与发芽率也逐渐增加,不同浓度的KT对海州常山种子萌发的总体作用表现为先抑制后促进。
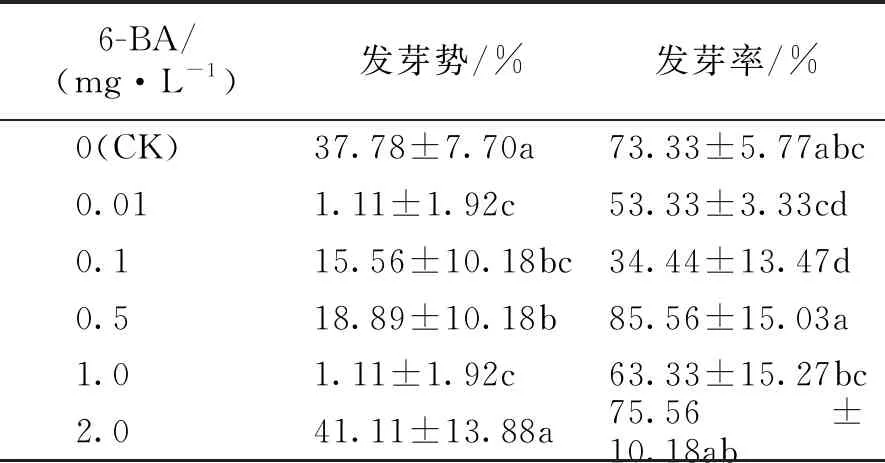
表5 不同浓度6-BA对海州常山种子萌发的影响
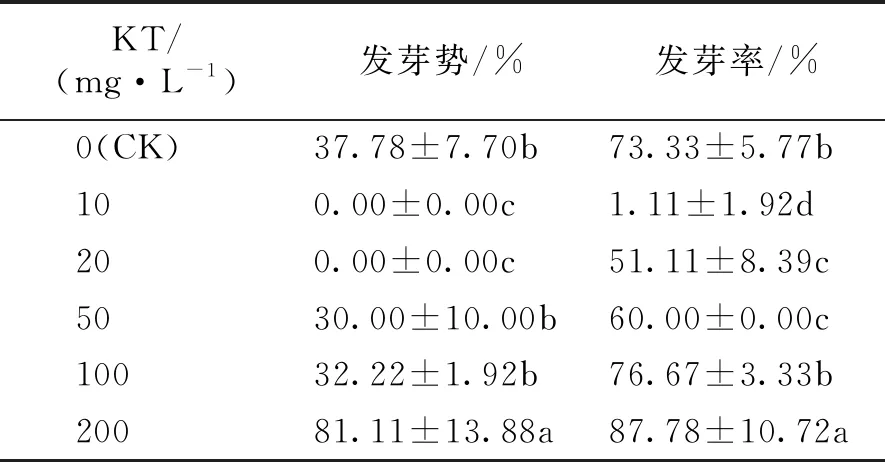
表6 不同浓度KT对海州常山种子萌发的影响
相比CK,当KT为10 mg·L-1时种子几乎不发芽;KT 20、50 mg·L-1处理下显著抑制海州常山种子萌发;当KT为100 mg·L-1时开始表现为促进作用;而当KT为200 mg·L-1时,对种子萌发的促进效果非常明显,发芽势与发芽率都达到最高,显著高于CK(P<0.05),分别比CK高出43.33%、14.45%。表明低浓度(10~50 mg·L-1)KT对海州常山种子萌发具有抑制作用,较高浓度(100、200 mg·L-1)KT对海州常山种子萌发具有促进作用。综上可知,在本试验设定的浓度范围内,KT促进海州常山种子萌发的最佳浓度为200 mg·L-1。
3 结论与讨论
采用植物生长调节剂浸种是打破种子休眠、促进种子萌发、培养壮苗的一种简捷的有效方法[11]。使用GA3处理种子能使细胞分裂分化而促进种子胚的发育和促进种子解除休眠,提早发芽,从而提高发芽率[12]。已有前人对大白杜鹃[13]、光皮桦[14]、杜鹃红山茶[15]等种子使用GA3进行浸种处理,研究结果表明种子的发芽率随着GA3浓度增大呈逐渐上升的趋势。本研究得出类似结论,在10~200 mg·L-1范围内,GA3浓度越大,海州常山种子的发芽率越高。郑艳冰等[16]研究表明,不同浓度的IAA可以显著促进玉米种子萌发,且随着IAA浓度增大,玉米种子的发芽率表现为先增加后下降,这与本试验得出的结论略有不同。本试验中,不同浓度IAA都可以促进海州常山种子萌发,提高发芽率,但各浓度影响没有明显一致的规律,这可能与试验设置的IAA浓度有关。NAA可以促进细胞分裂和组织分化,诱导形成不定根;6-BA具有促进细胞分裂、增大增长和促进种子发芽的作用[12]。本试验结果表明,当浓度适宜时,NAA、6-BA对海州常山种子的萌发有一定的促进作用,但促进作用并不显著,这与靳祖石等[17]研究发现NAA、6-BA对薄叶鸡蛋参种子萌发具有显著促进作用的结论有所不同,推测是因为不同植物种子对不同植物生长调节剂的敏感程度不同。KT是一种能够促进细胞分裂、分化、生长的细胞分裂素,具有促进种子萌发的作用[18]。本实验研究发现,随着KT浓度增大,海州常山种子的发芽势与发芽率逐渐上升,低浓度(10~50 mg·L-1)会抑制海州常山种子萌发,较高浓度(100、200 mg·L-1)可以促进海州常山种子萌发。袁凤英等[18]指出高浓度的KT有抑制种子萌发的作用,而适宜浓度的KT浸泡种子,可提高发芽率;田再民等[19]研究发现适宜的KT浓度可以打破玉米种子的休眠,促进芽的分化,而高浓度的KT则会抑制芽的分化,其活力指数也相应降低,与本研究结果不一致。这可能是不同植物种子对植物生长调节剂的响应程度不同,另外,不同人对高低浓度的定义不同。本研究中,GA3、IAA、NAA、6-BA、KT 5种植物生长调节剂对海州常山种子均有不同程度的促进作用,其中以GA3200 mg·L-1、IAA 50 mg·L-1、NAA 0.5 mg·L-1、6-BA 0.5 mg·L-1、KT 200 mg·L-1处理对海州常山种子萌发有较好的促进作用;其中各处理组间海州常山种子发芽率均无显著差异(P>0.05);发芽势中,KT 200 mg·L-1处理组显著高于其它处理组(P<0.05),6-BA 0.5 mg·L-1处理组显著低于其它处理组(P<0.05)。因此,以KT 200 mg·L-1进行浸种处理时,海州常山种子的萌发效果最好。故在海州常山播种育苗时可选用KT 200 mg·L-1进行浸种处理,以提高海州常山种子的发芽势和发芽率。
影响种子萌发的因素很多,既有种子本身条件,也有外界环境条件。本试验利用植物生长调节剂对海州常山种子进行浸种处理,探讨不同植物生长调节剂及其不同浓度对海州常山种子萌发的影响,发现不同植物生长调节剂对海州常山种子的萌发具有不同的影响,不同浓度的同种植物生长调节剂产生的影响也不同,关于外界条件类似于温度、光照等对海州常山种子萌发的研究还有待进一步深入。

