PVDF中空纳米纤维的制备及其固定化酶的性能研究
刘瑞红,周 全,2,杨 帆,2,吴丽杰,2,任瑞鹏,2,吕永康,2
(1.太原理工大学 省部共建煤基能源清洁高效利用国家重点实验室,太原 030024;2.山西省工业与城市污水处理工程技术研究中心,太原 030024)
生物酶是一种绿色高效的催化剂,通常具有专一性强、反应条件温和、催化效率高等优点[1],其催化效率是无机催化剂的107~1 013倍[2]。然而在实际应用中,天然游离酶容易失活,导致其稳定性差、重复利用性低,限制了生物酶的广泛应用。研究表明,固定化技术是解决天然游离酶技术缺陷的有效手段[3-5]。
固定化酶的催化活性在很大程度上取决于固定化的载体材料。近年来纳米纤维如纳米片、层层自组装膜以及三维纳米花、纳米胶束和纳米管等[6-9]已经被用于固定化酶。其中纳米纤维膜因具有比表面积大、负载能力强等优点受到了人们的广泛关注,但是在纳米纤维外表面固定化的酶稳定性较差。TAHERAN et al[10]在聚丙烯腈纳米纤维膜表面固定漆酶,在催化底物2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)反应10次循环后,只保持了其初始活性的17%.ZEUNER et al[11]将乙醇脱氢酶固定在多孔的金属陶瓷基纳米纤维膜的表面,七个循环后该酶的残留活性只有6%.
纳米纤维的制备方法多种多样,其中静电纺丝法制备的纳米纤维膜具有孔隙率高、比表面积大、性能可调控和容易与反应体系分离等优点[12]。常规静电纺丝方法有乳液静电纺、同轴静电纺和多头喷丝等[13-14]。通过同轴静电纺丝法制备的中空纳米纤维[15],可以将酶包埋在纳米纤维内空腔中,防止生物酶的流失,增强固定化酶的稳定性。目前已经报道的静电纺丝纳米纤维材料包括聚砜、聚偏氟乙烯(PVDF)、聚丙烯腈、聚四氟乙烯等[16-17],其中PVDF由于其出色的机械强度、耐化学腐蚀性和良好的热稳定性成为静电纺丝材料的较好选择[18-20]。
为了提高固定化酶的催化活性和稳定性,本研究采用同轴静电纺丝法,制备了中空型PVDF纳米纤维膜,利用内芯纺丝液中添加的多巴胺(dopamine,DA)原位聚合生成聚多巴胺(polydopamine,PDA),将漆酶(Laccase)和辣根过氧化物酶(horseradish peroxidase,HRP)固定在中空纳米纤维的内空腔中,探讨了外壳纺丝液中PVDF良溶液和不良溶液的溶剂比、纺丝温度、干燥方式等静电纺丝参数对PVDF中空纳米纤维膜形貌及结构的影响,筛选了最优的制备条件,并对在最优条件下制备的PVDF中空纳米纤维膜进行了扫描电子显微镜SEM、比表面积及孔径、亲疏水性等表征,探究了孔分布、亲疏水性对固定化Laccase和HRP的储存稳定性、重复使用性的影响。
1 实验部分
1.1 实验材料
聚偏氟乙烯(PVDF,相对分子质量100万);N,N-二甲基甲酰胺(DMF,C3H7NO,AR,99.5%);丙酮(Acetone);多巴胺盐酸盐;甘油(Glycerol,C3H8O3,≥99%);异硫氰酸荧光素(FITC);异硫氰酸罗丹明B荧光素(RBITC);漆酶(Laccase,来源于云芝,≥0.5 U/mg);辣根过氧化物酶(HRP,来源于辣根);2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS);Tris-HCl缓冲液;牛血清蛋白(BSA);Bradford蛋白试剂盒;高纯水;磷酸盐缓冲液(PBS).
1.2 实验仪器
同轴静电纺丝装置(实验室自装);扫描电子显微镜(JSM-IT200,日本,测试电压20 kV);气体吸附分析仪(Autosorb-i3,美国);接触角测试仪(JC200C,上海梭伦信息科技有限公司);激光共聚焦测试仪(OLYMPUS,型号:FV1200);UV-分光光度计(752UV-vis,上海频谱仪器有限公司)。
1.3 中空PVDF纳米纤维膜的制备
采用同轴静电纺丝制备PVDF中空纳米纤维,实验装置如图1所示。配置N,N二甲基甲酰胺(DMF)与丙酮的体积比分别为4∶6、5∶5、6∶4、7∶3的质量分数10%的PVDF聚合物溶液作为外壳纺丝液,甘油作为内芯纺丝液并添加一定量的生物酶和多巴胺(DA).同轴静电纺丝参数为:壳层PVDF溶液进料速率2 mL/h、内芯酶溶液进料速率0.6 mL/h、施加(10±1) kV电压、接收器距喷嘴端15 cm、湿度(35±1)%、静电纺丝温度分别为(20±1) ℃、(25±1) ℃、(30±1) ℃,收集PVDF纳米纤维膜4 h,然后将收集到的纳米纤维膜浸入500 mL超纯水中,溶去内芯的甘油得到PVDF中空型纳米纤维,取出冲洗,在三种不同条件下干燥,-20 ℃保存,观察纳米纤维形貌。

图1 静电纺丝装置图Fig.1 Coaxial electrospinning device
1.4 生物酶在PVDF纳米纤维中的固定化
将内芯添加DA、Laccase和HRP的PVDF中空纳米纤维膜浸入到0.1 mol/L、pH=7.4的Tris-HCl缓冲液中,DA原位聚合生成PDA固定酶,用Bradford法测定流失到缓冲液中的酶的含量,分析酶在PVDF中空纳米纤维中的固定效果。固定酶后,将纳米纤维膜从缓冲液中取出,室温自然风干,-20 ℃保存。为了证实酶被固定在PVDF中空纳米纤维中,用异硫氰酸荧光素(FITC)和异硫氰酸罗丹明B荧光素(RBITC)分别标记的牛血清蛋白(bovine serum albumin,BSA)代替两种酶固定,在激光共聚焦显微镜下观测。
1.5 固定化酶PVDF纳米纤维亲疏水性测试
内芯溶液分别加入0 mg/mL、0.2 mg/mL、2 mg/mL DA,制备固定化酶的PVDF中空纳米纤维。将制备的纳米纤维膜剪成2 cm×2 cm大小的正方形,在接触角测试仪下测量接触角,分析材料亲疏水性。
1.6 固定化酶的活性与酶稳定性测试
以2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)为底物检测固定化Laccase和HRP的活性。将2 cm×2 cm的PVDF中空纳米纤维膜(膜的质量为25 mg,负载酶2 mg)放入反应体系,用UV-分光光度计在420 nm检测1 min内待测量溶液的吸光度变化,计算酶活性,并计算在不同时间间隔时吸光度变化值与时间的比值,表示其酶促反应速率。固定化酶与游离酶的对比实验中,加入游离酶的量和固定化酶的含量相同。测定了两种游离酶和固定化酶在7天内的储存稳定性,以及重复反应10次的重复使用性。
2 结果与讨论
2.1 同轴静电纺丝参数对PVDF纳米纤维膜形貌与结构的影响
2.1.1溶剂比的影响
纺丝液的黏度会影响PVDF中空纳米纤维的形貌。良溶剂DMF和不良溶剂丙酮的比例不同,PVDF聚合物纺丝液的黏度也不同,因此制备了DMF与丙酮体积比分别为4∶6、5∶5、6∶4、7∶3的PVDF纳米纤维膜,形貌如图3所示。当DMF与丙酮体积比为4∶6时(图2(a)),纤维呈现带状,有部分粘连和破损;当DMF与丙酮体积比为5∶5时(图2(b)),纤维之间相互粘连;当溶剂比为6∶4时(图2(c)),纤维直径分布不均匀;当溶剂比为7∶3时(图2(d)),单根纤维几乎没有粘连,且直径分布均匀。这是由于当DMF与丙酮体积比为7∶3时,外壳纺丝液的黏度和同轴静电纺丝的参数相匹配,电场力能够克服表面张力,形成Taylor锥实现稳定喷射流,随之高分子射流拉伸形成丝状聚合物纤维,溶剂在拉丝伸长的过程中不断挥发,最后沉积到滚筒接收器上形成具有规整形貌的PVDF纳米纤维膜。

DMF与丙酮的体积比分别为(a)4∶6、(b)5∶5、(c)6∶4、(d)7∶3图2 DMF与丙酮不同体积比时PVDF纳米纤维膜载体的SEM图Fig.2 SEM images of PVDF nanofiber membrane carrier with different volume ratio of DMF to acetone
2.1.2温度的影响
温度影响溶剂丙酮的挥发从而影响纺丝液的黏度,因此探究了温度对PVDF中空纳米纤维形貌的影响。在温度分别为(20±1) ℃、(25±1) ℃和(30±1) ℃时制备了PVDF中空纳米纤维膜,形貌如图3所示,当温度为(20±1) ℃、(25±1) ℃时,单根纤维几乎粘连成块(图3(a)和图3(b)).粘连的主要原因是温度过低,纺丝过程中溶剂不能及时挥发,纤维沉积导致单根纤维中的溶剂互溶。这种粘连成块的纤维结构会影响底物与酶的接触,降低固定化酶的活性。当温度为(30±1) ℃时溶剂在纺丝过程中及时挥发,呈现出均匀规整的PVDF纳米纤维形貌(图3(c)).

DMF与丙酮的体积比为7∶3,(a) (20±1) ℃,(b) (25±1) ℃,(c) (30±1) ℃图3 不同温度下PVDF纳米纤维膜载体的SEM图Fig.3 SEM images of PVDF nanofiber membrane carrier at different electrospinning temperatures
2.1.3干燥方式的影响
考虑到酶对温度的耐受性,我们对载体的干燥方式做了探究。用上述优化的电纺参数制备PVDF纳米纤维膜,浸入水中溶去内芯的甘油,然后采用40 ℃真空干燥、室温下自然风干、冷冻干燥3种不同方式干燥,PVDF纳米纤维膜的截面结构如图4所示。采用真空干燥(图4(a)),PVDF纳米纤维膜中空结构变瘪,破裂;采用冷冻干燥(图4(c)),PVDF纳米纤维膜截面拉伸撕裂,并且分层;将PVDF纤维膜放在通风柜中,室温下自然风干,干燥之后中空结构完整(图4(b)).因此,自然风干能维持PVDF纳米纤维的中空结构。

图4 不同干燥方式下PVDF纳米纤维膜载体横截面的SEM图Fig.4 SEM images of the cross section of PVDF nanofiber membrane carrier with different drying conditions
2.1.4PVDF纳米纤维膜的孔结构
经静电纺丝参数的优化,在溶剂比7∶3、温度为(30±1) ℃时电纺,自然干燥,可制备出直径均匀的PVDF中空纳米纤维膜。纳米纤维的孔道结构是酶与底物的接触通道[21],因此进一步对PVDF中空纳米纤维的孔结构进行探究。PVDF中空纳米纤维膜载体表面形貌如图5所示。单根纤维表面有大量孔隙。孔的形成是由于外加电压使得聚合物液滴带电,溶液中电荷转移,在喷丝时造成了PVDF聚合物与溶液的相分离,且DMF与丙酮混合溶剂的沸点降低,溶剂挥发在纤维表面形成了大小随机的孔隙。为了进一步研究PVDF中空纳米纤维表面的孔结构,对PVDF中空纳米纤维膜做了氮气吸脱附实验,结果如图6所示,PVDF中空纳米纤维膜的比表面积为20.557 m2/g,孔径分布在3~5 nm、20~40 nm左右,大于底物的尺寸,为底物与酶的接触提供了物理通道。

图5 PVDF中空纳米纤维膜载体表面形貌Fig.5 SEM image of the surface morphology of PVDF nanofiber membrane carrier
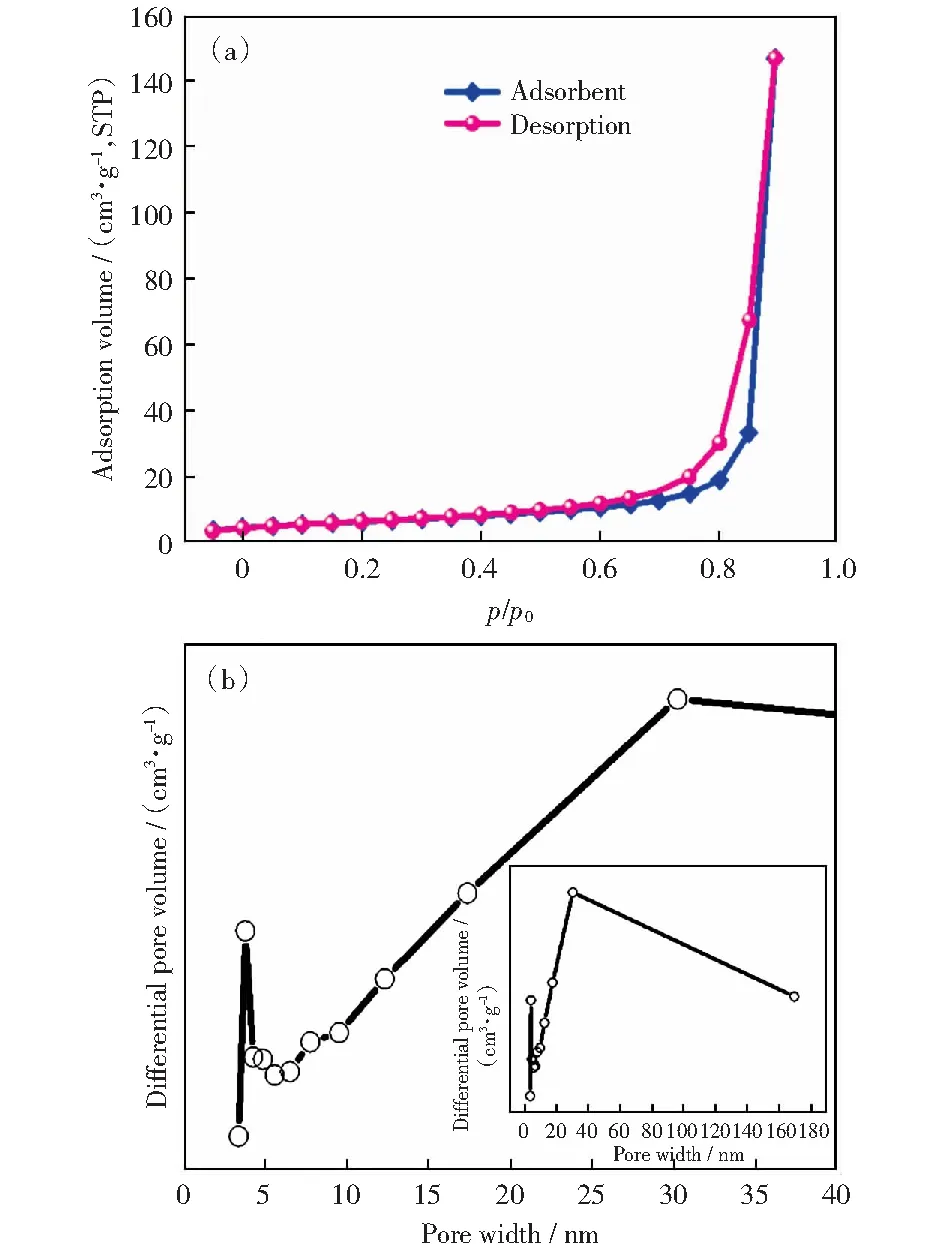
图6 PVDF纳米纤维膜的氮气吸脱附曲线(a)和孔径分布图(b)Fig.6 (a)Nitrogen adsorption-desorption curves and (b) pore size distribution of PVDF nanofiber membrane
2.2 生物酶在PVDF中空纳米纤维内空腔中的固定化
Laccase与HRP具有催化活性,可以与荧光分子发生反应而无法进行标记。Laccase与HRP的本质是蛋白质[22-23],因此,为了确认Laccase和HRP这两种生物酶可以固定在PVDF中空纳米纤维中,在最佳同轴静电纺丝参数条件下,将具有绿色荧光FITC标记的BSA和红色荧光RBITC标记的BSA代替Laccase和HRP加入内芯纺丝液,制备荧光标记的PVDF中空纳米纤维。将带有FITC和RBITC标记BSA的PVDF中空纳米纤维膜浸在0.1 mol/L、pH=7.4的Tris-HCl缓冲液中4 h固定荧光标记蛋白,在激光共聚焦显微镜(CLSM)下观察固定化BSA后的PVDF中空纳米纤维膜,结果如图7所示。固定有两种荧光标记蛋白的纳米纤维在488 nm处发出绿色荧光(图7(a)),在559 nm处发出红色荧光(图7(b)),绿色荧光和红色荧光照片叠加,显示出黄色(图7(c)),与明场照片中纳米纤维一一对应(图7(d)),表明2种荧光标记的BSA是在纳米纤维内部均匀分布的。内芯添加的DA原位聚合生成PDA[24]可以将生物酶均匀地固定在PVDF中空纳米纤维的内空腔中。采用Bradford法测定酶流失的量,计算得到81.3%的Laccase和HRP被固定在PVDF中空纳米纤维中。

图7 固定化FITC-BSA和RBITC-BSA的PVDF纳米纤维膜的激光共聚焦图Fig.7 CLSM images of PVDF nanofiber membrane with FITC-BSA and RBITC-BSA
2.3 固定化酶的PVDF中空纳米纤维膜的亲疏水性
在酶固定化的过程中,DA聚合生成的PDA与PVDF中空纳米纤维复合时,会改变PVDF中空纳米纤维膜载体本身的亲疏水性[25]。因此我们制备了内芯纺丝液中DA质量浓度分别为0 mg/mL、0.2 mg/mL、2 mg/mL的PVDF纤维膜,接触角测试如图8所示。当内芯纺丝液中不添加DA时(图8(a)),纤维膜载体的接触角为104.4°,其疏水性强归因于PVDF材料表面的F元素[26]。加入DA后,接触角逐渐降低显示出亲水性,这是由于生成的PDA中含有—OH和—NH3亲水性基团导致的。PDA改善了PVDF载体的强疏水性,有利于载体固定化生物酶后参与水环境中的催化反应。
2.4 PVDF中空纳米纤维膜固定化酶的催化活性与存储稳定性
通过检测Laccase/HRP-PDA@PVDF的催化活性,发现固定化之后2种酶Laccase/HRP的酶催化活性保持了游离酶的80%,比文献中报道的固定化酶的活性(50%)高[27]。这归因于PVDF中空纳米纤维载体表面的孔结构为Laccase/HRP与底物的接触提供了有效的物理通道,此外PDA在中空纳米纤维内部形成了一层亲水层,对酶的亲和力使得固定化酶稳定性提高[28]。
Laccase/HRP-PDA@PVDF与相同含量的游离酶在4 ℃磷酸盐缓冲液(pH值为7.4)中的存储稳定性如图9所示。图9(a)是固定化酶和游离酶与ABTS反应产生的紫外吸收强度随储存时间的变化曲线,图9(b)是固定化酶和游离酶的相对活性随储存时间的变化。图9(a)表明游离酶的最初活性高于固定化酶,但是游离酶活性急剧下降,固定化酶的活性衰减缓慢,在第一天出现交叉点,从第二天开始固定化酶的活性高于游离酶。储存7 d后游离的Laccase/HRP的酶活性降低了60%,而Laccase/HRP-PDA@PVDF的活性只降低了18%,固定化酶仍保持初始活性的82%.这归因于Laccase/HRP固定在PVDF中空纳米纤维的内空腔中,外层的聚合物对纤维内部的生物酶起保护作用,避免外部环境对酶活性的影响;而且内空腔中用来固定酶的PDA让纳米纤维膜载体更加亲水,对酶有亲和作用,所以固定化酶的存储稳定性高于游离酶。

内芯纺丝液中DA的质量浓度为:(a) 0 mg/mL、(b) 0.2 mg/mL、(c) 2 mg/mL图8 PVDF纳米纤维膜载体的接触角示意图Fig.8 Contact angle images of PVDF nanofiber membrane

图9 游离酶和固定化酶在4 ℃磷酸盐缓冲液(pH=7.4)中的存储稳定性Fig.9 Storage stability of free and immobilized enzymes in 4 ℃ phosphate buffer (pH=7.4)
2.5 固定化酶的重复使用性
重复使用性是酶固定化的重要性能之一,因此我们检测了固定化Laccase/HRP的PVDF中空纳米纤维膜重复反应10次的催化活性,如图10所示。从图中可以看出,进行10个反应操作后,固定化酶仍保持初始活性的40%以上,比文献[10-11]报道的重复使用性好。这是由于除了外层PVDF聚合物的保护作用,内部原位生成的PDA将Laccase/HRP固定在纳米纤维的内空腔中,降低了酶的流失。
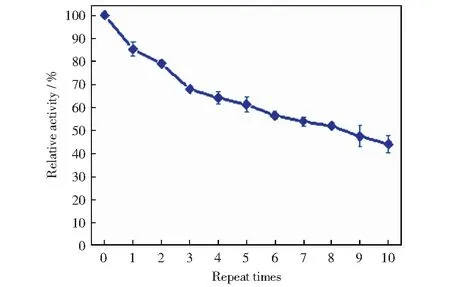
图10 Laccase/HRP-PDA@PVDF催化底物ABTS的重复使用性Fig.10 Laccase/HRP-PDA@PVDF reusability test by catalyzing substrate ABTS
2.6 固定化酶的反应速率
酶被固定在PVDF中空纳米纤维的内部活性较高、稳定性良好,但聚合物壳层会影响底物与内空腔中固定化酶的接触,进而对固定化酶的反应速率产生影响。为此,以ABTS作反应底物,计算了游离Laccase/HRP和固定化酶Laccase/HRP-PDA@PVDF分别在1~5 min、5~10 min、10~20 min区间内紫外吸光度与时间的比值ΔA/ΔT,以此表示反应速率,结果如图11所示。实验显示在反应最开始固定化酶的速率低于游离酶,这是由于聚合物管壁对底物扩散进入中空纳米纤维的阻碍造成的;而在10 min后固定化酶的速率比游离酶高,可能是由于Laccase/HRP两种酶在中空纳米纤维内部形成了底物通道提高了催化活性;在20 min时,固定化酶的反应速率与游离酶相当,说明这时反应都趋近了平衡。

图11 游离Laccase/HRP和Laccase/HRP-PDA@PVDF分别在1~5 min、5~10 min、10~20 min区间内的反应速率Fig.11 Reaction rate of free Laccase/HRP and Laccase/HRP-PDA@PVDF in the interval of 1~5 min, 5~10 min, and 10~20 min
3 结论
1) 探究了同轴静电纺丝参数如溶剂比、温度、干燥方式等对PVDF中空纳米纤维膜载体形貌的影响,最佳纺丝条件为DMF和丙酮的溶剂比7∶3、温度为(30±1) ℃、自然干燥。
2) 在最佳纺丝条件下制备PVDF中空纳米纤维,在其内空腔中原位生成PDA并固定化2种酶Laccase和HPR,测试了固定化酶的亲疏水性、催化活性、存储稳定性和重复使用性。与游离酶相比,固定化Laccase/HRP的稳定性大大提高,在4 ℃磷酸盐缓冲液中存储7 d仍保持其初始活性的82%,固定化酶在进行10个反应操作后仍保持其初始活性的40%以上,研究结果表明同轴静电纺丝法制备的表面多孔的PVDF中空纳米纤维膜是酶固定化的优良载体。

