ZSM-5催化剂与低温等离子体协同转化H2S-CO2制合成气
王乾浩,赵璐,孙付琳,3,房克功
(1 中国科学院山西煤炭化学研究所,煤转化国家重点实验室,山西 太原 030001; 2 中国科学院大学,北京 100049;3 东北石油大学化学化工学院,黑龙江 大庆 163318)
引 言
硫化氢(H2S)是一种具有恶臭、剧毒的酸性气体,其易燃易爆且极易腐蚀金属而造成管道堵塞,因而排放受到严格限制。此外,在甲醇合成、燃料电池、合成氨以及加氢精制等化工工业应用中,即使微量H2S也会导致金属催化剂中毒失活[1]。为此,必须对H2S 进行无害化处理。二氧化碳(CO2)是主要的温室气体,已对环境造成严重危害。将CO2转化为高附加值化学品和燃料一直是全球关注的重要课题[2-3]。但CO2具有高热力学稳定性,其活化需要很高能量。研究表明,在5000℃以上才可完全分解为碳和氧[4-5]。此外,CO2与甲烷重整反应、部分CO2甲烷化等CO2转化反应还会引起催化剂表面积炭失活[6];CO2加氢合成甲醇等反应因是放热反应,而高温对正向反应不利[7]。因此,探索CO2低温转化过程亦是推动CO2利用进一步发展的关键。在煤炭、石油、天然气化工中,上述H2S和CO2两种酸性气体往往共存并腐蚀管线,被公认是有害废气。如在煤化工变换净化单元会产生大量H2S-CO2混合酸气,但目前采用的传统克劳斯工艺能耗高,对H2S和CO2相对组成具有明确限定,无法实现氢源回收和CO2减排[8]。因此,探索合理转化利用H2S-CO2混合酸气的新途径对节约能源、保护环境和实现我国化工工业绿色可持续发展有着重要意义。
将H2S 和CO2一步转化制合成气(CO 和H2的混合气),既实现了二者的无害化处理,又生产出合成气,是一条理想的废气资源化利用新路线。但由于H2S 和CO2分子结构稳定,活化需要很高能量,受热力学平衡限制,在常规条件下二者反应转化率极低。而在低温等离子体中,大量高能电子可与气体分子发生非弹性碰撞,并将其能量传递给气体分子,从而产生活泼的激发态分子、原子和离子[9]。高能电子能量在1~10 eV 之间[10],而H2S 和CO2的离解能分别为4.0 eV[11]和5.6 eV[12],故二者可被激发为高活性物种来参与反应。到目前为止,科研工作者已经对H2S或CO2的单独转化进行了大量研究,其中也发现在低温等离子体下可以显著提高H2S[13]或CO2[14]转化率,但同时以H2S和CO2为原料一步直接转化制取合成气的研究未受关注。本课题组构筑出用于H2S-CO2混合酸气高选择性制合成气的低温等离子体催化协同反应体系,开辟了一条制备合成气及资源化利用CO2、H2S 的新路径[15-16]。工作中深入开展了以低温等离子体催化协同体系完成H2S-CO2共转化制合成气的工作,实现了工业上H2S-CO2酸性废气制合成气及长周期连续稳定运行。然而,由于低温等离子体的复杂性,针对低温等离子体氛围下的协同催化机制辨析一直是研究的重难点,尤其是低温等离子体放电对气态分子在催化剂表面的吸附活化影响鲜有报道。
在前期实验基础上,研究了一系列具有不同Si/Al 摩尔比的ZSM-5 催化剂与低温等离子体结合转化H2S-CO2一步制合成气,考察了ZSM-5 催化剂中Si/Al比以及低温等离子体放电条件等对H2S-CO2转化反应的影响。本文将低温等离子体氛围下的不同ZSM-5 催化剂上CO2、H2S、H2、CO 等分子的化学吸脱附行为与常规条件下的化学吸脱附进行了详实对比,旨在揭示低温等离子体下ZSM-5 催化剂表面的吸附性质与H2S-CO2转化反应的内在关联。
1 实验材料和方法
1.1 ZSM-5催化剂
本研究所使用的化学试剂是规格为分析纯的正硅酸四乙酯、硫酸铝、四丙基氢氧化铵、氢氧化钠等,均购自国药集团化学试剂有限公司。以不同Si/Al摩尔比的ZSM-5 分子筛作为催化剂(n(Si/Al)=25、38、50、80、200),合成方法如文献所述[17-18]。在使用前进行干燥处理,各催化剂置于120℃烘箱中保持8 h,随后将其压片筛分成0.25~0.42 mm样品备用。
1.2 催化剂的表征
X 射线衍射测试在Rigaku D/Max-RA 衍射仪上进行,以CuKα为辐射源,其中管电压40 kV。采用JW-BK200C 型物理吸附仪进行ZSM-5 催化剂的比表面积测定,以BET 法计算各样品比表面积。通过DZ5001 型介电常数测量仪完成对ZSM-5 催化剂的介电常数测量。PCA-1200型化学吸附仪与GAM200质谱仪联用测定不同样品CO2、H2S、H2、CO程序升温脱附曲线,将样品用Ar 于400℃吹扫1 h,降温至30℃后分别进行CO2、H2S、H2、CO 吸附实验并至饱和,然后以10℃/min 的升温速率进行程序升温脱附实验,记录CO2、H2S、H2、CO-TPD 曲线。不同低温等离子体气氛下各吸附实验操作如下:通过质量流量计控制气体流量50 ml/min,在保持放电频率10 kHz下调节输入电压以达到稳定功率(30 W)进行气体放电吸附实验,后续完成程序升温脱附测试。
1.3 H2S-CO2转化反应评价
介质阻挡放电具有放电稳定、均匀的优点,并且可在常压下操作,能在电极间实现固体催化剂的填充,因此本实验中选用介质阻挡放电形式产生低温等离子体。本课题组已在前期工作中详细阐述了评价反应过程[15-16],具体如下。本研究所用低温等离子体系统示意图如图1 所示,低温等离子体放电反应器以石英玻璃作为阻挡介质,内外径分别为8和10 mm,放电区域体积15 ml,在其外壁紧密环绕接地极(铝片)。因H2S 具有腐蚀性,高压电极采用不锈钢线(304 不锈钢,直径2.5 mm)并与低温等离子体高压发生器(CTP2000K,南京苏曼电子有限公司)相连且沿反应器轴线安装。在反应过程中产生的含硫物为硫黄,为防止生成的硫黄堵塞床层,使反应不能稳定持续进行,研究中将反应器置于120℃恒温油浴中,以保持生成的硫黄为液态并脱离床层。由于产生低温等离子体时高压电场的存在,用热电偶无法测定床层的温度,为此采用红外热像仪(ThermoVision A40 M)测量了床层截面方向的温度分布(图2)。可见,床层温度为120~130℃且分布均匀,实现了H2S-CO2转化反应长时间稳定运转,这也说明H2S-CO2转化反应不是源于高温而是来自低温等离子体和催化剂的协同促进作用。每次实验通过质量流量计控制反应气流量,将不同ZSM-5 催化剂填装于放电区域,在反应前注入氮气10 min 用于除去反应系统中空气。接通连接高压电极的低温等离子体高压发生器,在放电频率10 kHz 及输出电压约10 kV 条件下进行低温等离子体催化协同转化H2S-CO2实验。同时,将电容值为0.47 μF 的电容串联在等离子体反应器接地线用于测量放电过程中的电量大小,具体通过与示波器探头连接以Lissajous 图形模式显示放电输出信号,并以Lissajous图形计算放电功率。反应器出口经冷阱收集液相产物后,气相进入气相色谱仪进行在线分析。在各考察条件下反应30 min 达到稳定后,间隔15 min 取三个平行样。本研究中采用TCD 气相色谱(SP-3420A,通道A:TDX-1,通道B:Propark QS)在线分析检测反应过程中产生的气相产物。其中,通道A用于定量分析CO2、H2、CO 以及定性分析其他产物,通道B 用于检测H2S 含量。液相产物通过气相色谱(Agilent GC7890B,DB-FFAP 毛细柱)进行分析。同时为准确检测含硫化合物,采用火焰光度检测器FPD(KB-PLOT Q+毛细柱)对可能存在的含硫副产物进行在线测定。

图1 低温等离子体系统Fig.1 Schematic diagram of the non-thermal plasma experimental set-up

图2 介质阻挡放电反应器反应床层截面温度分布Fig.2 The temperature distribution across the reaction bed under actual reaction conditions
H2S转化率计算如下:

式中,X(H2S)为H2S 转化率,%;n(H2S converted)为H2S转化量,mol;n(H2S input)为H2S进气量,mol。

式中,X(CO2)为CO2转化率,%;n(CO2converted)为CO2转化量,mol;n(CO2input)为CO2进气量,mol。
H2/CO(摩尔比)计算如下:

式中,n(H2/CO)为H2/CO 摩尔比;n(H2produced)为反应产物中H2的量,mol;n(CO produced)为反应产物中CO的量,mol。
各气态产物分布(D,%)计算如下:

式中,D(H2)为H2在气态产物中分布,%;D(CO)为CO在气态产物中分布,%;D(COS)为COS在气态产物中分布,%;n(H2produced)为反应产物中H2的量,mol;n(CO produced)为反应产物中CO 的量,mol;n(COS produced)为反应产物中COS的量,mol。
反应中硫平衡、碳平衡的计算分别如下:硫平衡

式中,B(sulfur)、B(carbon)分别为反应中硫平衡和碳平衡,%;n(H2S input) 为H2S 进气量,mol;n(H2S out) 为反应尾气中H2S 的量,mol;n(S out) 为反应产物中硫的量,mol;n(COS out) 为反应副产物COS 的量,mol;n(CO2input)为CO2进气量,mol;n(CO2out)为反应尾气中CO2的量,mol;n(CO out)反应尾气中CO的量,mol。实验中以N2作为内标物,根据气相色谱分析结果确定以上原料及反应后气相物种量,结合反应后积硫槽中硫黄称重质量进而计算硫、碳平衡。本研究中硫、碳平衡的误差均在5%以内,确保了实验数据的准确性。

式中,Y(CO)表示CO产率,%;n(CO out)为反应尾气中CO的量,mol;n(CO2input)为CO2进气量,mol。
低温等离子体放电功率由Lissajous 方法测定。将数字示波器与电路连接以Lissajous图形模式显示低温等离子体放电输出信号,进而计算放电功率[19]:

式中,SEI 为比能量密度,J/L;V为气体流量,L/s。
2 结果与讨论
2.1 不同Si/Al比ZSM-5催化剂的物相分析
ZSM-5催化剂是具有MFI拓扑结构的沸石分子筛,图3 示出了具有不同Si/Al 比ZSM-5 催化剂的XRD 谱图。从图中可以看出,各样品在2θ为7.8°、8.8°、23.2°、23.8°和24.3°等处均出现明显特征衍射峰,对应于MFI 型ZSM-5 分子筛的特征结构[21]。同时,未观察到有其他杂质峰存在,并且各特征衍射峰强度小且峰形宽化,这是晶粒尺寸小所造成的[22]。此外,表1示出了各ZSM-5催化剂的比表面积,从中可以看出不同Si/Al 比ZSM-5 催化剂的比表面积均在305~325 m2/g,无显著差异。

表1 不同Si/Al比ZSM-5催化剂的比表面积及介电常数Table 1 Specific surface area and dielectric constant of ZSM-5 catalysts with various Si/Al molar ratios

图3 不同Si/Al比ZSM-5催化剂的XRD谱图Fig.3 XRD patterns of ZSM-5 catalysts with various Si/Al molar ratios
2.2 不同Si/Al 比ZSM-5 催化剂的H2S-CO2转化反应性能
考察了不同Si/Al 比对ZSM-5 催化剂的H2SCO2转化反应性能影响。作为对照实验,表2示出了无低温等离子体协同作用下不同ZSM-5 催化剂上H2S和CO2高温热转化反应结果。如表所示,即使在500℃高温下,H2S 和CO2转化率均低于6%,证明H2S-CO2单独通过热法转化很难进行。以上反应结果主要归因于H2S和CO2分子结构稳定,活化二者需要很高能量,并且受到热力学平衡限制,因此难于在常规热法下实现高H2S 和CO2转化率。图4(a)、(b)分别示出了低温等离子体放电区填充不同ZSM-5 催化剂时H2S 和CO2转化率随SEI 的变化。各ZSM-5 催化剂对比单独低温等离子体放电反应均表现出更优的反应性能,表明ZSM-5 催化剂的填充促进了H2S-CO2转化。从图中可以观察到H2S、CO2转化率与SEI 直接相关,SEI 越高越利于H2S 和CO2转化。同时,不同Si/Al 比对H2S、CO2转化率也有明显影响。在相同SEI 下,H2S 和CO2转化率随Si/Al 比的增加呈现先增大后减小的变化趋势。其中,Si/Al 比为80 的ZSM-5 催化剂表现出最优的H2S-CO2转化性能,当SEI 在30 kJ/L 左右时,H2S 转化率可达99%以上,CO2转化率达到15%。以上H2S-CO2转化反应结果对比前期课题组已报道工作[15],在相同条件下H2S 转化率提高5%~8%,CO2转化率提高近1倍,达到最高H2S和CO2转化率。

表2 无等离子体下不同Si/Al比ZSM-5催化剂上热转化H2S-CO2反应结果Table 2 The thermal conversion of H2S-CO2 in the presence of packing various ZSM-5 catalysts without non-thermal plasma

图4 不同Si/Al比ZSM-5催化剂上H2S-CO2转化性能随SEI的变化(反应条件:原料气H2S/CO2为1∶4;N2浓度20%;反应气流量200 ml/min;填充体积15 ml)Fig.4 H2S-CO2 conversion as a function of SEI in the presence of packing various ZSM-5 catalysts in non-thermal plasma(feed:H2S/CO2 molar ratio=1∶4;20%(vol)N2 in H2S-CO2 gas;feed flow rate 200 ml/min;material bed volume 15 ml)
图5(a)示出了不同Si/Al 比ZSM-5 催化剂上H2S-CO2转化反应的气相产物分布随SEI 的变化。从化学反应式2H2S+CO2H2+CO+H2O+2S 可知,该反应气相产物为合成气(H2和CO 混合气),同时产生H2O 和S。如图5(a)所示,在H2S-CO2转化反应中填充不同Si/Al 比的ZSM-5 催化剂时气相产物为H2和CO,同时检测到极少量的副产物羰基硫(<1%),未检测到其他副产物。图5(b)示出了不同Si/Al 比ZSM-5催化剂上H2S-CO2转化反应的H2和CO产率。在相同反应条件下,当填充Si/Al 比为80 的ZSM-5催化剂时表现出最高H2和CO 产率,达到H2产率56.1%和CO 产率10.0%。观察图5(c)中不同Si/Al比ZSM-5 催化剂上产物合成气H2/CO 比随SEI 的变化,可以发现SEI 对H2/CO 比影响较大,产物H2/CO比随着SEI的增加而降低。当SEI从6 kJ/L增大至约33 kJ/L 时,H2/CO 比从3.0左右显著降低到0.5左右。上述实验结果表明,产物合成气的H2/CO 比明显依赖于注入能量。因此,在实际应用中可以通过改变SEI来调控产物合成气H2/CO比以适于不同需求。

图5 不同Si/Al比ZSM-5催化剂上H2S-CO2转化反应气相产物分布、H2及CO产率、H2/CO比(反应条件:原料气H2S/CO2为1∶4;N2浓度20%;反应气流量200 ml/min;填充体积15 ml)Fig.5 Gaseous product distributions,H2 and CO yields and H2/CO molar ratios in H2S-CO2 conversion with packing various ZSM-5 catalysts in non-thermal plasma(feed:H2S/CO2 molar ratio=1∶4;20%(vol)N2 in H2S-CO2 gas;feed flow rate 200 ml/min;material bed volume 15 ml)
在低温等离子体中,填充多孔材料会影响低温等离子体放电强度、电流密度以及气态分子活化和活性物种分布等[23]。一方面因为多孔材料对低温等离子体放电产生的活性物种存在吸附作用,从而延长了活性物种的停留时间。另一方面能有效改善放电区间中放电强度。图6(a)示出了输入功率均在95 W 左右条件下填充不同ZSM-5 催化剂及空管时的Lissajous 图形。当ZSM-5 催化剂填充到放电区域时,图形形状相似但均明显不同于空管放电。根据Lissajous 图形面积计算的放电功率如图6(b)所示。当各ZSM-5催化剂填充时,放电功率在70 W左右,无显著差异,但相比空管放电功率(57.5 W)增加近30%,表明在放电区域填充ZSM-5 催化剂有利于电荷积累,进而提升了放电功率,因此提高了放电密度[24]。此外,根据图6(a)中各ZSM-5 催化剂Lissajous 图形中BC和AD线斜率,可得到其填充后介质阻挡放电的有效电容[25]。如图6(b)所示,填充ZSM-5 催化剂后的有效电容在145~165 pF,均显著高于空管放电有效电容(109.8 pF)。Diao 等[25]发现在介质阻挡放电中填充物的有效电容值与放电电流密度成正比,实验中具有高有效电容的填充物其放电电流密度更高,进而有助于增强电荷转移,产生更多的微放电通道。如上所述,不同Si/Al 比ZSM-5 催化剂上H2S 和CO2转化率随SEI 的增大而增加,与SEI的递增关系说明H2S-CO2转化反应明显依赖于体系注入能量。这是因为SEI的增大意味着放电功率的增强,进而导致单位时间内微放电数量的增加,从而会促进产生更多如活性氢等高活性物种,而已有研究证实高活性氢物种会诱发CO2活化而产生更多CO[26-27]。

图6 H2S-CO2转化反应中填充不同Si/Al比ZSM-5催化剂的Q-U Lissajous图形、放电功率和有效电容(反应条件:原料气H2S/CO2=1∶4;N2浓度20%;反应气流量200 ml/min;填充体积15 ml;输入功率95 W)Fig.6 Q-U Lissajous figures,discharge power and effective capacitance in H2S-CO2 conversion with packing various ZSM-5 catalysts in non-thermal plasma(feed:H2S/CO2 molar ratio=1∶4;20%(vol)N2 in H2S-CO2 gas;feed flow rate 200 ml/min;material bed volume 15 ml;input power 95 W)
文献已报道在低温等离子体中填充材料的介电常数会影响放电等离子体的局部场强,介电常数高的材料作为填充物时会产生更多微放电,具有更高的放电强度,因此可以促进分子、自由基和电子之间化学反应的进行[28]。研究中在常温常压下测定了具有不同Si/Al 比ZSM-5 催化剂的介电常数ε,结果如表1所示。ZSM-5催化剂的介电常数随着Si/Al比的升高而增加,因此具有较高介电常数的ZSM-5催化剂会利于放电反应的发生。此外,不同Si/Al比的ZSM-5 催化剂比表面积相近(300 m2/g 左右),表明ZSM-5 催化剂的比表面积并非影响反应性能的主要因素。
综上所述,对比空管放电,填充ZSM-5 催化剂后活性物种停留时间的延长和放电功率、放电强度的增强均有利于提高H2S 和CO2转化性能。但针对具有不同Si/Al比的ZSM-5催化剂,结合对各催化剂比表面积、介电常数以及填充后对等离子体微放电如放电功率、等效电容值、电流密度等方面的量化研究结果,发现各ZSM-5 催化剂之间仅对低温等离子体放电影响的差异并不显著。如实验中也观察到当Si/Al比达到200时,尽管具有高介电常数,但过高Si/Al 比的ZSM-5 催化剂的催化性能降低。为了进一步揭示低温等离子体氛围下不同Si/Al 比的ZSM-5催化剂化学吸附性质与H2S 和CO2转化反应的构效关联,研究工作对低温等离子体放电氛围下和常规条件下的不同Si/Al比ZSM-5催化剂上CO2、H2S、H2、CO等化学吸脱附行为进行了下述对比研究。
2.3 不同Si/Al 比ZSM-5 催化剂的CO2-TPD 对比分析
图7(a)、(b)分别示出了常规条件下和低温等离子体放电氛围下的不同Si/Al 比ZSM-5 催化剂的CO2-TPD 谱图。如图7(a)所示,常规条件下的不同ZSM-5 催化剂上均可以观察到位于200℃前的单一CO2脱附峰。该类脱附峰可归属于CO2分子在ZSM-5 催化剂上的弱化学吸附[29]。而与图7(b)对比,在低温等离子体气氛下,300℃左右出现了ZSM-5 催化剂对CO2分子中强度吸附的脱附峰。根据文献报道,在低温等离子体放电区存在大量电子,并且置于放电区内的材料表面会产生电子鞘层[30]。由于CO2分子在低温等离子体下难于被直接解离产生CO和O原子,即主要以CO*2分子激发态形式存在[31]。在低温等离子体下,CO*2中带弱正电的C 原子更易于同ZSM-5 催化剂表面形成的电子鞘层发生正负电荷相互作用,进而增加对CO2的吸附强度。

图7 不同Si/Al比ZSM-5催化剂的CO2-TPD谱图Fig.7 CO2-TPD profiles of ZSM-5 catalysts with various Si/Al molar ratios
为了验证上述结论,研究中通过提高放电强度以增大低温等离子体放电电流及ZSM-5 催化剂表面的电子密度。图8示出了不同低温等离子体输入电压下ZSM-5 催化剂(Si/Al 比为80)的CO2-TPD 谱图。从图中可以观察到,随着放电强度增加,CO2分子的中高温脱附峰逐渐增大,证明该ZSM-5 催化剂表面鞘层中电子密度的提高可促进对CO2分子的中强度吸附,使ZSM-5 催化剂在低温等离子体放电氛围下具有更多的CO2中强吸附位,而对CO2吸附强度的增大有利于其在催化剂表面的催化转化。

图8 不同低温等离子体输入电压下ZSM-5催化剂(Si/Al=80)的CO2-TPD谱图Fig.8 CO2-TPD profiles of ZSM-5 catalyst with Si/Al molar ratio of 80 at various input voltage
2.4 不同Si/Al 比ZSM-5 催化剂的H2S-TPD 对比分析
图9(a)、(b)分别示出了常规条件下和低温等离子体放电氛围下的不同Si/Al 比ZSM-5 催化剂的H2S-TPD 谱图。如图9(a)所示,常规条件下各ZSM-5 催化剂上均可以观察到位于150~250℃的两个H2S 脱附峰。上述两类脱附峰分别归属于H2S 分子在ZSM-5 催化剂上的弱和中强度化学吸附[32],并且发现随着Si/Al比的升高,H2S脱附峰峰面积增大,表明较高Si/Al 比有助于H2S 分子在催化剂表面的吸附活化。将图9(b)与(a)对比,在低温等离子体放电氛围下,不同Si/Al比ZSM-5催化剂上中强度吸附的H2S 脱附峰(200~300℃)面积增大,但注意到该峰位置却无明显移动,这主要归于以下原因。由于H2S 分子在低温等离子体下极易分解生成HS 自由基以及H 原子,HS 自由基进一步会解离为S 和H[33-34]。因此,在低温等离子体下ZSM-5催化剂上所吸附的H2S 分子会部分分解产生S 和H2并吸附在催化剂表面。当升温至高温段时,上述吸附在催化剂表面的S 和H2会发生逆反应生成H2S 分子。基于此,尽管实验中观察到中强度吸附H2S 分子的脱附峰在中高温度段面积增大,但峰位置却无明显移动,即ZSM-5 催化剂对H2S 的吸脱附行为在低温等离子体氛围下无显著影响。
2.5 不同Si/Al 比ZSM-5 催化剂的H2-TPD 对比分析
图10(a)、(b)分别示出了常规条件下和低温等离子体放电氛围下的不同Si/Al 比ZSM-5 催化剂的H2-TPD 谱图。对于常规条件下的不同样品,在500~600℃均可观察到H2的化学脱附峰,该类峰可归属于H2在各ZSM-5 催化剂上的强化学吸附[35]。如图10(a)所示,随着Si/Al 比的升高,各样品的H2脱附峰向高温移动,显示具有较高Si/Al比的ZSM-5催化剂对H2具有更强的化学吸附强度。此外,对比图10(a)、(b)发现,在低温等离子体氛围下各不同Si/Al 比的ZSM-5 催化剂在较低温度区间(350~500℃)均出现新的H2脱附峰,该类峰归属于H2的中强度吸附。结合该H2脱附峰面积增加并伴随明显向低温方向移动的实验结果,说明低温等离子体下的ZSM-5催化剂具有更多的H2中强吸附活性位点,对H2的吸附量明显增加。这也表明,在低温等离子体作用下可以有效改善ZSM-5 催化剂的H 活化能力。这主要由于H2分子在低温等离子体下极易解离成H 原子,从而有效促进了ZSM-5催化剂对H2分子的吸附活化,提高了其加氢反应活性。根据前期工作,在H2S-CO2转化反应中,活性H 是参与CO 生成反应的关键物种[15]。其中观察到当Si/Al 比为80 时,中强度吸附H2的脱附峰面积最大,即对应低温等离子体作用下H2吸附量最高,因此有利于H2SCO2转化反应的进行,这也与反应评价结果相一致。

图10 不同Si/Al比ZSM-5催化剂的H2-TPD谱图Fig.10 H2-TPD profiles of ZSM-5 catalysts with various Si/Al molar ratios
2.6 不同Si/Al 比ZSM-5 催化剂的CO-TPD 对比分析
图11(a)、(b)分别示出了常规条件下和低温等离子体放电氛围下的不同Si/Al 比ZSM-5 催化剂的CO-TPD 谱图。如图11(a)所示,常规条件下的ZSM-5 催化剂上均可以观察到峰值位于100℃左右的CO 脱附峰,其可归属于CO 分子在ZSM-5 催化剂上的弱化学吸附[36]。但值得注意的是,对比图11(b)发现,在低温等离子体下该CO 弱吸附峰消失,各ZSM-5 催化剂上新出现了200~400℃的CO 脱附峰,该类峰归属于对CO 的中强度吸附。同时也发现随着Si/Al 比的升高,该类CO 脱附峰位置向高温方向移动,并且伴随脱附峰面积增大。根据脱附峰强度及面积可以看出,Si/Al 比为80 的ZSM-5 催化剂具有更多的CO 中强吸附位。结合上述H2S-CO2转化反应的评价结果,该催化剂表现出最优的反应性能。由于低温等离子体下大量电子富集在ZSM-5催化剂表面[30],而中强度吸附的CO 分子中C 原子带正电[37],因正负电荷的相互作用,CO 在ZSM-5 催化剂表面可大量吸附。而大量吸附的CO 分子可能促进了CO2分子在ZSM-5 催化剂表面的吸附活化,进而利于CO2转化反应(图12)。
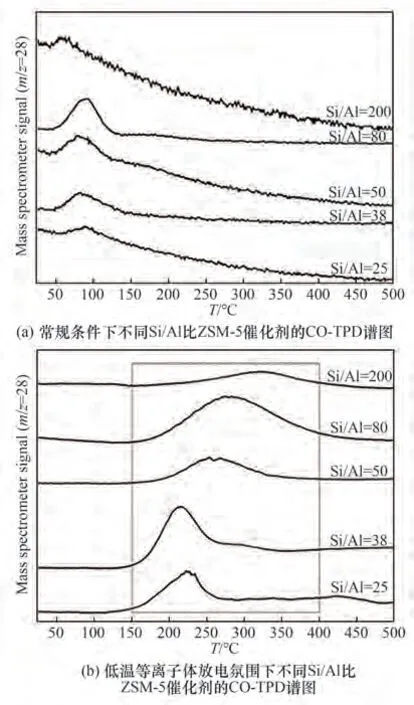
图11 不同Si/Al比ZSM-5催化剂的CO-TPD谱图Fig.11 CO-TPD profiles of ZSM-5 catalysts with various Si/Al molar ratios
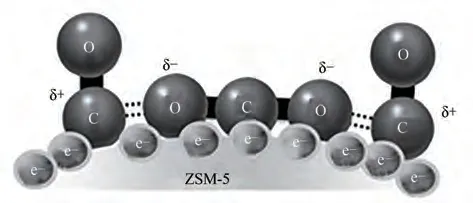
图12 ZSM-5催化剂表面吸附CO促进CO2吸附活化示意图Fig.12 CO adsorption on ZSM-5:improvement for CO2 adsorption
为了证明上述结论,研究工作先对催化剂进行了低温等离子体下CO的吸附实验,在此基础上进一步完成CO2吸脱附表征。图13示出了低温等离子体下吸附CO 后ZSM-5 催化剂(Si/Al 比为80)的CO2-TPD 谱图。从图中可以观察到,经过低温等离子体下CO吸附后,催化剂对CO2中强度吸附量显著增多,该实验结果验证了ZSM-5 催化剂对CO 吸附后会促进其对CO2分子的吸附活化。综上所述,由于Si/Al比为80 的ZSM-5 催化剂具有CO 中强度吸附量最多,在低温等离子体放电环境下具有更多的CO2中强吸附位,进而利于低温等离子体下CO2分子在表面的催化转化,所以在相同条件下其CO2转化率最高。

图13 低温等离子体下吸附CO后ZSM-5催化剂(Si/Al比为80)的CO2-TPD谱图Fig.13 CO2-TPD profiles of ZSM-5 catalyst with Si/Al molar ratio of 80 after CO adsorption in non-thermal plasma
3 结 论
采用ZSM-5 催化剂与低温等离子体结合显著提高了H2S-CO2一步转化制合成气反应性能。研究表明ZSM-5 催化剂Si/Al 比直接影响其对该反应的催化性能。ZSM-5 催化剂介电常数会随Si/Al 比的升高而增大,高介电常数有利于低温等离子体放电反应。同时,对不同ZSM-5 催化剂上CO2、H2S、H2、CO分子等化学吸脱附行为的对比研究发现,低温等离子体放电氛围下的ZSM-5催化剂对H2S分子吸脱附影响较小,但对CO2、H2以及CO 分子的吸附有显著促进作用,对应出现了新的有别于常规条件下的中强度吸附位,进而提升了H2S 和CO2转化率,而产物CO 的生成也会促进CO2分子在低温等离子体下的吸附活化,揭示了低温等离子体氛围下ZSM-5 催化剂表面吸脱附性质和H2S-CO2转化反应的构效关系。其中,Si/Al 比为80 的ZSM-5 催化剂表现出最优的催化H2S-CO2转化制合成气反应性能,最高H2和CO产率分别达到56.1%和10.0%。

