氮硫掺杂石墨烯量子点的合成及在孔雀石绿定量分析中的应用
邱競瑶,何 岗,白文凤,金 丽*,张建坡
1.吉林化工学院 化学与制药工程学院,吉林 吉林 132022
2.吉林石化精细化学品厂,吉林 吉林 132022
孔雀石绿其实不含有孔雀石的成分,其得名是因为二者颜色相似而已,孔雀石绿不仅是一种染料,还是可以杀真菌、细菌、寄生虫的药物,但它是一种有毒的三苯甲烷类化合物,长期过量食用具有致癌作用,我国农业农村部明令禁止将孔雀石绿用于水产品之中。但是由于孔雀石绿对鱼体和鱼卵水霉病有特效,而市场上目前没有可以短时间治愈水霉病的特效药,因此水产业养殖户仍会违规使用孔雀石绿。此外,在运输过程中,鱼贩也常使用孔雀石绿延长鳞受损鱼的生命,因而市场上仍在售卖孔雀石绿。
近年来,不同的检测方法被用于孔雀石绿的分析,例如表面增强拉曼法(SERS)[1]、液相色谱-质谱联用法[2-3]、免疫法[4]、电化学法[5]、荧光法[6-7]。其中荧光法具有快速、灵敏度高、操作简单等优点。Ju等[8]利用双波长金纳米簇基于能量共振转移对孔雀石绿进行了检测;Luo等[9]研发的RNA适配体可以与孔雀石绿特异性结合,实现荧光“关-开”检测;Hu等[10]则采用Se、N、Cl掺杂碳点对孔雀石绿进行了定量分析;周刚[11]基于QuEChERS方法,采用电喷雾正离子多反应监测模式,建立同时测定水产品中孔雀石绿和结晶紫及其代谢物残留量的LC-MS/MS检测方法;王蓓蓓等[12]建立了一种高效液相色谱法-串联质谱法,可适用于水产品中孔雀石绿和隐色孔雀石绿的测定;赖姝毓等[13]基于溶胶-凝胶法建立了孔雀石绿快速直读显色检测与半定量方法;肖佳敏等[14]将富含多糖的内源真菌Phyllostictacapitalensis的粉末菌剂作为生物吸附剂,可对孔雀石绿染料废水进行吸附处理。
液相色谱及液相色谱-质谱联用的方法虽然灵敏度较高,但是前处理步骤多,检测成本高。目前的检测技术手段或步骤烦琐、耗时长,或方法不够灵敏,不能达到理想的检测效果。然而,基于量子点荧光猝灭法定量分析孔雀石绿相关的报道还比较少。因此,开发简便、高效且成本低廉的检测方法是未来发展方向。
作者以硫脲和柠檬酸为原料,在电炉上直接加热,15 s快速合成出了发射蓝光的氮硫掺杂的石墨烯量子点(N,S-GQDs),最大发射波长为449 nm。进一步研究了N,S-GQDs与孔雀石绿的相互作用,讨论了检出限的测定和猝灭反应机理,得出N,S-GQDs荧光强度的降低与孔雀石绿的浓度呈正比例关系,建立了一种用于孔雀石绿定量的分析方法。本研究针对水中孔雀石绿残留构建的荧光探针法,在食品安全快速分析领域具有广阔的应用前景。
1 材料与方法
1.1 试验材料
孔雀石绿(ARS):天津鼎盛鑫化工有限公司;硫脲和柠檬酸:国药集团化学试剂有限公司。所有试剂均为分析纯,使用前未做任何处理。水为双蒸水(>18 MΩ·cm)。
1.2 仪器与设备
F-280荧光分光光度计:天津港东科技发展股份有限公司;UV-2500紫外可见分光光度计:日本岛津公司;FLS920稳态/瞬态荧光光谱仪:海森堡公司;BWS465-532S拉曼光谱仪:必达泰克科技股份有限公司;Tecnai G220 电子显微镜:FEI公司;Thermos Scientific K-AlphaX 射线光电子能谱仪:厦门裕洲商贸有限公司。
1.3 试验方法
1.3.1 氮硫掺杂石墨烯量子点的合成
根据文献[15-16]的方法,并进行了修改,具体如下:将0.4 g柠檬酸和硫脲混合物(质量比1∶ 1)加入50 mL烧瓶中,在电炉上直接加热2 min,直至混合物变为浅黄色,超声下加入10 mL氢氧化钠溶液(浓度为0.3 mol/L,已加热)。所得溶液旋转蒸发去除大部分的水,80 ℃烘干2 h,得浅黄色晶体。称质量后,溶解(质量浓度为5 mg/mL),4 ℃保存。
1.3.2 氮硫掺杂石墨烯量子点用于孔雀石绿的定量分析
将10 μL孔雀石绿(浓度根据测试要求而定)加入60 μL N,S-GQDs中,定容至2 mL(pH=9),室温下孵育1 min,测得荧光发射光谱,激发波长370 nm,激发和发射狭缝都为5.0 nm。
2 结果与分析
2.1 氮硫掺杂石墨烯量子点的表征
采用透射电镜对所合成的N,S-GQDs进行表征,结果如图1a所示。由图1a可知,N,S-GQDs纳米粒子分散比较均匀,为近球形,粒度范围为2~8 nm。采用X射线光电子能谱(XPS)对N,S-GQDs中的元素和表面基团进行分析,结果如图1b所示。由图1b可知,XPS光谱在531、399、288、163 eV处的峰为O1s、N1s、C1s和S2p的特征峰,在化合物中各原子的含量依次为32.90%、12.94%、48.53%、5.62%,说明成功地将氮硫掺杂到石墨烯量子点中。
通过荧光光谱对N,S-GQDs的光学性质进行了分析,测得在不同激发波长下(300~390 nm)的荧光发射波长。最大荧光发射波长未发生明显的变化(图2a),但是荧光发射强度(图2b)先增大后减小,这可能是因为发射位点的不同[17],当激发波长为 370 nm时荧光发射强度最大,最大荧光发射波长为 449 nm。
2.2 氮硫掺杂石墨烯量子点与孔雀石绿的相互作用的机理讨论
将一系列浓度的孔雀石绿(MG)加入N,S-GQDs中,N,S-GQDs的最大荧光发射波长随着MG浓度的增加而增大(发生红移,从449 nm到530 nm),而且N,S-GQDs的荧光发射强度也会随之降低,荧光发射峰的形状也发生了变化。
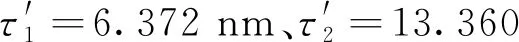

图3 添加MG前后N,S-GQDs的荧光衰减曲线与不同浓度MG对N,S-GQDs的荧光发射光谱的影响
根据许金钩的理论,猝灭剂(本文中为MG)可以引起荧光物质(本文中为N,S-GQDs)荧光强度明显的降低,该过程为荧光猝灭过程。猝灭剂对荧光物质的荧光猝灭过程可分为静态猝灭和动态猝灭[18]。通过变温曲线测定、紫外吸收光谱绘制和计算,用以确定MG所引起的N,S-GQDs猝灭方式。如图4所示,在20 ℃、30 ℃和40 ℃下,将一系列浓度的MG加到N,S-GQDs溶液后,N,S-GQDs荧光强度的降低(F0/F)仍与所加入MG的浓度成正比例关系。根据许金钩提出的猝灭原理,荧光猝灭符合公式F0/F=1+Kqτ0M=1+KsvM,其中τ0代表N,S-GQDs的平均荧光寿命,M代表MG的浓度,Kq代表荧光衰减常数,Ksv代表回归线的斜率。由图4可知,随着温度的升高,回归线的斜率随之减小,这是静态猝灭的特征之一。斜率随着温度升高而减小,这是因为温度升高引起配合物的稳定度下降,从而减小静态猝灭程度。测得荧光衰减曲线后(谱图未给出),通过平均加权计算法[19]得到了N,S-GQDs的τ0为5.05 ns。通过公式Kq=Ksv/τ0可得20 ℃、30 ℃和40 ℃时的Kq分别为2.015×1013、1.768×1013、1.612×1013mol·L-1·s-1,均大于最大静态猝灭常数(2×1010mol·L-1·s-1),这也与许金钩提出的静态猝灭的理论相符合。
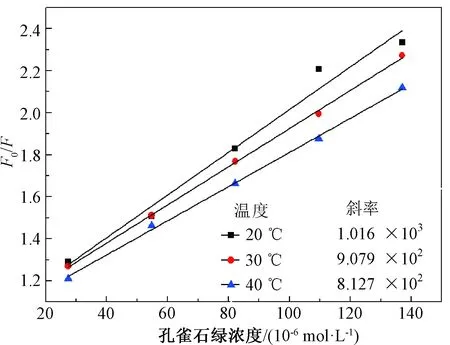
图4 不同温度下MG的浓度和N,S-GQDs荧光强度的线性关系
此外,加入MG后N,S-GQDs的紫外吸收光谱(图5)发生了明显的变化,MG位于420 nm处的吸收峰发生明显的增高,而且415 nm处出现新的吸收峰,该处的吸收峰会随着MG浓度的增加而增大,如图5插入图所示。这些均符合静态猝灭的特点,也说明N,S-GQDs和MG二者之间形成了复合物。综上所述,MG所引起的N,S-GQDs荧光猝灭过程为静态荧光猝灭过程。
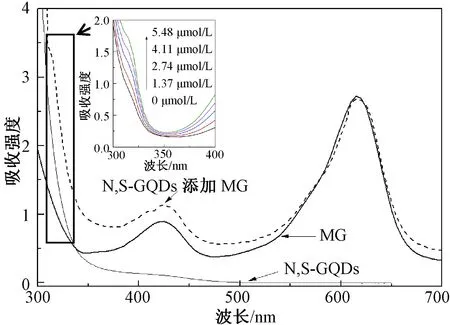
图5 N,S-GQDs添加MG前后的紫外吸收光谱
2.3 氮硫掺杂石墨烯量子点用于孔雀石绿的定量分析
为了进一步应用,优化了pH值对该猝灭体系的影响。由图6可知,pH值会引起该体系荧光强度较大的波动,通过反复试验发现当pH值为9时荧光强度比较稳定,因而选择pH值为9。此外,该体系随着时间变化,荧光强度变化不大,为了使试验数据具有可比性,选择孵育时间为1 min。为了操作方便,采用室温作为孵育温度。
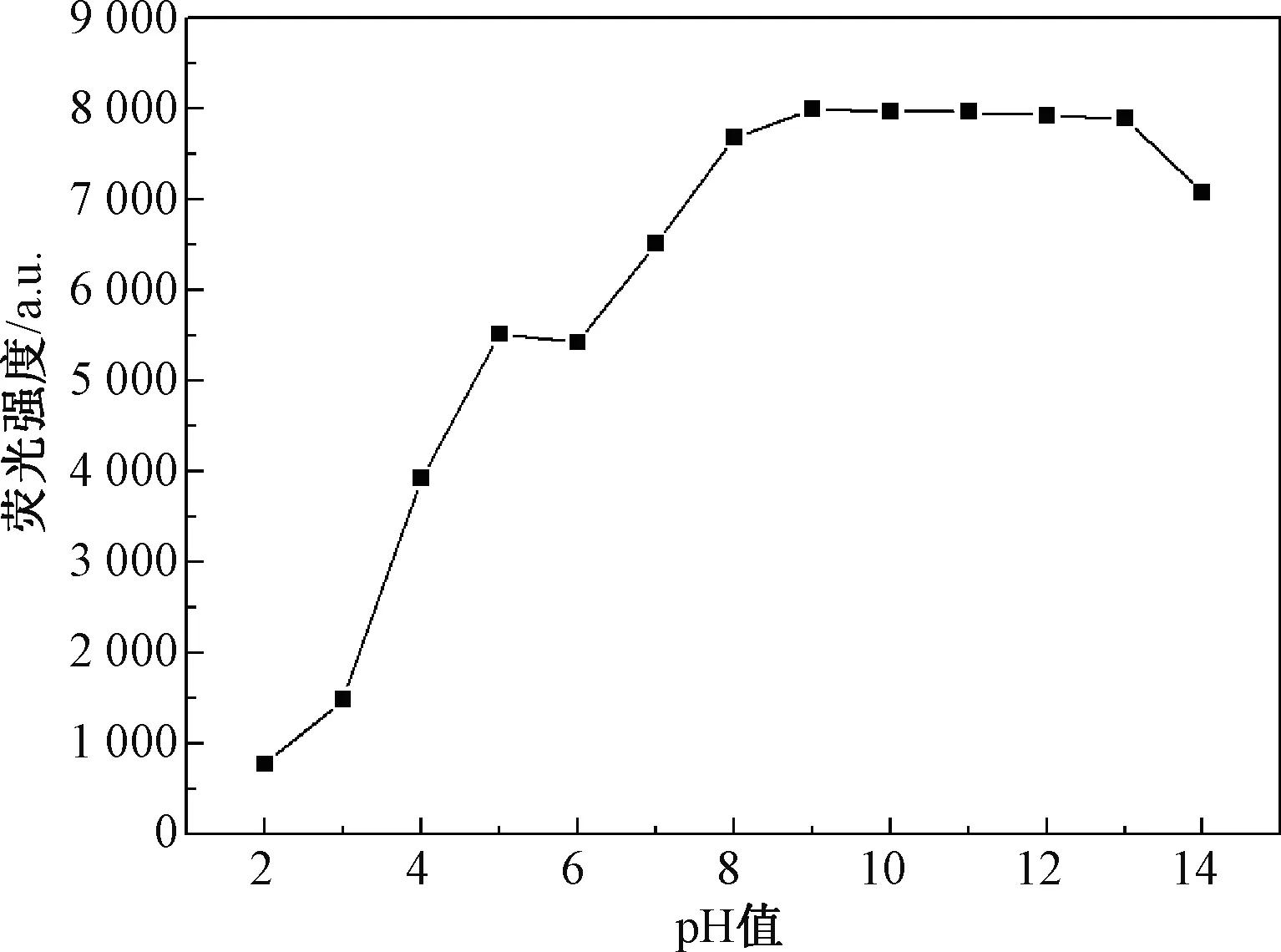
图6 溶液pH值对猝灭体系荧光强度的影响
在最优条件下,测定该猝灭体系的最低检出限,如图7所示。MG浓度范围为8.22~13.70 nmol/L时,回归方程为F0/F=0.005 18M+0.963 8,根据文献[20]计算可得最低检出限为4.83 nmol/L(1.76 ng/mL)。此时所采用的N,S-GQDs质量浓度为0.1 g/L,荧光激发狭缝为5 nm,发射狭缝为10 nm。由表1可知,与其他荧光检测方法[6,7,9]相比,本研究方法具有更低的检出限,虽然检测范围略窄,但是在实际样品检测中可以通过稀释样品溶液满足测试的要求。虽然SERS[5]方法具有更低的检出限,但是该方法用到了复合金的四氧化三铁纳米粒子,检测成本远远高于本方法。
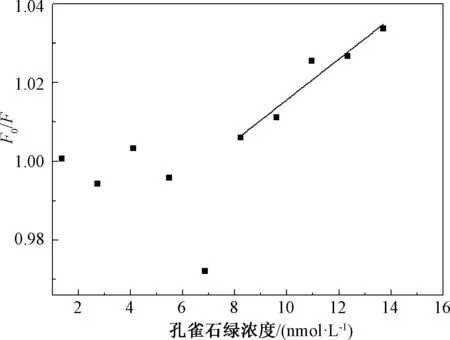
图7 不同浓度的MG与N,S-GQDs荧光强度(F0/F)的关系

表1 本研究和其他几种检测孔雀石绿的方法的比较
2.4 水样品分析
将该荧光体系用于实际样品的分析,水样取自市场中养鱼的水。通过向其中加入确定量的MG溶液得到待分析试样,之后采用本荧光体系进行定量分析。由表2可知,当未加入MG时,采用本荧光体系未检出MG的含量。当不同量的MG被加入水样中后,回收率为95.80%~116.30%,说明本方法可以用于样品中MG的定量分析。

表2 水样中MG含量分析
3 结论
研究了表面具有羧基、硫基和氨基的N,S-GQDs的快速合成方法。所合成材料粒径为2~8 nm,分布比较均匀,结晶度良好,晶格间距0.33 nm。基于N,S-GQDs与MG之间存在静态猝灭的过程,设计N,S-GQDs荧光探针,用于MG的定量分析,最低检出限可达到4.83 nmol/L(1.76 ng/mL)。

