液相色谱串接质谱仪测定有机茶叶中的苦参碱与氧化苦参碱
李 丽
(江苏联合职业技术学院镇江分院 镇江高等职业技术学校,江苏镇江 212000)
苦参碱、氧化苦参碱属于喹诺里西啶类生物碱,广泛存在于豆科的槐属、野决明属及山豆根属等植物中[1-2]。苦参碱、氧化苦参碱对于治疗结核病、溃疡性结肠炎、乙型肝炎以及癌症的辅助治疗都有一定的疗效,在医学上得到了广泛的应用[3-7]。在植物的病虫害防治方面,苦参碱、氧化苦参碱可以有效防治竹斑蛾[8]、对异色瓢虫[9]、茶毛虫[10]等病虫害,是良好的杀虫剂。中国是世界最大的茶叶生产和贸易国,也是欧盟茶叶的最大输入国,仅2014年中国出口到欧盟的茶叶就有2.49万t,货值达到1.04亿美元,其中有相当一部分是有机茶叶[11-12]。中国国家标准《有机产品》(GB/T 19630.1—2011)[13],明确规定苦参碱、氧化苦参碱可以作为杀虫剂投入品进行使用,且没有最大残留限量的规定。但是近年来,欧盟加强了对茶叶中农药残留的监控,其监控项目由过去的458项增加到现在的将近600项。对于没有授权使用的农药,其最大允许残留限量均采用了一律标准,要求不得大于10μg/kg。仅今年9月份,西班牙就在欧盟快速预警平台上公布了3起从中国进口红茶中检出未经授权使用的化学物质苦参碱,并且在口岸自动拒收,给出口商造成了很大的损失。
目前检测苦参碱、氧化苦参碱的方法包括:气相色谱法[17]、高效液相色谱法、滴定法、薄层色谱法、比色法、瑞利散射法、液相色谱串接质谱法。这些方法有的是针对苦参碱、氧化苦参碱的制品或者生物检样,并不针对茶叶样品;有些检测植物产品的方法,样品前处理的过程复杂,提取净化耗时长,重复性不佳,影响检测的周期。到目前为止,我国尚未制定出同时检测茶叶中苦参碱、氧化苦参碱含量的标准。因此,有必要建立检测方法对茶叶中苦参碱、氧化苦参碱的含量进行本底调查,确保茶叶的安全质量,规避有机茶叶出口面临的风险。
1 材料与方法
1.1 仪器
Thermo TSQ Quantan Access液相色谱-串接质谱仪:配电喷雾离子源(ESI)和自动进样器(Finnigen Surveyor);XPE205电子天平:感量0.01mg(梅特勒公司,瑞士);DS-1组织捣碎机(上海右一仪器有限公司,中国);3K15高速冷冻离心机(Sigma公司,德国);SB-1000YDTA超声波清洗机(宁波新芝生物科技股份有限公司,中国)。
1.2 试剂及耗材
乙腈,乙醇:均为色谱纯(Merck公司,德国);氨水,三氯甲烷,氯化钠:均为分析纯(上海国药集团);实验用水为Milli-Q高纯水(Millipore公司,美国);N-丙基乙二胺固体粉末(PSA,上海安普公司);石墨化炭黑(GCB,深圳逗点公司)。
苦参碱标准溶液(CAS:519-02-8 分子式C15H24N2O)购自广州硕谱生物科技有限公司(1 000 μg/mL),于4℃保存;氧化苦参碱(CAS:16837-52-8 分子式C15H24N2O2)购自上海国药集团,纯度大于98%。标准溶液:取适量的氧化苦参碱,用乙腈配制成1 000μg/mL的标准储备液,于4℃保存。临用时将苦参碱、氧化苦参碱标准储备液等体积混合,根据实验需要,用乙腈稀释至适当浓度用于生成标准曲线和试样加标。
1.3 样品处理
(1)用于实验的20份样品均从本地市场、上海、福建等地采购。
(2)取300g茶叶,用组织捣碎机充分打碎,过100目筛子,取筛下物混合均匀备用。
(3)样品的提取净化
①称取茶叶0.500g(±0.002)于50mL离心管中,加入10mL去离子水涡旋30s,水浴20min(50℃)后超声20min。加入100μL浓氨水涡旋30s,加入1g氯化钠涡旋2min,加入20mL三氯甲烷涡旋2min超声20min。以8 000r/min(离心半径8cm)离心5min后,弃去上层的水相,取15mL三氯甲烷层氮吹至干(避免将上层的水相吸入)。残渣中加入100mg PSA和1.0mL乙醇,超声2min复溶,过有机相膜进样。
②加标回收试验,采用经过检测的不含待测组分的茶叶进行加标,提取净化程序按照1.3.3.1实施。
1.4 仪器条件
Se QuantTMZic®-Hillic 亲水柱(150mm×2.1mm,5um);流动相:A相:乙腈、D相:10mmoL/L乙酸铵(含有0.15%甲酸),梯度洗脱(表1),流速0.3mL/min;进样量,25μL;柱温30℃。
电喷雾离子源(ESI),正离子模式扫描;质谱扫描方式:多反应监控(MRM);喷雾电压4200V;离子源温度380℃;辅助气流速3mL/min;壳气流速4mL/min;碰撞气(氩气)流速0.45mL/min。苦参碱的定量、定性对和碰撞能量分别为249/148.1m/z、32eV,249/150.1m/z、31eV,249/112.2m/z、32eV,249/110.2m/z、35eV,249/98.2m/z、37eV;氧化苦参碱的定量、定性对和碰撞能量分别为265/205.1m/z、30eV,265/150.0m/z、32eV,265/148.0m/z、30eV,265/136.1m/z、29eV,265/98.2m/z、34eV。标准溶液的总离子流图,如表1,图1所示。
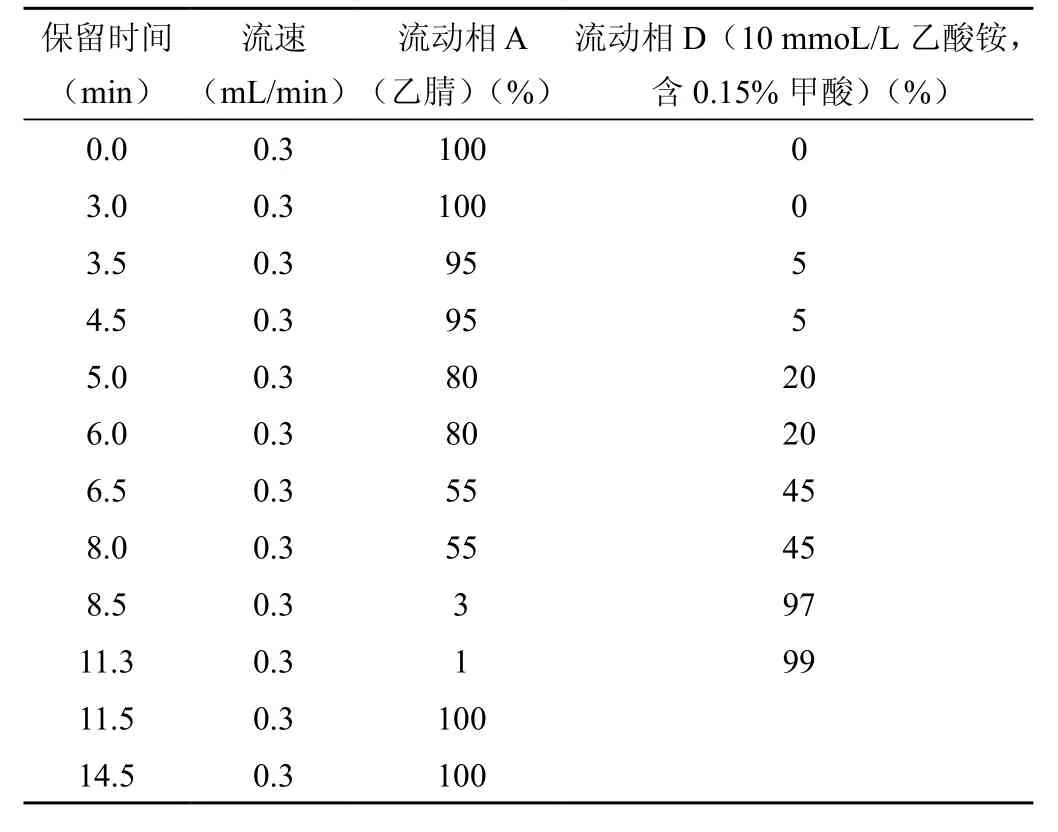
表1 色谱梯度洗脱条件

图1 苦参碱、氧化苦参碱总离子流图(浓度0.312 μg/L)
2 结果
2.1 方法的标准曲线、线性范围、检出限和定量限
吸取100.0μL苦参碱、氧化苦参碱混合标准溶液(100.0μg/L)于900.0μL乙腈中,涡旋混合均匀。再用乙腈倍比稀释,共计6个点:0.312、0.625、1.25、2.50、5.00、10.0μg/L。以峰面积对质量浓度作图,苦参碱的标准工作曲线Y=8.19×104X-2.93×103,如图2所示;氧化苦参碱的标准工作曲线Y=3.62×104X-5.18×103(图3)。结果显示,在所测定的质量浓度范围内,苦参碱、氧化苦参碱工作曲线有良好的线性,相关系数(R2)大于0.999。

图2 苦参碱的标准曲线(0.312~10.0μg/L)
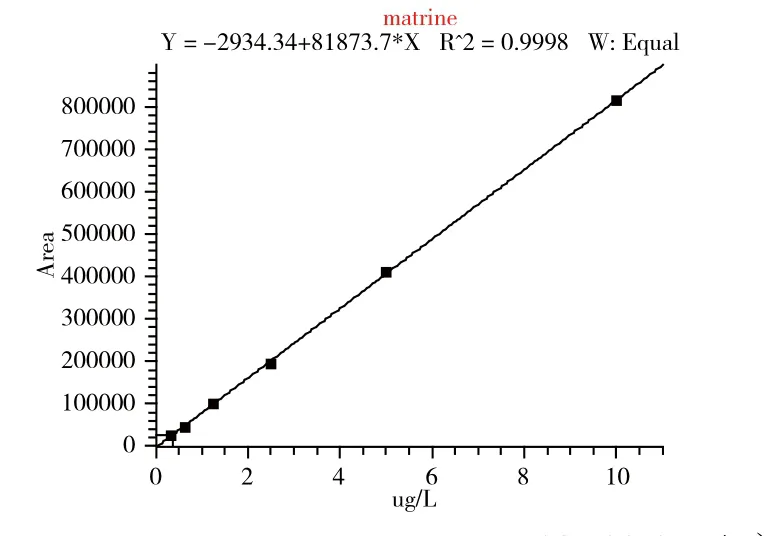
图3 氧化苦参碱的标准曲线(0.312~10.0μg/L)
参照EPA[28]的方法,先计算仪器的检出限和定量限。然后在仪器的定量限上做实际样品的加标回收,以7次平行试验的标准偏差计算方法的检出限和定量限。苦参碱、氧化苦参碱的检出限均为1.0μg/kg;苦参碱、氧化苦参碱的定量限均为2.0μg/kg。
2.2 实验的回收率和精密度
用三种有机茶叶的阴性样品做加标回收试验,添加水平为2.00μg/kg、4.00μg/kg、10.0μg/kg,每个加标水平测定6次,苦参碱的回收率70.5%~78.3%,相对标准偏差4.60%~7.80%,如表2所示;氧化苦参碱的回收率93.0%~105%,相对标准偏差3.21%~5.17%(表2)。阴性样品以及加标样品的总离子流图,如图4~5所示。
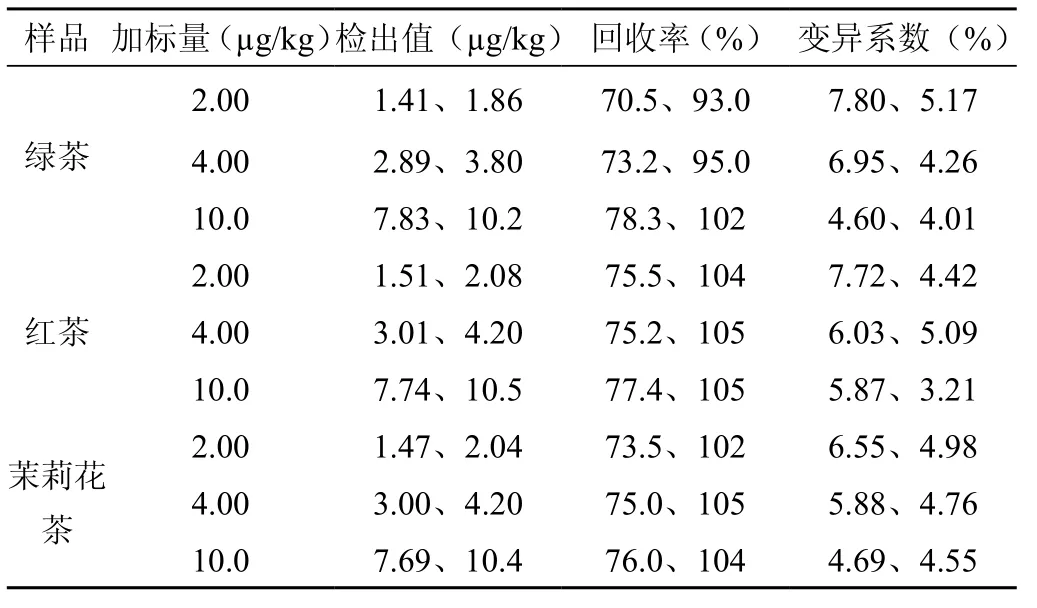
表2 茶叶阴性样品的加标回收率、精密度(苦参碱、氧化苦参碱)(n=6)

图4 茶叶空白样品提取液总离子流图
2.3 样品的筛查
20份有机茶叶样品,其中有3份样品检出苦参碱,分别为绿茶(8.31μg/kg、12.3μg/kg)和红茶(6.77 μg/kg),其他均未检出。
3 讨论
尝试了C18柱、C8柱、亲水柱、离子交换柱(SCX柱、MCX柱)等色谱柱用于待测组分的分离。C18、C8柱排除样品基质干扰的效果不佳,易出现假阳性的结果。离子交换柱对待测组分的保留性强,峰型较宽并且拖尾。采用亲水柱,在梯度洗脱条件下,空白样品基质在苦参碱和氧化苦参碱的出峰处会产生微小的干扰峰,但是其含量不足定量限的1/5,对检测结果以及产品的合规性没有影响;待测组分的峰型、保留时间等方面,都能够满足相关的技术要求(图5)。因此,选择Se QuantTMZic®-Hillic 亲水柱作为分离柱。

图5 茶叶加标样品提取液总离子流图
QuEChERS方法是检测农药残留经常使用的技术,但是实验中发现其主要的试剂——石墨化炭黑(GCB)对苦参碱、氧化苦参碱有很强的吸附作用,基本没有加标回收率。茶叶中富含鞣酸,苦参碱容易与之形成鞣酸苦参碱,水溶性增大。但是试验结果显示,采用纯水(中性的、酸化或者碱化的)、水/乙腈体系(中性的、酸化或者碱化的)、水/甲醇体系(中性的、酸化或者碱化的)、纯乙腈、纯甲醇,对目标化合物的提取效果都不佳,回收率偏低,且基质干扰较大。在茶叶样品中加入过量的氨水可以有效中和茶叶中鞣酸之类的酸性物质,有利于苦参碱、氧化苦参碱转移至三氯甲烷中;水相中加入氯化钠可以使水的饱和度增加,能够降低苦参碱、氧化苦参碱在水相中的分配系数。通过优化,本实验的选择性、回收率、精密度、检出限、定量限等指标均符合欧盟残留监控指南的要求。
4 结论
本研究建立了有机茶叶中苦参碱、氧化苦参碱的液相色谱串接质谱的检测方法。样品用水溶解超声萃取后,加入氨水中和茶叶中的酸性物质;水相中加入氯化钠后,用三氯甲烷提取待测组分,经PSA净化后上机测定。该方法具有良好的分离效果、线性关系,也具有理想的回收率和精密度。方法的检出限、定量限分别为1.00μg/kg和2.00μg/kg。筛查的茶叶中有3份呈阳性结果。该方法简便、快速、准确,适用于茶叶中苦参碱、氧化苦参碱的检测,为出口茶叶的质量安全监测提供技术支撑。

