原代胃癌相关成纤维细胞的分离培养与鉴定方法比较
梅晶晶,吴霏2,支慧3,徐慧秋2,江玉华3,李佳嘉
(1. 皖南医学院弋矶山医院病理科,安徽 芜湖 241000;2. 皖南医学院临床医学院,安徽 芜湖 241000;3. 皖南医学院病理学教研室,安徽 芜湖 241000)
胃癌是我国常见的消化道恶性肿瘤,我国发病人数与死亡例数约占全球胃癌发病数的50%[1-2]。伴随着胃癌的早期筛查,近几十年来胃癌的发病率有所下降[3],但是胃癌病死率依然高达74.5%。近年来发病率明显增加,死亡率仅次于肺癌[4],尤其是晚期胃癌患者的五年生存率仅为10%[5]。治疗胃癌已是我国癌症防治的重中之重,临床研究发现侵袭性高及远处转移是胃癌预后不良的主要原因[6]。癌症虽然由癌细胞内发生的突变引起,但是肿瘤组织的发展及其对治疗的反应均受到肿瘤微环境的调控。肿瘤细胞生存的内环境,即肿瘤微环境(tumor microenvironment,TME),不仅包括肿瘤细胞自身,还涵盖了多种非肿瘤细胞(如脂肪细胞、免疫细胞、成纤维细胞),各类因子(如趋化因子、生长因子、炎症因子)及间质血管。有研究结果显示,胃瘤组织微环境中的间质细胞可通过多种形式进行信息特质的传递,破坏细胞外基质的结构,导致胃癌肿瘤组织的高转移浸润的特性[7]。肿瘤相关成纤维细胞(carcinoma-associated fibroblasts,CAFs)是肿瘤微环境中的三大基质细胞之一,主要是由肿瘤中固有的成纤维细胞被激活转化而来[8]。活化的CAFs除了是肿瘤微环境的构成成分,更是可与微环境中的其它细胞互相作用,在肿瘤的发生发展过程中均发挥着重要作用,如促进肿瘤细胞的恶性表型的改变(如化疗耐药、抗凋亡、侵袭转移)。故胃癌肿瘤微环境中的CAFs有望成为抑制胃癌转移复发的靶细胞。
1 材料与方法
1.1胃癌组织的来源 2019年9月—2020年12月从皖南医学院弋矶山医院无菌手术室收集经病理诊断为胃癌的新鲜胃癌组织标本,患者年龄为50~70岁。在无菌条件下将取下来的胃癌组织放置在含有5%青链双抗的培养基中,并在低温下保存,2 h内送至学校无菌操作台进行分离培养操作。
1.2主要试剂 1640培养基(碧云天公司生产)、胎牛血清(gibico公司生产),0.25%胰蛋白酶(碧云天生物科技公司生产)、α-平滑肌肌动蛋白(迈新生物科技有限公司生产),波形蛋白(迈新生物科技有限公司生产),CK-18(迈新生物科技有限公司生产)。
1.3人原代CAFs的培养
1.3.1胃癌组织标本的处理 在消毒完毕的超净台内拿出从医院带回来的胃癌组织标本,倒出组织中的培养基,用镊子夹住组织块,用含5%青-链双抗的RPMI-1640培养基反复冲洗组织块,每隔半小时左右,将镊子夹的组织块放在无菌的培养皿中,换新镊子重新夹住组织块的不同位置,重复以上操作,直至组织块冲洗干净。
1.3.2胰酶消化法分离培养CAFs 将冲洗干净的组织块放在培养皿中,并在培养皿中加入含有10%FBS的RPMI-1640培养基中,用新的消毒好的镊子夹住组织块在培养皿的正上方,用剪刀修剪组织块至很小。将混合着培养基的组织块用胶头吸管转移到5 ml离心管中,将剪刀插入到离心管里面反复修剪至很小的碎组织块。离心后将组织块转移到15 ml的离心管中,加入5 ml 0.25%的胰酶,封住离心管口,晃动均匀,放置在5%CO2,37 ℃培养箱中培养半小时,半小时后拿出来充分混匀震荡,再次放回培养箱中,以此重复操作3~4 h。3 h、4 h后,拿出培养箱中含有组织块的离心管,加入等体积的10%FBS RPMI-1640培养基终止消化,充分混匀后过滤,收集筛网下的滤液后离心(1000 r/min),在离心后的细胞沉淀中加入3 ml 10%FBS RPMI-1640培养基,吹打均匀后转移到培养瓶中,十字摇晃均匀后放入5%CO2,37 ℃培养箱中培养,2~3 d后换液。
1.3.3组织块培养法分离培养CAFs 将上述1.3.2中冲洗干净的组织块放在培养皿中,加入适量含10%FBS的RPMI-1640培养基覆盖住组织块,用剪刀将组织块修剪成很小的块状组织,用镊子将修剪好的组织块转移到培养瓶中,每瓶放3~5个组织块,将培养瓶放入5%CO2,37 ℃培养箱中培养,1 h后从培养箱中拿出组织块,观察组织块是否贴壁,贴壁后在培养瓶中加入3 ml含10%FBS的RPMI-1640培养基,放入培养箱中继续培养,2~3 d换液1次。
1.4人原代CAFs的分离 与上皮细胞相比,基质细胞在培养的过程中更容易被胰酶消化脱壁,再次贴壁也很快。根据基质细胞的这种特性,在培养时采用差速贴壁法进行分离纯化胃癌相关成纤维细胞,在倒置显微镜下观察CAFs的形态,人原代CAFs生长2~3 d后就能进行传代:在无菌操作台中倒出旧的细胞培养液,用PBS清洗2次,加入1 ml 0.25%胰酶放入5%CO2,37 ℃培养箱中培养5 min左右直至在倒置显微镜下观察发现所有的细胞都变成悬浮的小球,消化结束后加入等体积的含10%FBS的RPMI-1640培养基终止消化,将含有胰酶的细胞悬液转移到5 ml离心管中离心(1000 r/min)后弃上清,加入3 ml含10%FBS的RPMI-1640培养基,将细胞呈“十字”摇晃均匀后转移到5%CO2,37 ℃培养箱中培养1 h,1 h后从培养箱中取出细胞,用胶头吸管从培养瓶中吸出上清转移到下一个培养瓶中,并补充培养基到3 ml,在第一个弃去培养液的瓶中加入PBS清洗2~3遍,洗去多余的未贴壁细胞,然后加入3 ml培养基,由于基质细胞贴壁较快,第一个培养瓶培养1 h后剩余的贴壁细胞即为CAFs,剩下没有贴壁的都是杂细胞。
1.5人原代CAFs的镜下观察与细胞组织学鉴定
1.5.1人原代CAFs的显微镜观察 显微镜下观察不同生长阶段的CAFs的生长特点。
1.5.2HE染色观察CAFs形态 取5代以内生长状况良好的胃癌相关成纤维细胞种植在6孔板中,待其生长至60%左右时观察到其形态舒展开来,细胞之间不拥挤,弃去培养板中的培养基,加入4%的甲醛固定,1 h后弃去每孔中的甲醛,用双蒸水清洗数次至没有甲醛残留,甩干孔板中的水后,每孔加入1 ml苏木素,10 min后弃去孔板中的苏木素,PBS清洗3次,每孔加入1 ml伊红,5 min后弃去伊红洗干净后在倒置显微镜下观察,并拍照记录。
1.5.3免疫细胞化学鉴别CAFs的形态和表面标志物 在6孔板中放入圆形玻璃片,P3代胃癌相关成纤维细胞种在上述6孔板中,细胞爬片培养2~3 d后至细胞几乎全部覆盖住玻璃片,PBS小心清洗2~3次,用4%多聚甲醛常温固定1 h,PBS清洗3次,0.1%Triton-100孵育30 min,PBS清洗3次,在每孔种加入过氧化物酶溶液在摇床上摇晃孵育30 min,30 min后用PBS清洗3次加入正常非免疫动物血清孵育30 min,30 min后用PBS清洗6次加入一抗(α-平滑肌肌动蛋白α-SMA的工作液浓度为1∶200;波形蛋白Vimentin的工作液浓度为1∶200;角蛋白CK-18的工作液浓度为1∶200)4 ℃孵育过夜,第2天用PBS清洗6次,加入生物素标记的第二抗体孵育2 h,PBS清洗完毕后加入链霉菌抗生物素30 min,最后用DAB试剂显色并在镜下观察,拍照。
2 结果
2.1胰酶消化法分离培养CAFs 剪碎的组织中加入胰酶置于5%CO2,37 ℃培养箱中培养,第1天时可以在倒置显微镜下看见几个悬浮的细胞,并且培养液里混杂着许多丝状组织碎片。第2天观察发现,整个瓶中的培养液都较为浑浊,悬浮着很多消化碎的组织沫,看见2~3个细胞贴壁生长,呈长梭形,胞质清亮。3 d后进行常规换液,放置在培养箱中5%CO2,37 ℃条件下继续培养,在14 d时可以看见数个小团块细胞生长,呈漩涡状。20 d时细胞可以铺满整个培养瓶。见图1。

A:细胞生长第7天;B:细胞生长第12天;
2.2组织块培养法分离培养人原代CAFs 将冲洗干净的组织块用剪刀剪成小块放置在培养瓶中,7 d左右可以看到组织块四周爬出成纤维细胞,呈长梭形,围绕着组织块呈漩涡状生长,生长速度较快,第14天时细胞基本覆盖住整个瓶子,高倍镜下可以看见成纤维细胞胞质透亮,有多个散在的核仁。P5前生长速度极快,传代2~3 d可长满,培养基比较干净,生命力及其旺盛,对细胞代谢废物不敏感,一周不换液可继续生存。见图2。
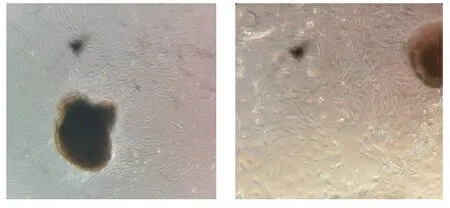
图2 组织块培养法分离培养GCAFs第14天(×100)
2.3HE染色观察CAFs形态 细胞呈长梭形,细胞核中有多个散在的核仁,胞质饱满有2个以上的触角。见图3。

图3 HE染色鉴别人原代CAFs的形态(×200)
2.4免疫细胞化学鉴别CAFs表面标志物 Vimentin在胞质中呈阳性表达,表明该细胞是成纤维细胞,而α-SMA呈阳性表达,CK-18呈阴性表达,并且结合取材部位,证明其为激活的CAFs。见图4。

A:α-SMA(+);B:Vimentin(+);C:CK-18(-)。
3 讨论
研究表明[9],CAFs是存在于肿瘤微环境中的一种基质细胞,是肿瘤组织浸润转移的调节器,为肿瘤微环境的重要组成部分。研究胃癌CAFs的生长为我们进一步研究胃癌与胃癌CAFs之间的作用关系具有重要的意义。本文对比分析了胰酶消化法和组织块培养法两种培养法,提出了两点注意事项:首先,成功取材是细胞培养的重要前提,新鲜的胃癌组织标本离体后,容易被操作环境中的灰尘污染而导致取材失败,因此我们要创造良好的无菌环境,严格遵守无菌操作要求来收集胃癌组织标本。此外,标本转移的过程中要保持低温并确保在短时间内送达实验室。
其次,结合实验结果,我们得知在相同的时间内组织块培养法比胰酶消化法产生的细胞数量更多,耗材更少,操作简便。组织块培养法只需将组织块转移到培养瓶后在培养箱中培养,定期换液即可,而胰酶消化法还需用胶头吸管将组织块与培养液要同时转移,两次更换不同型号离心管,每半小时就要混匀震荡重复操作3~4 h,从培养箱取出后还要进行离心操作并注意吹打均匀。因此我们在后续实验研究中更加侧重于组织块培养法。

