磁共振波谱对前列腺癌、前列腺增生及前列腺炎的鉴别诊断
闫茹茹
(山西白求恩医院放射科 山西 太原 030032)
前列腺癌(prostatic cancer,PCa)是男性中最高发的癌症之一[1]。PCa可能先于癌症形态形成改变细胞代谢[2]。虽然与PCa发生相关的因素尚不清楚,但考虑与年龄、种族和遗传因素相关,直系亲属受到影响,疾病的可能性会增加一倍[3]。前列腺病变主要与临床症状相关,如前列腺特异性抗原(PSA)增加。PCa和良性前列腺增生(benign prostatic hyperplasia,BPH)具有局灶性表现,而前列腺炎是一种弥漫性疾病[4]。虽然PSA血液试验是早期诊断PCa最常见的方法,但特异性较低[5-6]。因此,应该用一种具有高敏感性和特异性的非侵入性方法来诊断PCa、前列腺炎和BPH。磁共振成像(MRI)是一种不使用电离辐射的非侵入性成像技术。这种模式能够描绘PCa,并为诊断、分期和治疗计划提供解剖和生理信息。用于诊断前列腺病变的不同类型的MRI包括:T2加权成像、扩散加权成像(DWI)、动态对比增强磁共振成像和磁共振波谱(MRS)[7-8]。MRS作为一种功能性的非侵入性手段,可检测前列腺代谢物的水平,包括柠檬酸盐(Cit)、胆碱(Cho)和多胺肌酸(Cr)含量[9]。PCa相关的代谢物包括良性组织标记物Cit、Cr和恶性组织的标记物Cho。在定量分析中,所有代谢物的峰值是通过(Cho+Cr)/Cit来评估的。在定性分析中,比较Cit和Cho的峰值高度,如果在至少三个相邻体素中观察到较高Cho/Cit峰值,则判断为可能患有PCa[10]。关于磁共振成像的非侵入性、敏感性和特异性及其在早期检测小肿瘤的能力,MRS有区分PCa和前列腺炎的能力。为了提供关于前列腺生化和结构变化的信息,磁共振波谱已经被许多先前的研究所应用[1]。最近的研究主要集中在PCa检测上,这已经被多参数磁共振成像(mpMRI)彻底改变[11]。因此,本研究的目的是分析和比较前列腺炎、PCa和BPH的区别,并确定三者是否可通过MRS进行区分。
1 资料与方法
1.1 一般资料
将2012年2月—2019年2月于我院进行MRS检测的121名患者纳入本研究。包括32名PCa患者,平均年龄(68.38±8.03)岁,平均BMI(22.37±1.66)kg/m2;18名前列腺炎患者,平均年龄(68.33±7.88)岁,平均BMI(22.52±1.62)kg/m2);71名BPH患者,平均年龄(67.24±12.32)岁,平均BMI(22.00±1.70)kg/m2),分别命名为PCa组、炎症组和BPH组,三组患者的年龄及BMI相比无显著差异(P>0.05),可比较。
1.2 方法
所有的磁共振成像检查都使用3.0 T扫描仪进行,通用电气型号为Achieva 3.0 T磁共振系统(飞利浦,荷兰)。为了通过射频脉冲刺激所需区域,使用射频体线圈,并使用SENSE-XL-Torso线圈进行数据采集。为了确定肿瘤的范围和位置以及光谱学的范围,采用T2快速自旋回波技术(T2WI),弥散加权成像,SPIR压脂技术。扫描序列:T2WI-TRA/SAG,T1-TRA,DWI-TRA,SPIRCOR,3D PRESS。T2WI-TRA层厚4 mm,层间距0.5 mm,TR=3 484 ms,TE=90 ms,FOV 26×26×9.8,NEX=2。T2WISAG层厚4 mm,层间距0.5 mm,TR=3 000 ms,TE=74 ms,FOV 22×23×8,NEX=2。T1-TRA 层厚4 mm,层间距0.5 mm,TR =444 ms,TE=7.1 ms,FOV 26×26×9.8,NEX=2。DWI层厚4 mm,层间距0.5 mm,TR=4 000 ms,TE=70 ms,FOV 23×23×11,NEX=4,b值分别是0和1 000 s/mm2。T2-COR-SPIR层厚4 mm,层间距0.5 mm,TR=4 678 ms,TE=70 ms,FOV 25×23×8,NEX=2。波谱TR=1400 ms,TE=140 ms,ACQ matrix MXP=5×5 cm2,ACQ Voxel MPS=12×12×12 mm3,饱和带选择前列腺周边,并进行VOI区域脂肪压制,调整带宽为2 000 Hz,并实施匀场处理。在磁共振波谱技术中,10个外部饱和带用于防止磁场不均匀性和磁化率,这种不均匀性和磁化率与线圈、骨结构、前列腺增生脂肪和膀胱中尿液的存在有关。前列腺磁共振波谱中水和脂肪的抑制导致这些结构在扫描中不受干扰。饱和带位于前列腺周围的所有方向,以消除由前列腺周围组织、脂肪组织和直肠组织引起的光谱干扰。局部磁场均匀性通过自动匀场程序进行优化。一般来说,完成扫描(包括患者定位、磁共振成像和光谱数据采集)所需的时间约为20 min。平均光谱扫描时间约为5 min。观察并记录三个组的影像学结果,以及代谢产物含量分析,代谢产物含量分析包括Cho/Cit、(Cho+Cr)/Cit。
1.3 统计学方法
所有数据采用Excel进行整理,结果用平均数±标准差(± s)来表示。采用Graphpad Prism 6.0对三组中的指标数据进行单因素方差分析,P<0.05表示差异有统计学意义。年龄、BMI和(Cho+Cr)/Cit之间用Pearson进行相关分析,相关性用R语言的corrplot包进行可视化。
2 结果
2.1 影像学结果分析比较
在PCa组(图1A)、前列腺炎组(图1B)以及BPH组(图1C)中,影像学表现均为前列腺轮廓清晰,膀胱充盈良好,其内未见充盈缺损影,盆腔内未见肿大淋巴结。在前列腺炎组和BPH组中,影像学均表现为:包膜完整,体积增大,呈球形变,前列腺向上部分突入膀胱内,前列腺中央腺体明显均匀增大,外周带受压变窄呈环状,以长T1,等长T2信号为主。在PCa组中,前列腺呈等T1、等低T2信号,双侧精囊腺呈等T1、等T2信号。在前列腺炎组中,外周带受压变窄呈环状,信号均匀,膀胱内偏腹侧可见局灶性长T1、短T2信号影。而在BPH组中,前列腺中央带信号不均匀,以长T1、长T2信号为主。各组胆碱峰的谱线形态见图1D-F。
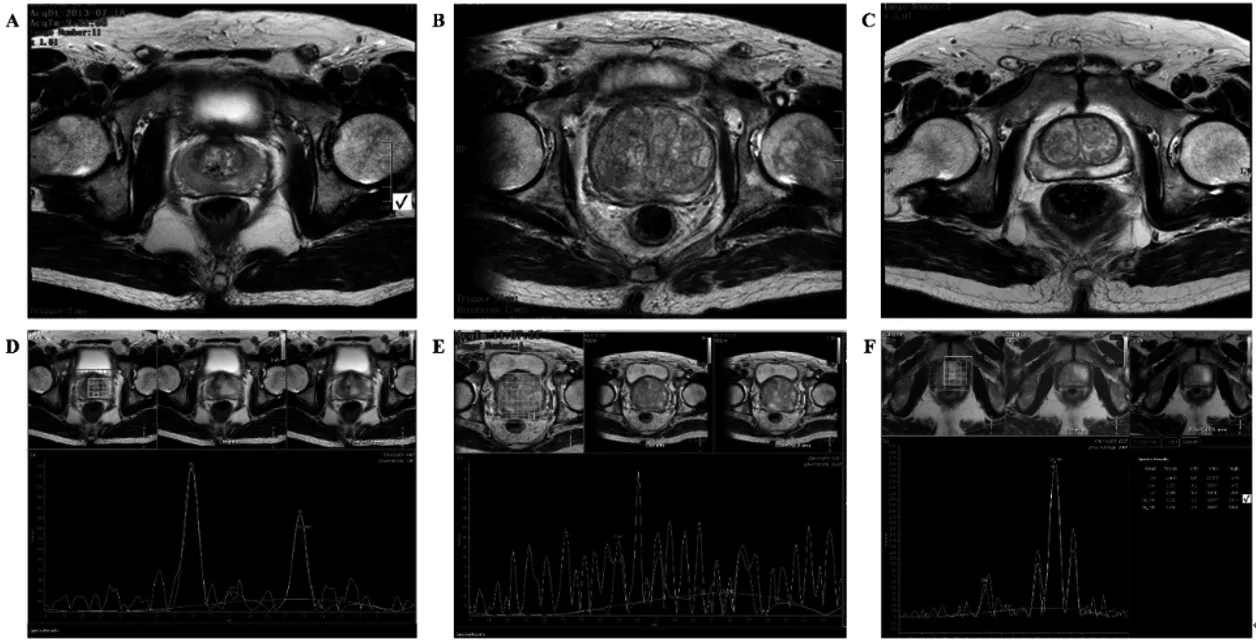
图1 PCa、前列腺炎和BPH的T2横断影像学图像
2.2 代谢产物含量分析比较
PCa组(Cho+Cr)/Cit平均值为(5.02±1.06),炎症组为(0.27±0.06),BPH组为(0.10±0.01)。因此,癌症患者的(Cho+Cr)/Cit值显著高于炎症组和BPH组(表1)。且每两组间差异均有统计学意义(P<0.05)。PCa组的Cho代谢物的峰值明显高于增生组和BPH组。而癌症组的Cit值较低。
表1 代谢产物含量计算情况比较( ± s)
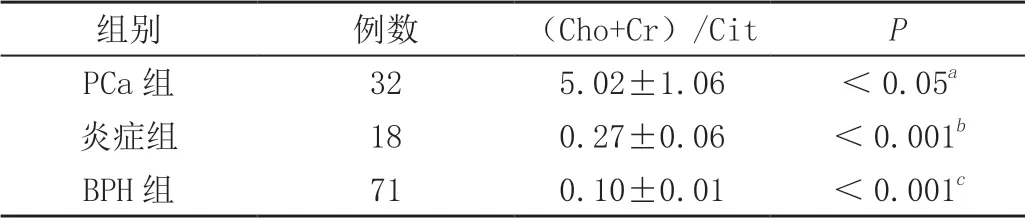
表1 代谢产物含量计算情况比较( ± s)
注:a为PCa组与炎症组比较;b为炎症组与BPH组比较;c为PCa组与BPH组比较。
此外,进一步分析了年龄、BMI与(Cho+Cr)/Cit之间的相关性,发现年龄、BMI和(Cho+Cr)/Cit之间无显著相关(图2)。
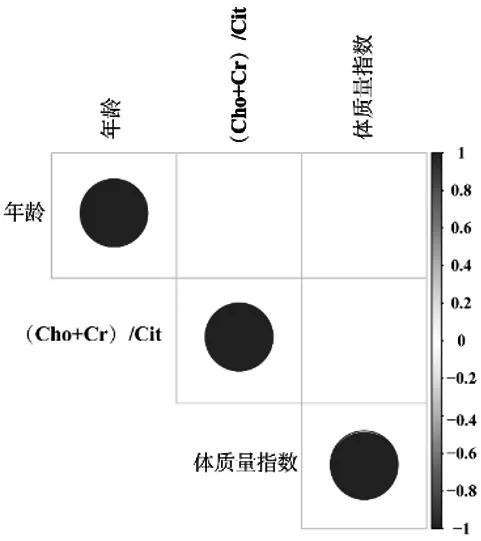
图2 年龄、BMI和(Cho+Cr)/Cit之间相关性
3 讨论
MRS检查对于PCa来说是一种相对较新的技术,已用于常规临床实践[11]。它被证明能有效提高前列腺疾病鉴别诊断的准确性。T2WI更常用于PCa的精确检测和分期[12]。(Cho+Cr)/Cit与癌症分期之间存在显著相关性,被用作常规前列腺病变的评估标准[12]。在较严重阶段,Cho和Cr的总量高于Cit。通过抽血检测也有相同的结果,较高的PSA可使Cho和Cr总量更高,相反,(Cho+Cr)/Cit的比值增加,PCa的侵入水平也增加[13]。目前来说,MRS评估(Cho+Cr)/Cit是检测PCa的可接受指标,代谢物的分布有助于评估病理阶段和侵入性PCa以确定合适的治疗方案,(Cho+Cr)/Cit增加为恶性组织,而良性组织中(Cho+Cr)/Cit较低,例如,前列腺癌症组中(Cho+Cr)/Cit高于BPH组,这与我们的结果也一致。
此外,本文结果显示,PCa组与BPH组相比,Cit显著降低,Cho升高,而前列腺炎病变显示Cho正常,Cit没有显著降低。磁共振观察到的大部分Cit信号来源的腔内空间可能由于炎症过程而变得压缩精液含量减少,导致Cit水平异常[14]。BPH的MRS测量提供了Cho和Cit的参考值。在目前的研究中,Cho并没有在所有前列腺炎病例中升高,因为这种代谢模式不同于癌症。通过Cho可以初步诊断PCa和前列腺炎。也有研究证明,(Cho+Cr)/Cit<0.75为BPH,(Cho+Cr)/Cit>0.86为PCa,若比值在0.75~0.86内,可考虑为PCa,需做进一步的诊断。在本文结果中,PCa组中的(Cho+Cr)/Cit均>0.86,BPH组中均<0.75。在我们的病例中,炎症组的(Cho+Cr)/Cit相对于BPH组是显著升高的,可能由于炎症伴随着一定的增生情况,而增生不一定会发生炎症反应。因此在实际应用中还需要结合影像学表现来诊断前列腺炎和良性前列腺增生。
尽管MRS有精确的物理原理和临床能力,但也有特殊的局限性。它对患者自愿和不想要的运动非常敏感,目前可通过适当的匀场和提高磁场强度来解决。另一个问题是截断伪影,就是使用适当的射频接收器系统消除该伪影。对于MRS的研究,样本量小是研究最大的局限,为了提高病情诊断的准确率,我们应在更高磁场中使用直肠内线圈检测更多的代谢物并提高磁共振波谱的分辨率。也可加大样本量,筛选出在更高强度的磁场中其他可作为新的生物标记物代谢物。总之,我们的结果表明,比较(Cho+Cr)/Cit有助于PCa、前列腺炎和BPH的准确诊断。根据这些发现,可以得出结论,MRS可以作为一种合适的无创性工具用于诊断PCa、前列腺炎和BPH,具有较高的敏感性、特异性和准确性。

