间断热疗在低体质量婴儿体外循环改良超滤期的应用△
谢 庆,彭勤宝,周成斌,陈晓霞,宋海娟
[1.广东省人民医院(广东省医学科学院)心外科,广州 510080;2.南方医科大学南方医院心外科,广州 510515]
随着心脏外科整体技术的不断发展,越来越多的低龄低体质量先天性心脏病患儿可以更早地接受外科手术治疗,而在体外循环(cardiopulmo⁃nary bypass,CPB)中为了克服过度的血液稀释给此类低血容量患儿带来不良影响,由Naik 等提出的改良超滤(modified ultrafiltration,MUF)被广泛应用于10 kg 以下的患儿[1],即在CPB 结束后使用超滤器进行10~15 min 的超滤,以此提升患儿红细胞压积(hematcrit,HCT),减轻液体负荷,减少临床用血需求。传统的MUF 期间由于失去氧合器的保温效应,暴露于手术室室温下的血液管道会迅速散失热量[2],造成患儿核心体温下降等非计划低体温事件的发生,导致代谢紊乱、心力衰竭甚至休克[3],而充气式保温则是其有效的应对手段[4]。本研究通过前瞻性、随机对照的研究设计,应用Bair-Hugger 升温系统对低体质量婴儿在MUF 期间实施间断热疗并与传统方法相比,评价其有效性及安全性。
1 资料和方法
1.1 一般资料
本研究经医院伦理委员会批准通过(伦理号:2016404H),共纳入2017 年1 月至2018 年6 月于广东省人民医院心血管外科行外科治疗的患儿113例。纳入标准:(1)年龄≤1 周岁,体质量5~10 kg;(2)行常见先天性心脏病术式,先天性心脏病手术风险校正评分(risk adjustment for congenital heart sur⁃gery,version 1;RACHS-1)2~3 分;(3)患儿监护人知情同意并签署相关文书。排除标准:(1)术前血流动力学不稳定,纽约心脏协会(New York Heart Association,NYHA)婴儿心功能分级Ⅳ级;(2)术前合并其他器官功能障碍;(3)术前存在活动性感染征象;(4)术前存在皮肤相关并发症,如红肿、破损等。
1.2 研究方法
应用计算机进行随机化分组,将患儿分为热疗保温组(M 组,n=59)以及常规保温组(C 组,n=54)。于术前铺设好一次性充气式保温毯(3MTMBair HuggerTMBlanket System Pediatric Long Model 530)确保其有孔侧朝向患儿,开启Bair-Hugger 升温系统(3M Bair Hugger Model 750)至低转速风扇档位并完成自检测试,手术室温保持在22~25℃。所有患儿均按本中心诊疗常规在体外循环下完成先天性心脏病外科治疗,体外循环过程采用2.4 L/(m2·min)的流量并行,全程测量鼻咽温(nasopharyngeal temperature,Tn)及直肠温(rectal temperature,Tr),降温至30~32℃并维持此平台期大于15 min 保证目标降温有效;心内操作完成后开始复温直至Tn及Tr维持36~37℃并维持此平台期大于15 min 保证目标复温有效,心肺转流结束后行MUF,期间将Bair-Hugger 升温系统调至高转速风扇档位,M 组患儿以3 min 为区间分别使用38 ℃和43 ℃交替保温直至MUF 结束,C 组患儿则全程使用38 ℃保温至MUF 结束。所有患儿均由固定心外科医师、麻醉师、CPB 师、护理团队进行住院期间的治疗。
1.3 观察指标
统计全部患儿的基线资料,包括性别、年龄、体质量、心功能分级及RACHS-1 评分等。记录两组患儿手术的基本情况,包括手术时间、CPB时间、主动脉阻断时间、术中用血量等。于CPB结束(T1)、MUF 后5 min(T2)、MUF 结束(T3)、手术结束(T4)、入重症监护病房即刻(T5)共5 个时间点,检测两组患儿的Tn及Tr)。记录两组患儿术后并发症的发生情况,包括皮肤发红部位数和术后发热。
1.4 统计学分析
应用IBM SPSS 20.0 进行统计分析。计数资料以()的表示,组间比较采用Student-t检验,重复的计量资料比较行秩和检验。计量资料以[n(%)]表示,组间比较采用卡方(χ2)检验或Fisher精确概率法。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患儿基线资料比较
两组患儿在性别、年龄、体质量、心功能分级以及RACHS-1 评分上比较,均差异无统计学意义(P>0.05),见表1。
表1 两组患儿基线资料比较 [n(%),]
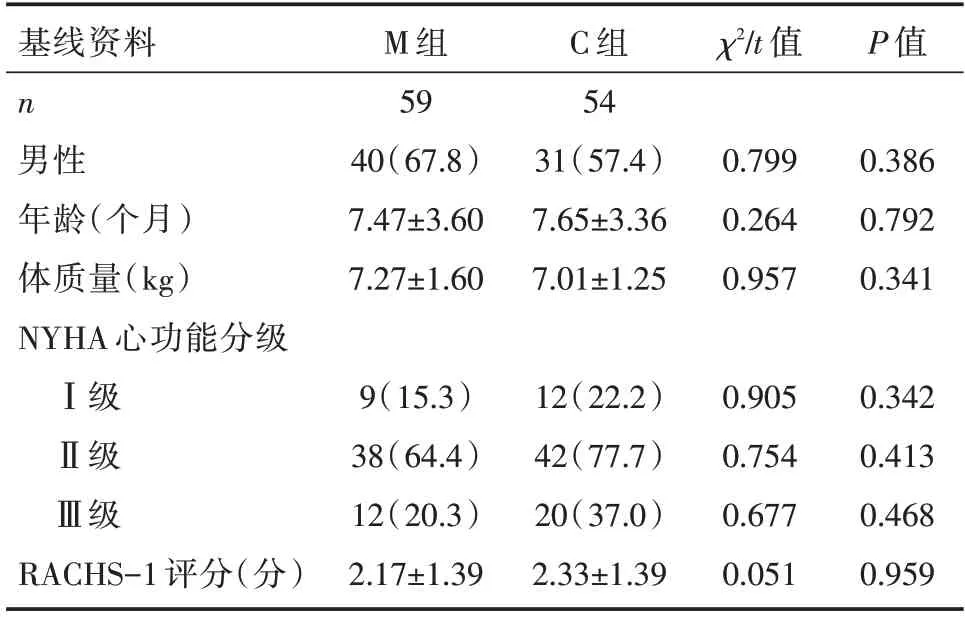
表1 两组患儿基线资料比较 [n(%),]
2.2 两组患儿术中资料比较
两组患儿在手术时间、CPB 时间、主动脉阻断时间、术中用血量比较,差异均无统计学意义(P>0.05),见表2。
表2 两组患儿的手术情况比较 []
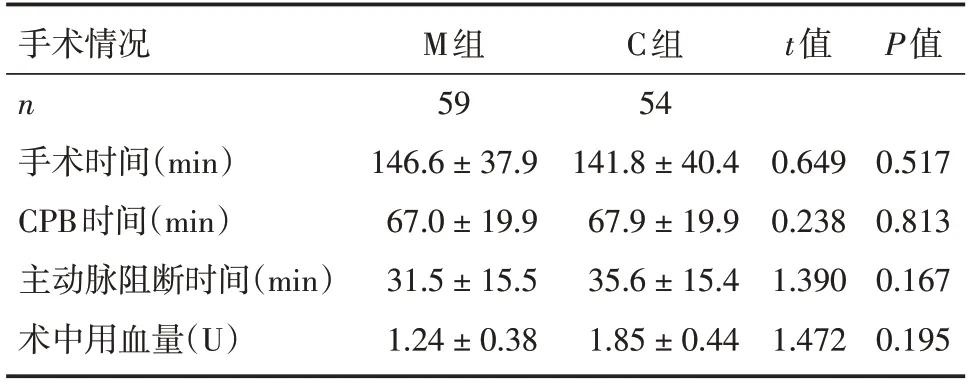
表2 两组患儿的手术情况比较 []
2.3 两组患儿在不同时间点的鼻咽温及直肠温比较
M 组患儿T1~T5时点的Tn和Tr均明显升高(P<0.05);C 组患儿T1~T5时点的Tn和Tr均明显降低(P<0.05);M 组患儿T2~T3时点的Tn和Tr均高于C组,差异有统计学意义(P<0.05),见表3。
表3 两组患儿在不同时间点的Tn和Tr比较 [℃,]
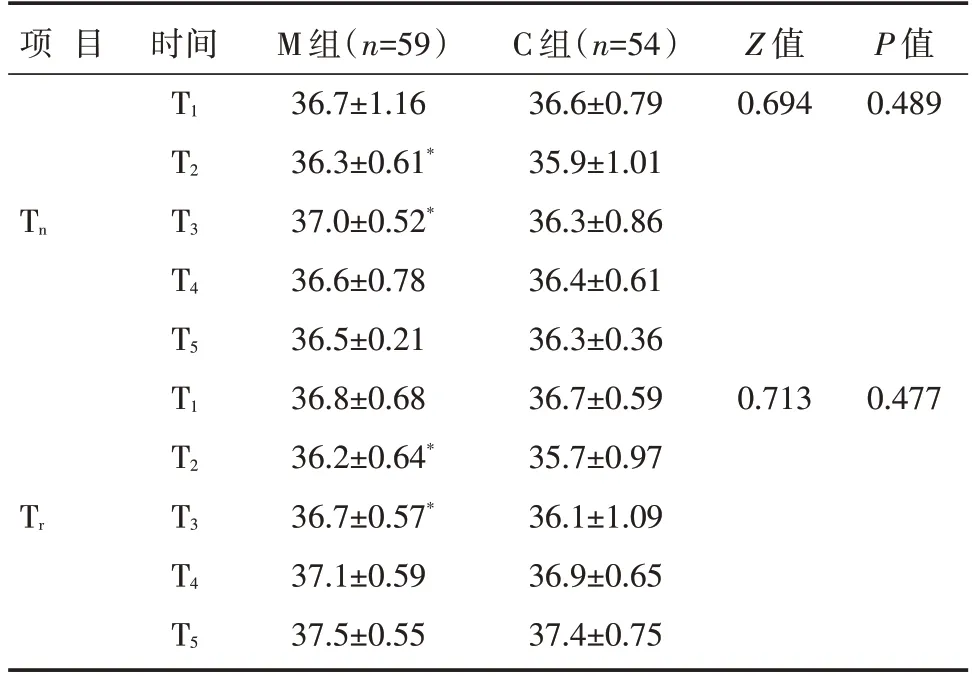
表3 两组患儿在不同时间点的Tn和Tr比较 [℃,]
注:与同期C 组比较,*P <0.05
2.4 两组患儿术后并发症比较
两组患儿术后皮肤均有不同程度发红,部位分布在枕后、骶尾、肘部、肛周、肩胛等,但均在早期自行消退,无一例有压疮等不良事件。术后发热情况M 组有6 例,C 组有5 例,11 例患者均在采用物理冰敷后体温降至正常,两组比较差异无统计学意义(P>0.05),见表4。
表4 两组患儿术后资料比较 [n(%),]
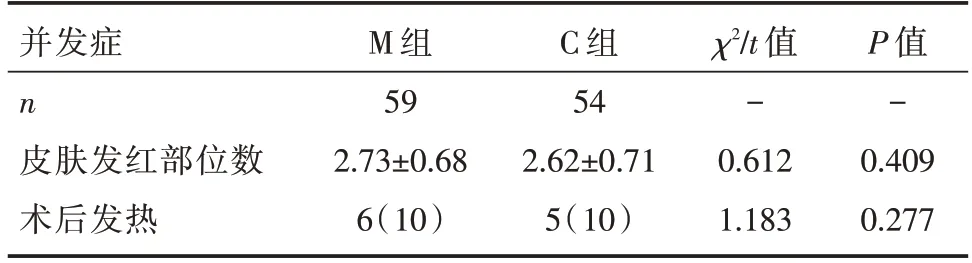
表4 两组患儿术后资料比较 [n(%),]
3 讨论
脱离CPB 进入MUF 阶段发生低体温事件属于围术期非计划性低体温[5],表2~3 数据表明,无论采用M 组抑或C 组的保温方法,MUF 进行的前5 min 患儿均不可避免地伴随着体温下降,与俞瑾等[2]报道一致,查阅Bair-Hugger 系统说明书发现该系统配备的微孔式充气毯恰巧需要2~5 min使得触点表面温度从23℃±2℃加热至37℃,提示临床工作者下一步是否可以前置复温时间。既往研究表明,MUF 过程中失去氧合器保温效应后维持低体质量患儿正常生理体温及氧耗水平一直是术中护理的难点[6]。Lydia 等[7]的随机对照试验报道使用Bair Hugger 系统持续设定厂家限定最高温度43℃,采用以5 min 为观察周期并加用可压缩的Model 530 充气毯可更好地维持患儿术中的核心温度,但在113 例患儿中仍有8 例发生术后发热事件(体温>38℃),因此笔者在研究中将观察周期缩至3 min 并采用43 ℃与38 ℃交替使用,发现尽管M组和C组患儿在MUF开始有着同等的温度基线,但当MUF 进行5 min 后(时点T2),无论是Tn还是Tr,M 组患儿均维持在36~37℃之间的生理体温,且显著高于C 组(T2-Tn,P=0.039,T2-Tr,P=0.04),此效应延续至MUF 结束(T3-Tn,P=0.048;T3-Tr,P=0.037),表明间断热疗更能有效维持患儿在MUF期间的生理体温。
由于婴儿本身具有相对体表面积大、血流丰富、皮肤薄弱、能量储备少以及体温调节中枢发育不成熟等生理特点,加之以往膀胱温监测尚未普及,Tr精度受外界影响较多,为了减少MUF 期间保温带来的皮肤发红、压疮、术后体温过高等并发症,期间多采用38℃充气式保温方法[8],本研究中M 组患儿采用间断热疗的方法在术后的皮肤发红或体温过高等发生率与C 组比较,差异无统计学意义(P>0.05),两组均无发生严重并发症,表明3 min 的间断43℃热风并未对患儿带来额外不良影响,且可保障了MUF 期间合适的生理温度。有学者认为采用双层布类中单翻折成风袋状以取代一次性使用的Long Model 530 气毯可取得相同效果且节省经济成本[9],但也有学者认为这对术野无菌条件的维护造成了不良影响[10],厂家在最新版的说明书上也予以说明不建议采用此法,并强调了系统进风口高效0.2 mm 空气过滤器的定期更换,布类微孔不均匀或者“非透气式”的覆盖引起热风循环容易引起烫伤且保温效应不及微孔式充气毯[11-12]。虽然两组患儿的用血量比较,差异无统计学意义(P>0.05),但M 组患儿的平均用血量小于C 组,这可能得益于优良的保温促进了患儿凝血功能和血流动力学的稳定。
综上所述,对低体质量婴儿而言,MUF 实施早期体温下降不可避免,需引起重视。护士熟悉掌握Bair-Hugger 升温系统的参数并及时更新使用方法,在MUF 期间灵活使用间断热疗可较好维持患儿体温,且不增加并发症,值得推广。
存在问题:本研究选取对象为简单先天性心脏病患儿,平均手术时间不超过3 h,研究结果不一定适合于复杂先天性心脏病患儿,需要进一步扩展研究对象。

