山柰酚对大鼠高原肺水肿的预防作用及机制研究
曹丽睿,查玉杰,何庆
(1.西南交通大学医学院,成都 610036;2.西南交通大学附属医院成都市第三人民医院,成都 610030)
高原肺水肿(high altitude pulmonary edema,HAPE)是一种严重的急性高原疾病,是快速上升至海拔超过2 500 m的高原环境时,机体对高原低压低氧环境不适应所引起的特发性疾病[1-2],HAPE起病迅速且死亡率高[3-4],对需要急进高原地区的人群危害极大,严重者可能会危及生命[4-5]。近年来随着川藏地区经济建设和高原作业的不断增多,需要从低海拔地区进入高原环境的人群数量逐年增加,急性高山病(acute mountain sickness,AMS)的发病率持续升高[6]。如何使平原地区人群进入高原地区后快速适应高原环境,提高生活质量和工作能力,减少HAPE的发病率,是目前急需解决的问题。尽管已有研究对AMS和HAPE的机制和防治措施进行探索,但可以用于临床且疗效和安全性都有一定保障的预防和治疗措施仍然比较缺乏,因此加强HAPE及其相关防治药物的研究,具有重大的临床意义。
山柰酚(kaempferol,KA)又名山柰酚-3,是一种黄酮醇类化合物,具有抗炎、抗氧化、抗病毒、抗肿瘤等多种生物活性[7-9]。有实验研究表明山柰酚能够清除氧自由基,抑制炎性细胞因子产生,保护组织免受缺氧损伤[10],而HAPE的产生与炎症、氧化应激增强密切相关[11-12],因此猜测山柰酚对HAPE也具有一定的防治作用,但目前对于山柰酚预防HAPE的作用及相关机制研究还未见报道。
本研究利用高原性疾病环境模拟系统模拟海拔6 000 m高原环境以建立HAPE大鼠模型,以乙酰唑胺作为对照组,通过预给药的方式探讨山柰酚是否通过缓解氧化应激和炎症作用对HAPE大鼠产生保护作用以及可能存在的相关机制,以期为山柰酚的临床运用和HAPE的防治提供新的思路和理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 6~7周龄的SPF级雄性Sprague-Dawley(SD)大鼠32只,体重180~220 g,购于成都达硕实验动物有限公司,实验单位动物使用许可证编号:SYXK(川)2019-189。饲养于SPF级动物饲养中心,室温保持20~24℃,相对湿度维持45~65%,人工光照昼夜12 h循环,大鼠自由进食、饮水。
1.1.2 实验试剂 山柰酚(原料药,纯度>98.5%,成都埃法生物科技有限公司,AB0715),乙酰唑胺(原料药,纯度≥98%,上海皓元生物医药科技有限公司,HY-B0782),Tweeen-80(Amresco,BDH7781-2),RNA提取液、5×蛋白还原型上样缓冲液、HRP标记山羊抗大鼠、HRP标记山羊抗兔、β-actin、GAPDH(武汉赛维尔生物科技有限公司,批号分别为G3013、G2013、GB23302、GB23303、GB12002、GB12003)。丙二醛(malondialdehyde,MDA)测试盒、一氧化氮合酶(nitric oxide synthase,NOS)测试盒、超氧化物歧化酶(superoxide dismutase,SOD)测试盒(南京建成生物工程研究所,批号分别为A003-1、A014-2-2、A001-1);白细胞介素-6(interleukin-6,IL-6)检测试剂盒、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)检测试剂盒(武汉优尔生科技股份有限公司,批号分别为L200807450、L200927099);BCA蛋白定量检测试剂盒、SDS-PAGE凝胶制备试剂盒(武汉赛维尔生物科技有限公司,批号分别为G2026、G2003)。
1.1.3 实验仪器 高原性疾病环境模拟系统(成都达硕生物科技有限公司,DS-F),酶标检测仪(BioTek仪器有限公司),电子天平(梅特勒-托利多仪器有限公司,ME203E/02),台式高速冷冻离心机(北京大龙,D3024R),病理切片机(上海徕卡仪器有限公司),全景切片扫描仪[(3DHISTECH(Hungary)],电子显微镜(日本Nikon电子公司,Eclipse Ci-L),荧光定量PCR仪(Bio-rad,CFX),超微量分光光度计(Thermo,NanoDrop2000)。
1.2 实验方法
1.2.1 动物造模及给药 将32只6~7周龄的健康SD大鼠随机分为4组,每组8只,分别为对照组(N组)、模型组(M组)、山柰酚给药组(KA组)、乙酰唑胺给药组(ACZ组)。对照组与模型组生理盐水灌胃,剂量为10 mL/kg;山柰酚给药组按10 mL/kg容量灌胃给予大鼠配制好的浓度为10μmol/mL的药液,乙酰唑胺组根据体表面积折算法,将临床常用的人体用药剂量折算为大鼠的用药剂量,按照44.66 mg/kg剂量给药。各实验组每日均灌胃给药1次,持续7 d,实验期间密切观察大鼠的一般状况。
第8天N组给药后仍照常饲养,其余3组在给药1 h后放入模拟海拔6 000 m低氧环境的低压氧舱内(动物进舱后以10 m/s速度减压上升,10 min达到海拔6 000 m,氧含量9.8%,之后维持氧含量在9.7%~9.9%范围内,舱内大气压维持在46.57~49.02 kPa范围内,湿度维持在49%~55%之间,室内温度由中央空调统一控制,白天保持22~24℃,夜晚16~18℃。N组大鼠在同一实验室常压常氧条件下饲养48 h,其余3组大鼠在低压低氧舱内饲养48 h,维持各组大鼠其他饲养条件相同。饲养结束后,按N组、M组、KA组、ACZ组的顺序依次取出各组大鼠,观察一般情况、称量体重并记录后,腹腔注射10%水合氯醛溶液将大鼠麻醉,无菌条件下解剖。取出整个肺组织,观察并记录肺组织的形态是否正常,以及各组大鼠肺组织的颜色和大小有无差异,将肺组织分解并妥善保存。
1.2.2 大鼠肺含水量测定 取大鼠左上肺组织,生理盐水冲洗2次,无菌水淋洗3次,用无菌滤纸吸干水分,置于锡箔纸上称重,得到的肺组织重量记录为湿重[W(g)],用锡箔纸包裹好肺组织后置于烘箱中,设置温度为80℃,连续烘干48 h,待肺组织重量恒定后称重,记录为干重[D(g)]。根据公式肺含水量(%)=(湿重-干重)/湿重×100%,计算得到肺含水量。
1.2.3 苏木素-伊红(HE)染色观察肺组织病理学变化 取大鼠左下肺组织,用0.9%的生理盐水冲洗后,采用4%多聚甲醛溶液固定48 h,等待固定充分后,依次将其进行蜡封、包埋、切片,随后将切片进行二甲苯脱蜡、清洗、苏木精和伊红染色、脱水、中性树脂封片,光镜下观察病理改变并拍照记录。
1.2.4 ELISA法检测炎症因子TNF-α和IL-6水平 取大鼠右上肺组织,用9倍匀浆介质(0.9%生理盐水)研磨,然后将研磨液3 000~4 000 r/min,离心10 min,取上清制备成10%的组织匀浆,用ELISA试剂盒测定样本中TNF-α和IL-6水平。所有操作按试剂盒规定步骤,根据ELISA标准曲线计算组织样本中的各个指标含量。
1.2.5 大鼠肺组织NOS、MDA、SOD变化检测 取大鼠右上肺组织,用9倍匀浆介质(0.9%生理盐水)研磨,然后将研磨液3 000~4 000 r/min,离心10 min,取上清制备成10%的组织匀浆,根据试剂盒操作要求测定肺组织和血浆中SOD活性、MDA浓度和NOS活性。
1.2.6 Western印迹检测磷脂酰肌醇3激酶(PI3K)、丝氨酸苏氨酸蛋白激酶1(Akt1)蛋白水平 从冰箱中取出大鼠右下肺组织,准确称量,研磨匀浆,冰上裂解30 min后,离心获得上清液,采用BCA试剂盒检测蛋白浓度,然后配制SDS-PAGE凝胶(10%分离胶、5%浓缩胶)、电泳、转膜,加入5%脱脂奶粉室温封闭1 h,分别加入Akt1、PI3K、内参蛋白β-actin一抗(1∶1 000),4℃孵育摇床过夜后洗涤后加入二抗(1∶3 000),室温孵育2 h,孵育结束后洗涤,ECL反应液充分反应,压片并显影定影,整理去色并分析目标带的光密度值。
1.2.7 RT-PCR检测PI3K、Akt1 mRNA水平 取右下肺组织,研磨后提取RNA,配制逆转录反应体系,混匀并离心,设定好逆转录程序。在NCBI数据库Nucleotide中查询大鼠PI3K(NM_053481.2)、Akt1(NM_033230.3)、GAPDH(NM_017008.4)的mRNA相应基因号,结合参考文献,委托武汉ServiceBio生物科技公司完成引物设计、合成与验证,见表1。采用两步法PCR扩增标准程序进行Real-Time PCR反应,使用实时荧光定量PCR仪分析结果,得出各个样本的Ct值,采用ΔΔCt法分析数据,得到目的基因的相对表达量。

表1 目的基因的引物序列Tab 1 Primer sequence of target genes
1.3 统计学处理本研究数据分析采用SPSS 25.0软件处理,作图工具采用Graphpad Prism 8.01。计量资料采用±s表示,采用Kolmogorov-Smirnov检验评估变量的正态性。多组间比较先行方差齐性检验(Levene检验),若方差齐用单因素方差分析(analysis of variance,ANOVA),采用LSD-t(le ast-significant-difference)检验进行组间差异的多重比较。以P<0.05作为差异具有统计学意义。
2 结果
2.1 大鼠肺含水量与N组比较M组、KA组、ACZ组的肺含水量都有所升高。与N组相比,M组的肺含水量显著上升(t=17.946,P<0.01)。与M组相比,KA组的肺含水量降低(t=11.949,P<0.01),ACZ组与M组相比,肺含水量也呈下降趋势(t=12.358,P<0.01)。
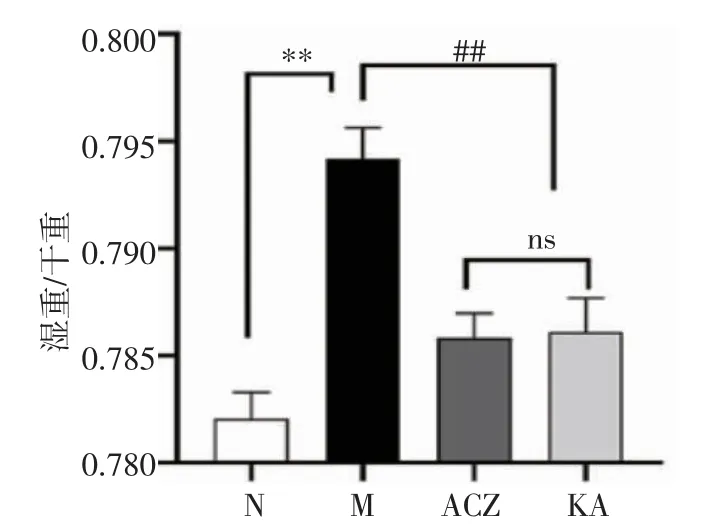
图1 大鼠肺组织含水量Fig 1 Water content in luny tissue of rats
2.2 大鼠肺组织HE染色结果如图2所示,N组大鼠肺组织结构正常,无明显病理改变,肺泡腔结构清晰完整,肺泡壁未见明显增厚,也未观察到炎性细胞浸润。与N组相比,M组存在明显的肺组织结构破坏,显微镜下可见肺泡塌陷水肿,肺泡壁增厚且厚度不均一,肺泡腔缩小,伴有大量淋巴细胞与中性粒细胞浸润,局部支气管管腔狭窄变形,管腔内可见大量炎性细胞浸润和嗜酸性黏液分泌。KA组和ACZ组可见肺泡壁增厚和肺泡腔缩小伴炎性细胞浸润,但与M组相比这种变化显著减轻。
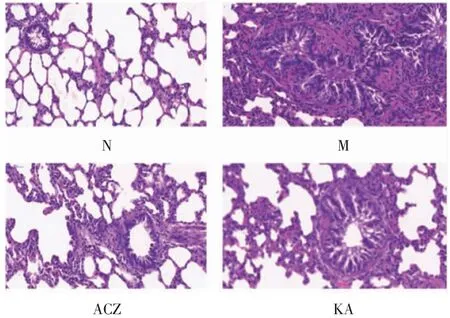
图2 大鼠肺组织HE染色(200×)Fig 2 HE staining of lung tissue in rats(200×)
2.3 大鼠肺组织炎症因子TNF-α和IL-6水平变化如图3所示,与N组比较,M组TNF-α、IL-6水平升高(t=14.753、7.666,均P<0.01)。与M组相比,KA组TNF-α和IL-6水平均明显下降(t=9.104、3.843,均P<0.01);与M组相比,ACZ组TNF-α、IL-6水平均下降(t=9.299、5.407,均P<0.01),且KA组与ACZ组之间并无明显差异(t=0.201、1.564,均P>0.05)。

图3 山柰酚干预后肺组织TNF-α、IL-6含量的变化Fig 3 The changes of TNF-αand IL-6 in the lung tissue of the rats
2.4 大鼠肺组织氧化应激指标变化如图4所示,与N组相比,M组大鼠肺组织SOD活性显著下降(t=9.663,P<0.01),MDA含量显著上升(t=13.906,P<0.01),NOS活性下降(t=4.681,P<0.01);与M组相比,KA组和ACZ组大鼠肺组织的SOD活性上升(t=3.715、4.417,均P<0.01),MDA含量减少(t=9.196、12.215,P<0.01),NOS活性上升(t=2.629、4.327,均P<0.05);且KA组与ACZ组比较,NOS和SOD均无明显差异(t=0.135、1.204,均P>0.05),KA组MDA高于ACZ组(t=3.016,P<0.05)。
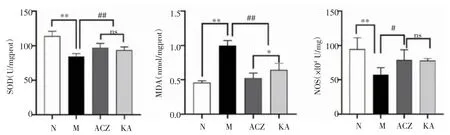
图4 大鼠肺组织氧化应激生化指标变化Fig 4 The changes of levels of oxidative stress in the lung tissue of the rats
2.5 山柰酚干预后大鼠肺组织中PI3K/Akt通路激活情况检测如图5、图6所示,与N组相比,M组PI3K和Akt1相对含量均显著升高(t=3.552、7.930,均P<0.05)。与M组比较,KA组PI3K表达降低(t=6.701,P<0.01),Akt1表达降低(t=4.010,P<0.05)。与M组相比,ACZ组PI3K蛋白和Akt1蛋白相对含量略有降低,但差异无统计学意义(t=1.092、1.414,均P>0.05)。
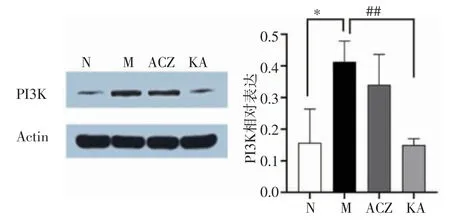
图5 大鼠肺组织PI3K蛋白表达含量的变化Fig 5 The changes of expression of PI3K protein in the lung tissue of the rats
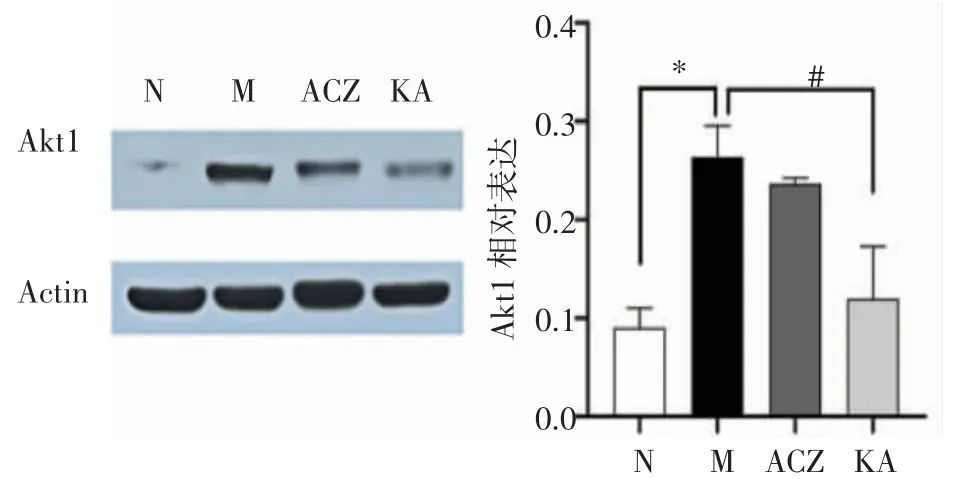
图6 大鼠肺组织Akt1蛋白表达含量的变化Fig 6 The changes of expression of Akt1 protein in the lung tissue of the rats
2.6 山柰酚干预后大鼠肺组织中PI3K、Akt1 mRNA表达水平测定 如图7所示。与N组相比,M组PI3K、Akt1 mRNA相对表达量明显升高(t=7.069、5.896,均P<0.01),与M组相比,KA组PI3K、Akt1 mRNA相对表达量降低(t=8.468、5.871,均P<0.01)。与M组相比,ACZ组PI3K、Akt1mRNA相对表达量降低(t=5.492、3.355,均P<0.05)。

图7 大鼠PI3K、Akt1 mRNA相对表达量Fig 7 Expression of PI3K and Akt1 mRNA in the lung tissue of the rats
3 讨论
近年来,HAPE作为高原疾病中发病率和死亡率都较高的一种疾病日渐受到关注,越来越多的研究说明HAPE的发生、发展与氧化应激失衡、炎症等相关[12]。山柰酚广泛存在于茶叶、花椰菜、洋葱、番茄、草莓和葡萄等可食用的水果和蔬菜以及银杏叶、山楂、连翘、山奈等传统医学常用的植物中,安全性较高,具有良好的抗氧化能力和抗炎能力,可以保护组织免受缺氧损伤,而且山柰酚纯品的提取技术已经相当成熟,具有良好的开发和应用前景。
氧化应激失衡是引起高原肺水肿的因素之一。SOD是生物体内重要的抗氧化酶,其含量高低可以间接反映机体内源性氧自由基清除能力,MDA是过氧化反应的代谢产物,可以反映脂质过氧化程度。急进高原低压低氧环境时,SOD的生成和活性受到炎症因子的抑制,又在清除氧自由基时大量消耗,因此SOD的含量和活性降低,而MDA的含量增加,血管内皮细胞和肺泡上皮细胞受损,通透性增加,导致肺水肿[13]。一氧化氮(NO)由NOS以L-精氨酸为底物生成,是重要的血管内皮舒张因子。研究表明,NO产生不足可以加重气道充血渗出,引起肺水肿[11]。本研究发现,使用高原性疾病环境模拟系统模拟高原环境可以使大鼠肺组织SOD活性增强,MDA含量增加,NOS活性降低,氧化和抗氧化平衡失调,引起组织损伤,这种变化与文献报道的HAPE的改变一致[14];而山柰酚和乙酰唑胺预给药处理可以使大鼠SOD活性降低,MDA含量减少,NOS活性升高,达到抑制氧化应激、改善肺水肿状态的目的。说明山柰酚具有良好的抗氧化活性,可以通过清除自由基减轻氧化损伤,实现对肺组织的保护作用。
TNF-α和IL-6作为重要的促炎因子,在诱导炎症细胞浸润和组织损伤中起到关键作用,其活性的高低可以提示机体的炎症损伤情况[15-16]。低压低氧诱导炎症细胞激活和炎症因子释放,炎症信号在细胞因子和炎症介质中迅速转导放大,氧自由基和蛋白酶被释放,肺泡毛细血管内皮细胞和肺泡上皮细胞损伤,造成微循环障碍,肺泡上皮通透性增强,富含蛋白质和纤维蛋白的液体渗出,进而引起肺水肿[17]。研究发现在LPS所诱导的肺损伤模型中,山柰酚可显著抑制促炎细胞因子TNF-α和IL-6产生,并能显著抑制丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和核因子κB活化信号转导通路[18]。本研究发现在低压低氧诱导的HAPE大鼠中,炎症因子TNF-α、IL-6大量释放,炎性反应增强,而山柰酚预给药使大鼠炎症因子TNF-α、IL-6的水平下降,炎性反应被抑制,肺水肿程度减轻,提示山柰酚可以抑制高原低压低氧引起的炎性反应,进而缓解HAPE。
PI3K是重要的信号转导分子,Akt是PI3K的下游效应物,PI3K/Akt信号通路是同时具有蛋白激酶活性和脂类激酶活性的细胞内信号转导通路,活化的Akt可以通过磷酸化下游效应因子调控细胞凋亡和细胞增殖,参与心血管疾病、肿瘤和代谢障碍疾病等多种疾病的病理过程[19]。近年来研究发现,PI3K/Akt信号通路也参与急性肺损伤的发病过程,包括炎症、肺水肿、气道重塑和肺气肿等[20]。
低氧可以刺激PI3K/Akt信号通路活化[21]。研究发现山柰酚通过抑制细胞外调节蛋白激酶/p38丝裂原活化蛋白激酶(ERK/p38 MAPK)、PI3K/Akt/哺乳动物雷帕霉素靶蛋白(PI3K/Akt/mTOR)信号通路的激活,抑制内皮细胞中低氧诱导因子-1α(hypoxia in ducible factor-1α,HIF-1α)、血管内皮细胞生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)激活,进而抑制内皮细胞血管形成[22-23]。PI3K/Akt信号通路在调控中性粒细胞活化和炎症因子释放的过程中起重要作用[24],并与氧化应激调控密切相关[25]。ZEA诱导产生氧化应激,山柰酚刺激核因子E2相关因子2/血红素氧合酶1(Nrf2/HO-1)级联和PI3K/Akt信号转导,减轻炎症和脂质过氧化作用,使抗氧化酶SOD、过氧化氢酶和谷胱甘肽还原酶的表达正常化[26]。右美托咪定可以抑制脂多糖(LPS)诱导的大鼠肺部炎症,抑制肺泡壁增厚和出血,减轻肺水肿,并减轻肺组织细胞凋亡和线粒体凋亡信号激活,这种保护作用与PI3K/Akt信号转导通路抑制密切相关[27]。金雀异黄酮可以与雌激素受体结合激活PI3K/Akt/eNOS信号通路,使NO的合成与分泌增加,舒张肺血管[28]。本研究发现,与N组相比,M组大鼠肺组织PI3K蛋白和mRNA均明显上升,Akt1蛋白和mRNA上升,提示低压低氧诱导PI3K/Akt信号通路激活,刺激炎症和氧化平衡失调,进而促进HAPE的发生、发展。与M组相比,KA组大鼠肺组织PI3K蛋白和mRNA减少,Akt1蛋白和mRNA下降,提示山柰酚可以抑制PI3K/AKT1信号通路,炎症和氧化应激减轻,HAPE程度得到改善。说明山柰酚和PI3K/Akt信号通路之间存在相关性,山柰酚可以抑制PI3K/Akt信号通路,抑制高原低压低氧引起的炎症和氧化应激,进而缓解HAPE。
综上所述,山柰酚可以通过抑制氧化应激和炎症预防急性高原肺水肿的发生,这种保护作用机制可能与PI3K/Akt信号通路抑制有关。

