妊娠期高血压疾病对胎龄28~34周早产儿外周静脉血细胞计数的影响
刘艳会 梁琨
(昆明医科大学第一附属医院儿科,云南昆明 650032)
妊娠期高血压疾病(hypertensive disorders of pregnancy,HDP)是妊娠期妇女所特有及常见的疾病,分类包括妊娠期高血压、子痫前期(轻度和重度子痫前期)、子痫、慢性高血压并发子痫前期及妊娠合并慢性高血压[1]。虽然HDP的确切病因尚不清楚,但已确定胎盘滋养细胞功能障碍在母体系统血管内皮功能紊乱中起重要作用,这些变化最终表现为胎盘缺氧和发育不全,导致胎儿宫内发育迟缓、早产、低出生体重、小于胎龄儿(small for gestational age,SGA)、脑损伤、吸入综合征、新生儿呼吸窘迫综合征、心力衰竭、死产[2-3]。此外,国内外临床病例研究发现,母亲合并HDP的新生儿可伴有血细胞计数的改变[4-6]。在临床上也常见到该类患儿生后第1天外周静脉血白细胞(white blood cell,WBC)计数、中性粒细胞绝对计数(absolute neutrophil count,ANC)及血小板(platelet,PLT)计数偏低,临床医生易与早期细菌感染所致血细胞计数改变相混淆,增加抗生素使用率。因此,本研究通过对我院新生儿重症监护病房(neonatal intensive care unit,NICU)收治的HDP母亲分娩的早产儿进行回顾性分析,分析母亲HDP对胎龄28~34周早产儿外周静脉血细胞计数的影响,为临床治疗提供参考。
1 资料与方法
1.1 一般资料
选取2020年1~12月昆明医科大学第一附属医院NICU收治的母亲合并HDP的胎龄28~34周早产儿为研究组,另选取同期收治的母亲无HDP的胎龄28~34周早产儿为对照组。本研究方法及内容均知情,家属已签署知情同意书。该研究通过我院研究生科研伦理初始审查。
入选标准:(1)入住NICU的胎龄28~34周早产儿;(2)母亲合并HDP:①妊娠期高血压亚组:妊娠首次出现血压≥140/90 mm Hg,产后12周血压水平恢复正常,且患者尿蛋白为阴性;②轻度子痫前期亚组:妊娠20周后出现血压≥140/90 mm Hg,尿蛋白定量≥300 mg/24 h或尿蛋白(+)。③重度子痫前期亚组:妊娠20周后出现血压≥160/110 mm Hg,尿蛋白定量≥2 g/24 h或尿蛋白(++),血肌酐水平>106μmol/L,PLT<100×109/L,视觉障碍、持续头痛[7]。对照组为母亲无HDP的胎龄28~34周早产儿。
研究组和对照组排除标准:(1)子痫,妊娠合并慢性高血压,慢性高血压并发子痫前期,母亲合并其他疾病特别是血小板减少性疾病如免疫性血小板减少、系统性红斑狼疮、抗磷脂综合征、再生障碍性贫血,妊娠合并其他血液系统疾病(如骨髓增生异常综合征等);(2)母亲病历资料不全;(3)早产儿病历资料不全;(4)早产儿合并宫内感染或早期细菌感染;(5)新生儿患自身免疫性血小板减少症、溶血性疾病。符合上述入选标准和排除标准者共454例,其中研究组227例,对照组227例,两组胎龄、出生体重、性别、孕母年龄、受孕方式等一般资料差异无统计学意义(P>0.05),见表1。
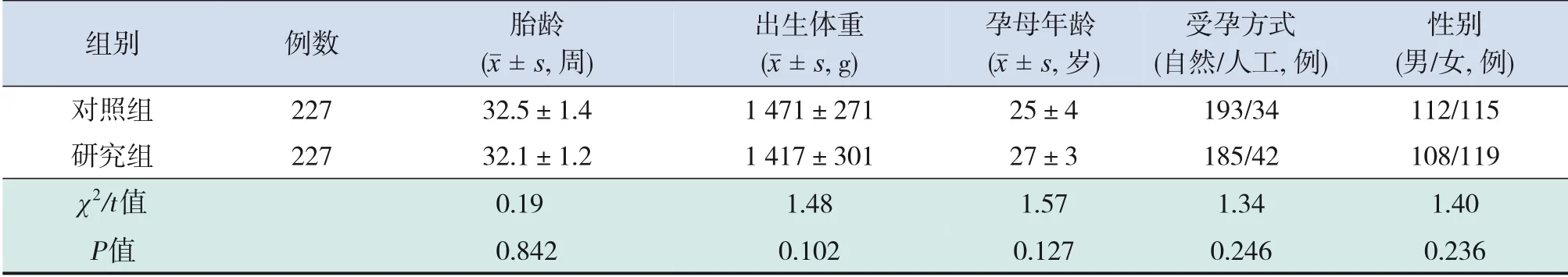
表1 两组早产儿一般资料比较
1.2 观察指标
收集研究组和对照组生后第1天外周静脉血细胞计数,包括WBC计数、血红蛋白(hemoglobin,Hb)水平、ANC和PLT计数等。其中白细胞减少症定义为WBC<4×109/L;红细胞增多症定义为:Hb≥220 g/L,红细胞压积≥0.65;中性粒细胞减少症定义为ANC<1.5×109/L;血小板减少症定义为PLT<150×109/L[8]。根据母亲妊娠期血压分为妊娠期高血压亚组(75例)、轻度子痫前期亚组(81例)、重度子痫前期亚组(71例);根据早产儿出生体重分为SGA亚组(113例)及适于胎龄儿(appropriate for gestational age,AGA)亚组(114例)。
1.3 统计学分析
应用SPSS 22.0软件进行统计学分析。计数资料采用例数和百分率(%)表示,采用χ2检验;正态分布计量资料采用均数±标准差(±s)表示,两组间比较采用两样本t检验,多组间比较采用方差分析,组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 研究组及对照组外周静脉血细胞计数比较
研究组患儿生后第1天外周静脉血WBC计数、ANC及PLT计数均低于对照组,差异具有统计学意义(P<0.05)。研究组中白细胞减少症、中性粒细胞减少症发生率均高于对照组,差异具有统计学意义(P<0.05)。两组间Hb水平,以及红细胞增多症、血小板减少症的发生率差异无统计学意义(P>0.05)。见表2。

表2 两组早产儿外周静脉血细胞计数比较
2.2 HDP分期对胎龄28~34周早产儿外周静脉血细胞计数的影响
妊娠期高血压亚组、轻度子痫前期亚组及重度子痫前期亚组WBC计数、ANC、PLT计数差异有统计学意义(P<0.05)。两两比较显示,轻度子痫前期亚组、重度子痫前期亚组WBC计数、ANC、PLT计数均低于妊娠期高血压亚组(P<0.05),但轻度子痫前期亚组与重度子痫前期亚组WBC计数、ANC、PLT计数差异无统计学意义(P>0.05)。3个亚组间Hb水平差异无统计学意义(P>0.05)。见表3。
表3 HDP分期对外周静脉血细胞计数的影响 (±s)
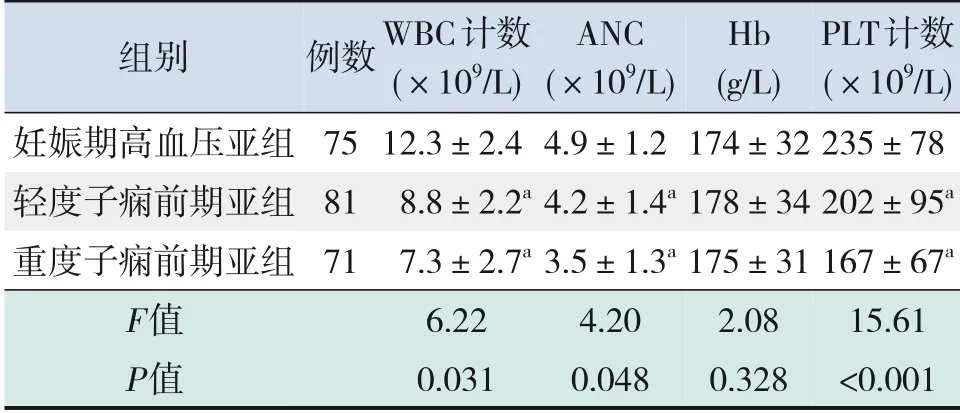
表3 HDP分期对外周静脉血细胞计数的影响 (±s)
注:[WBC]白细胞;[ANC]中性粒细胞绝对计数;[Hb]血红蛋白;[PLT]血小板。a示与妊娠期高血压亚组比较,P<0.05。
PLT计数(×109/L)235±78 202±95a 167±67a 15.61<0.001组别妊娠期高血压亚组轻度子痫前期亚组重度子痫前期亚组F值P值例数75 81 71 WBC计数(×109/L)12.3±2.4 8.8±2.2a 7.3±2.7a 6.22 0.031 ANC(×109/L)4.9±1.2 4.2±1.4a 3.5±1.3a 4.20 0.048 Hb(g/L)174±32 178±34 175±31 2.08 0.328
2.3 不同出生体重对胎龄28~34周早产儿外周静脉血细胞计数的影响
SGA亚组WBC计数、ANC、PLT计数均低于AGA亚组(P<0.05),两亚组Hb水平差异无统计学意义(P>0.05),见表4。
表4 不同出生体重对外周静脉血细胞计数的影响 (±s)
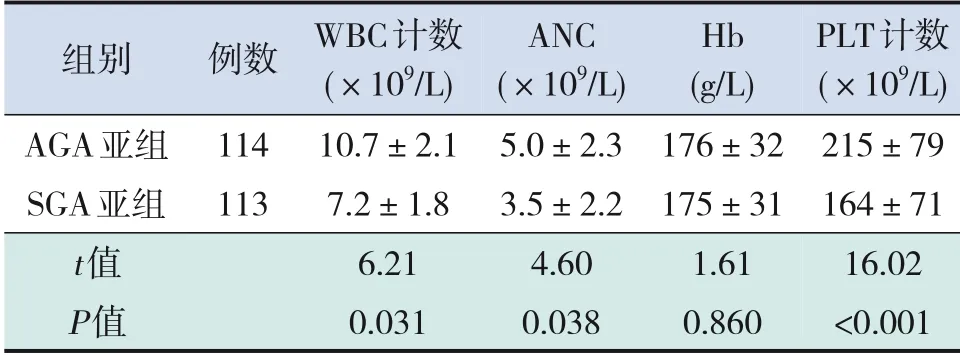
表4 不同出生体重对外周静脉血细胞计数的影响 (±s)
注:[WBC]白细胞;[ANC]中性粒细胞绝对计数;[Hb]血红蛋白;[PLT]血小板;[SGA]小于胎龄儿;[AGA]适于胎龄儿。
组别AGA亚组SGA亚组t值P值例数114 113 PLT计数(×109/L)215±79 164±71 16.02<0.001 WBC计数(×109/L)10.7±2.1 7.2±1.8 6.21 0.031 ANC(×109/L)5.0±2.3 3.5±2.2 4.60 0.038 Hb(g/L)176±32 175±31 1.61 0.860
3 讨论
目前研究表明HDP导致了全身性促炎状态,母体HDP通过改变激素和细胞信号模式来重塑胎儿的宫内环境,呈促炎状态,并可破坏胎儿的造血功能[9]。国内外临床病例研究发现,母亲合并HDP的新生儿可伴有外周血细胞计数的改变[4-6]。本研究中,同样发现母亲合并HDP的早产儿WBC水平、ANC、PLT计数较母亲无合并HDP的早产儿明显降低,并且这一改变在母亲子痫前期及SGA中更为显著。Aneman等[10]、Gregory等[11]研究也得到相似结论,认为子痫前期患者胎盘滋养细胞功能障碍和母体系统血管内皮功能紊乱更严重,胎盘更易发生缺氧和功能不全,SGA发生率增加,因此,对胎儿免疫功能的影响更显著,对胎儿的造血功能破坏也更为明显。
目前关于母亲合并HDP的新生儿发生中性粒细胞减少的机制还在研究探索中。国外有研究发现,HDP特别是子痫前期中发生的子宫胎盘功能不全可以抑制孕中期胎儿骨髓生成,并可抑制粒细胞-巨噬细胞祖细胞的储备[12]。有研究还表明,在妊娠合并子痫前期的新生儿或其母亲的血清中,与Fas-Fas配体凋亡途径相关的蛋白增加,导致了中性粒细胞的破坏增加[13]。另外,新生儿中性粒细胞减少与败血症之间的相关性仍存在争议[14],Procianoy等[15]发现,即使子痫前期本身并不增加新生儿败血症的风险,但早产儿死亡率与中性粒细胞减少相关。但也有研究报道,子痫可增加晚发型败血症的发生[16],并且中性粒细胞减少的新生儿发展为慢性肺部炎性疾病的趋势更明显[17]。本研究未对母亲合并HDP的早产儿晚发型败血症的发生率进行分析,母亲合并HDP所致中性粒细胞减少能否增加晚发型败血症的风险需更多研究进一步证实。
研究发现血小板减少通常发生在生后第2~3天,在大多数情况下,这种改变会在10 d之内自行恢复[12]。血小板减少症的可能原因是子痫前期及其导致的胎儿缺氧对巨核细胞生成和血小板产生抑制作用。研究表明,巨核细胞形成受损,由细胞因子、血小板生成素和白细胞介素6介导的血小板活化增加等综合作用可能为其发生机制[18]。由血小板生成抑制剂介导的血小板生成减少也被认为是新生儿血小板减少症的原因之一,由于缺氧导致胎儿暴露于高促红细胞生成素水平,也可能通过抑制巨核细胞系而导致血小板减少[19]。
目前一些研究显示母亲合并HDP的新生儿可能患有红细胞增多症。继发于子痫前期的慢性胎儿缺氧会刺激促红细胞生成素产生,从而导致红细胞量增加[18-19]。本研究中母亲合并HDP的早产儿中红细胞增多症发生率及Hb水平与对照组比较差异无统计学意义,可能原因与样本数较少,以及研究人群为中海拔地区相关。有研究已证实高海拔地区由于氧浓度低,可导致人群的红细胞相关参数较高[20]。因此,可扩大样本量及改变研究人群分布进一步证实。本研究的局限性包括回顾性设计和未动态观察外周血细胞计数的改变,未进行早产儿并发症相关性分析。在今后的研究中,可进一步研究探讨母亲合并HDP对不同日龄早产儿外周血细胞计数的影响,探讨这些改变对早产儿并发症(包括晚发型败血症等)的影响。
综上所述,本研究表明母亲合并HDP对胎龄28~34周早产儿的外周血细胞计数有着显著影响,这一影响在母亲子痫前期及SGA中更为明显,故临床上,需要把母亲合并HDP的早产儿外周血细胞的改变与新生儿早期细菌感染所致的血细胞改变相区别,以合理使用抗生素。对于这一改变是否增加新生儿晚发型败血症等疾病的发生和病死率仍需进一步研究。
利益冲突声明:所有作者声明不存在利益冲突关系。

