产时抗菌药物预防治疗B族链球菌感染对早发型新生儿败血症发生率及病原菌分布的影响
彭周杰 包蕾
(重庆医科大学附属儿童医院新生儿科/国家儿童健康与疾病临床医学研究中心/儿童发育疾病研究教育部重点实验室,重庆 400014)
B族链球菌(group Bstreptococcus,GBS)是一种β溶血性革兰阳性链球菌,大部分寄生于人类下消化道及泌尿生殖道,是导致早发型新生儿败血症(early-onset neonatal sepsis,EONS)的主要病原菌之一[1]。美国疾控中心于1996年制定了《围产期GBS感染筛查及防治指南》,建议对所有妊娠35~37周(或分娩前1~5周)孕妇的直肠、阴道进行GBS筛查,并对GBS筛查阳性的孕妇给予产时抗菌药物预防(intrapartum antibiotic prophy-laxis,IAP)治疗[2],这使得美国EONS发生率明显下降[3]。近年来,我国也逐渐开始重视GBS感染的筛查与预防。在IAP中,青霉素是被推荐的首选抗菌药物[4],但近年来有报道发现以氨苄青霉素耐药性大肠埃希菌(ampicillin-resistantEscherichia coli,AR-E.coli)为病原菌的EONS病例[5],这引起了学者们对IAP使用的反思。为了探索IAP的使用是否会导致产生由耐药病原菌引发的EONS病例,本研究对近5年重庆大学附属三峡医院GBS筛查阳性孕妇经IAP后EONS发生率及病原菌分布进行回顾性分析,评估IAP疗效,为IAP应用方案提供理论依据。
1 资料与方法
1.1 研究对象
2015年1月至2020年12月于重庆大学附属三峡医院产科分娩的孕产妇共6 190例行GBS筛查,筛查结果阳性共494例,定植率为7.98%。回顾性收集494例GBS筛查阳性的孕产妇及其所分娩的526例新生儿的临床资料。纳入标准如下:(1)孕产妇孕晚期(孕35~37周)阴道分泌物或肛拭子GBS培养结果阳性;(2)孕产妇及新生儿临床资料完整;(3)孕产妇未患有胎膜早破、绒毛膜羊膜炎、羊水污染、身体其他部位感染等可能需要联合使用多种抗生素,或改变抗菌治疗方案,或影响用药同质化的疾病;(4)孕产妇未患有意识障碍及精神疾病;(5)孕产妇未患有其他严重妊娠期并发症。
根据孕产妇是否接受IAP治疗将新生儿分为IAP组(304例)和对照组(222例),对两组新生儿以下指标进行比较:(1)基本情况:产妇年龄、是否初产、分娩方式(顺产/剖宫产)及新生儿胎龄、出生体重;(2)非特异炎症反应指标:白细胞计数、C反应蛋白(C reactive protein,CRP);(3)异常临床表现情况,包括黄疸、呕吐、呼吸困难、发热、抽搐;(4)EONS发生率;(5)EONS患儿血培养病原菌分布;(6)感染大肠埃希菌的EONS患儿血液中AR-E.coli病原菌分布情况。本研究经重庆大学附属三峡医院伦理委员会审批通过[2020年科研第(128)号]。
1.2 诊断标准
出生后3 d内即患败血症被视为EONS[6],诊断标准如下:(1)有异常临床表现(发热、反应差、呕吐、腹胀、呼吸困难、呼吸暂停、抽搐、面色苍白、四肢冷、出血、产后24 h内出现黄疸)的前提下满足下列条件的任1项:①血液非特异性检查(白细胞计数、PCT、CRP、血小板)两项及以上阳性;②脑脊液检查异常。(2)脑脊液培养或血培养阳性。
1.3 临床处理
IAP组孕产妇接受IAP治疗:开始给药至胎儿娩出间隔超过4 h,首选青霉素钠抗菌治疗。给药方法如下:皮试阴性者,给予青霉素钠首剂量480万U静脉滴注,之后青霉素钠240万U,每4 h 1次静脉滴注,直至分娩结束。对于青霉素过敏的孕妇,依据药敏试验结果,依次试用如下药物:克林霉素、红霉素。最终各抗生素使用人数及占比如下:青霉素钠(279/304、91.8%)、克林霉素(19/304,6.2%)、红霉素(6/304、2.0%)。
对照组孕产妇未使用任何抗生素。
1.4 血标本采集及检测
在使用抗菌药物之前采集样本,按照无菌原则于患儿两个不同部位分别抽取3~5 mL血液存储于专用血培养瓶中,并于60 min内送检。分别于新生儿出生后6 h、24 h和72 h三个时间点采集静脉血2 mL,检测CRP及血常规。使用BACTEC 9120血培养仪(BD公司,美国)对样本进行菌种培养。使用MicroScan Walkaway-96 Plus及VITEK 2 Compact全自动微生物鉴定及药敏系统(梅里埃公司,法国),依据生产厂家提供技术操作指南进行细菌鉴定/药敏分析。
1.5 统计学分析
使用SPSS 20.0统计软件对数据进行统计学分析。符合正态分布计量资料用均数±标准差(±s)表示,两组间比较采用两样本t检验。不符合正态分布计量资料采用中位数(范围)表示,两组间比较采用秩和检验。计数资料采用百分率(%)表示,两组间比较采用卡方检验。P<0.05为差异有统计学意义。
2 结果
2.1 基本情况
预防性抗生素应用前,IAP组和对照组的产妇年龄、剖宫产率、初产率及患儿胎龄、性别、出生体重等基线资料比较差异均无统计学意义,具有可比性(P>0.05),见表1。
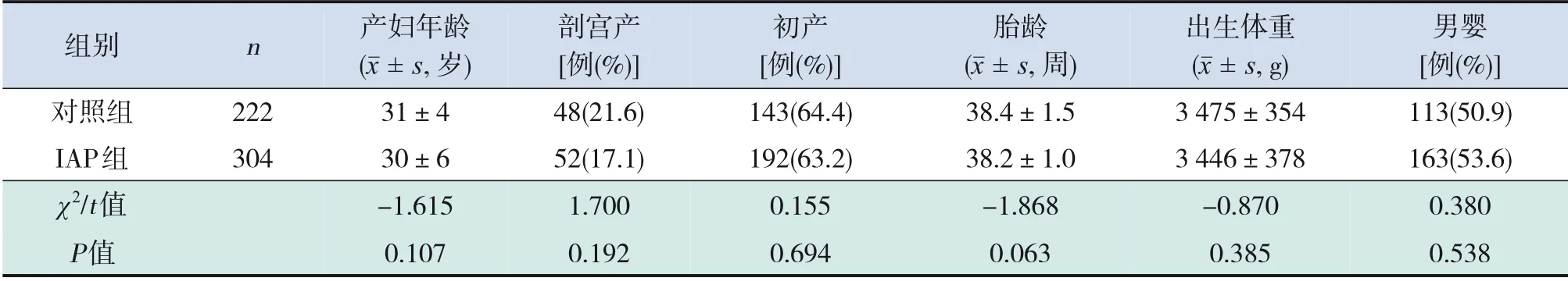
表1 预防性抗生素应用前两组患儿基本情况比较
2.2 血液非特异性检查结果比较
IAP组和对照组患儿出生后各时间点白细胞计数比较差异无统计学意义(P>0.05)。两组患儿出生后6 h CRP水平比较差异无统计学意义(P>0.05),对照组患儿出生后24 h及72 h CRP水平显著高于IAP组(P<0.001),见表2。
表2 两组患儿不同时间点白细胞计数及CRP结果的比较 (±s)

表2 两组患儿不同时间点白细胞计数及CRP结果的比较 (±s)
注:[CRP]C反应蛋白。
组别对照组IAP组t值P值n 白细胞计数(×109/L)CRP(mg/L)6 h 11.3±4.4 11.5±3.5 0.343 0.732 24 h 19.0±5.5 18.2±4.6-1.786 0.075 222 304 72 h 6.5±2.9 2.2±1.0-21.684<0.001 72 h 11.8±3.8 12.3±2.3 1.815 0.070 6 h 1.4±1.2 1.5±0.6 1.748 0.081 24 h 8.3±3.2 4.8±2.2-14.079<0.001
2.3 两组异常临床表现及病原菌检出情况
IAP组患儿出生后出现异常临床表现14例,包括黄疸3例、呕吐1例、呼吸困难4例、发热3例、抽搐3例;对照组患儿出生后出现异常临床表现32例,包括黄疸7例、呕吐4例、呼吸困难8例、发热9例、抽搐4例;IAP组异常临床表现发生率(14/304,4.6%)低于对照组(32/222,14.4%)(χ2=15.470,P<0.001)。入组526例患儿共确诊EONS 23例(4.4%),其中IAP组确诊EONS 8例,EONS发生率(8/304,2.6%)显著低于对照组(15/222,6.8%)(χ2=5.222,P=0.022)。IAP组EONS患儿血培养检测病原菌种类最多的为大肠埃希菌(7/304,2.3%),而对照组EONS患儿血培养检测病原菌种类最多的为GBS(7/222,3.2%),其次为大肠埃希菌(6/222,2.7%);所有23例EONS患儿血培养检测病原菌种类最多为大肠埃希菌(13/526,2.5%)。通过药敏试验在IAP组检测出AR-E.coli6株(6/7,86%),而在对照组只检测出1株(1/6,17%),两组之间的检出率比较差异有统计学意义(χ2=6.198,P=0.029)。
3 讨论
GBS正常定植于人类泌尿生殖道及下消化道,是一种条件致病菌[7]。由于地域、经济条件、检测孕周、检测方法等的差异,GBS的定植率报道不一。发达国家孕产妇GBS定植率约为10%~30%[8],我国不同省市报道GBS定植率波动于3.7%~14.27%[9]。本研究中,GBS定植率为7.98%,与我国多数省市报道一致。
孕妇分娩时阴道GBS定植是造成新生儿GBS感染的重要因素[10]。1996年及2010年美国疾病控制和预防中心联合美国妇产科医师协会等专业协会发布的指南《围产期B族链球菌病预防指南》推荐对所有妊娠35~37周(或分娩前1~5周)孕妇的直肠、阴道进行GBS筛查,2019年重新修订,2020年再次更新,建议对所有36~37+6周孕妇进行GBS筛查,将筛查时限进行了延后,并对结果阳性者给予IAP治疗[11],使得美国EONS发生率及病死率均明显下降。这充分表明了GBS筛查的重要性及必要性。近年来,我国已逐渐认识到了GBS感染对新生儿的危害,产前常规筛查GBS及IAP治疗已逐渐在全国推广,但目前还未达到普及,仍有一部分孕产妇因医院条件、自身经济状况及主观意愿等原因未行筛查及IAP治疗。我们认为加快推广产前常规筛查GBS及IAP治疗已刻不容缓。
新生儿感染的主要途径是垂直传播,如果存在产程延长或胎膜早破等因素则感染风险会进一步增加,所以这部分新生儿多为分娩后3 d内患病,为早发性感染[12]。还有部分新生儿因为水平传播感染GBS,常见于母乳喂养传播、医院感染或社区感染,为晚发性感染[13]。在本研究中23例败血症患儿均为3 d内发病,为早发性感染。在本研究中,IAP组患儿出生后出现异常临床表现的比例显著低于对照组。IAP组EONS发生率显著低于对照组。由此可以看出对GBS筛查结果阳性的孕产妇行IAP治疗,可以达到降低EONS发生率的目的。
从本研究的结果中可以得知,IAP组和对照组患儿出生后各时间点白细胞计数比较差异无统计学意义,这反映出白细胞计数在GBS筛查结果阳性孕产妇所生高危新生儿EONS筛查指标中敏感性及特异性均较低,不建议单独使用监测。两组患儿出生后6 h CRP水平比较差异无统计学意义,对照组患儿出生后24 h及72 h CRP水平显著高于IAP组。有研究显示,EONS发生的时间多为分娩后24~72 h,CRP值多在分娩后4~6 h开始升高,于24 h达到峰值[14],这均与本研究结果的趋势相符,结合已报道的研究和本研究可以看出,在GBS筛查阳性孕产妇所生的高危新生儿中,CRP可以作为提示EONS的监测指标。
随着GBS筛查和IAP治疗的推广,新生儿GBS感染的EONS的发生率降低了,但革兰阴性菌感染的EONS的发生率却升高了,其中以AR-E.coli所致的EONS病例最为显著[5]。2010年,Kuhn等[15]报道EONS总发生率为0.119%,且胎膜早破的孕妇产前预防性使用抗生素后AR-E.coli所致的EONS发生率升高,可能与胎膜早破的情况下,预防性使用抗生素的时间延长有关。本研究发现产前有GBS感染且预防性使用抗生素的孕妇所分娩的新生儿中仅有8例(2.6%)患儿发生EONS,但其中有6例(86%)EONS患儿的病原菌是AR-E.coli,显著高于对照组(17%),这可能是由于IAP的暴露使革兰阴性菌处于优势地位及肠道微生物菌群的失调导致。我们可以得到以下启示:(1)本研究结果与2010年报道[15]的不同,可能是因为数年来病原菌的菌谱发生了变化,AR-E.coli在大肠埃希菌的分布中占比在增加,我们应该积极检测、及时诊断,以便个性化治疗;(2)在Kuhn等[15]学者的报道中,对于胎膜早破和GBS感染孕产妇进行产前抗生素预防治疗对AR-E.coli所致的EONS发生率的影响不同,很可能归因于用药时间及剂量。对于胎膜早破的用药需至少8 d的疗程,而IAP只需大于4 h。由此我们认为,应该在后续的研究中重点研究IAP的用药时间及剂量,对现行方案进行改良,尽量达到精准化、个性化用药,尽量降低耐药菌的出现率。
综上所述,对GBS筛查结果阳性的孕产妇行IAP治疗,可以达到降低EONS发生率的目的,但IAP组AR-E.coli感染率显著高于对照组,应该引起重视。在临床工作中,应该强化对EONS患儿血培养结果的监测,尽早诊断,根据药敏试验结果及时调整诊疗计划。
利益冲突声明:所有作者声明不存在利益冲突关系。

