新生儿低血糖临床规范管理专家共识(2021)
中华医学会儿科学分会新生儿学组
新生儿经历从宫内到宫外的环境改变,血糖水平(blood glucose level,BGL)容易产生较大波动。脐带结扎后新生儿不再接受母体血糖的供应,生后1~4 h内因暂时性的自身胰岛素水平偏高,以及酮体对胰高血糖素和肾上腺素的反应受抑制,若未及时建立有效喂养,容易发生过渡期低血糖,常在生后1 h达到过渡期最低血糖水平[1]。一项调查问卷显示,英国的135个国家级医疗保健卫生机构中,88.1%的医疗机构将BGL<2.6 mmol/L作为低血糖事件的临床处理阈值[2]。新生儿人群中,存在低血糖高危因素者达30%[3];有高危因素的新生儿中,低血糖事件发生率高达51%[4]。持续的低血糖水平及血糖过大波动均可导致永久性脑损伤,而过于积极地将过渡期血糖偏低者收入院,则会显著增加新生儿入院率,加重家庭、社会及国家的经济负担。目前,多个国家、专业组织或协会已制定了新生儿低血糖临床管理指南、规范或推荐,而我国尚无新生儿低血糖相关指南或专家共识。我国不同医疗机构多参考不同国家的指南,或参照《实用新生儿学》[5]的低血糖相关内容进行新生儿低血糖临床管理。本共识目标人群是胎龄35周及以上低血糖高危新生儿,目的是规范低血糖的预防、监测、干预等临床管理。既要避免过度的医疗干预,又需防止发生低血糖脑损伤。为此,中华医学会儿科学分会新生儿学组成立了新生儿低血糖临床管理规范专家组,广泛征求各专家的意见和建议,以国内外的循证医学证据为基础,结合我国国情制定了本共识。本共识检索的数据库包括:PubMed、The Cochrane Library、Embase、中国生物数据库、中国生物医学文献数据库、中国知网、万方数据库。指南相关资源包括:中华医学知识库、澳大利亚临床实践指南平台、加拿大医学临床实践指南信息库等。文献检索截止时间为2021年9月30日。
本共识文献证据水平和推荐意见采用分级的评估、制定及评价(Grading of Recommendations Assessment,Development and Evaluation,GRADE)方法,对国内外相关文献根据证据质量和推荐意见的推荐强度进行分级(表1)。制定本共识前参考了2016年丁泓帆等[6]解读的WHO指南制定的相关原则和方法。本共识已在国际实践指南注册平台(http://guidelines-registry.cn/)注册(注册号:IPGRP-2020CN191)。
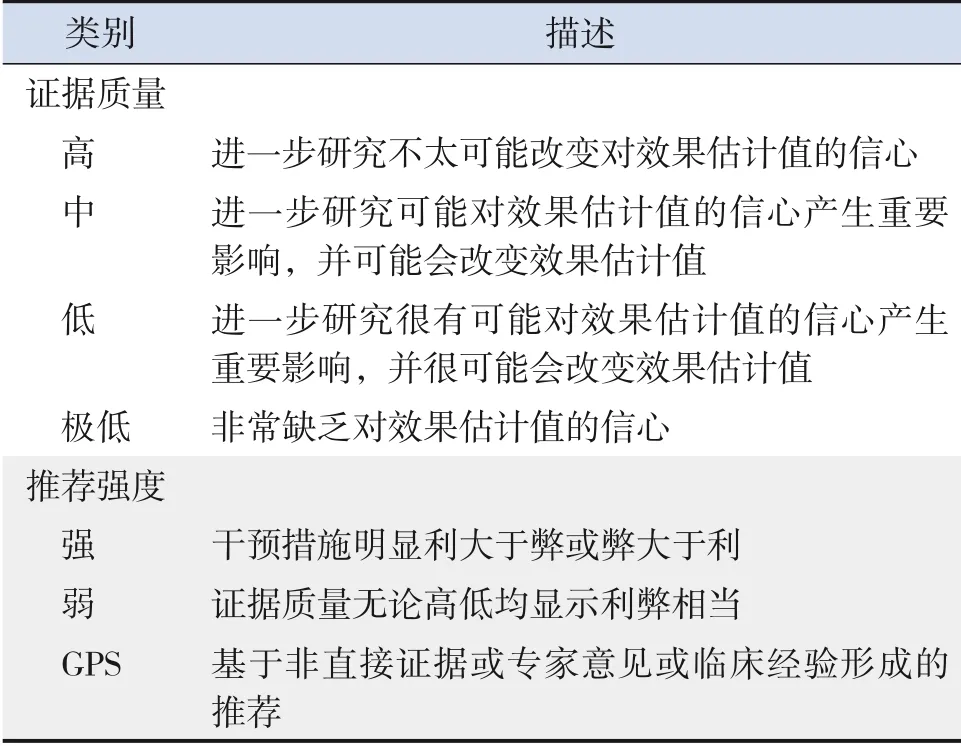
表1 GRADE证据质量与推荐强度分级[7]
1 新生儿低血糖的高危因素、临床表现及基本定义
1.1 高危因素
胎儿BGL是母体BGL的70%~80%,为适应快速生长和储存能量,胎儿在妊娠晚期对葡萄糖的需求大幅增长,所以早产儿、低出生体重儿因晚期储备不足,容易发生低血糖[1]。所有引起胰岛素分泌增多、反调节激素(生长激素、儿茶酚胺类、糖皮质激素等)分泌减少、自身储能不足的相关因素均可导致新生儿低血糖。新生儿低血糖的高危因素包括母体因素和新生儿因素[8-12]。母体因素包括:(1)妊娠糖尿病(gestational diabetes mellitus,GDM);(2)产前24 h内尤其是产时使用以下药物:β受体阻滞剂、地塞米松、磺脲类降糖药、抗抑郁药,静脉大量输注葡萄糖[8-9];(3)母亲有代谢性疾病或内分泌疾病家族史。新生儿因素包括:小于胎龄儿(small for gestational age,SGA)、大 于 胎 龄 儿(large for gestational age,LGA)、宫内生长迟缓(intrauterine growth retardation,IUGR)、胎 龄<37周、出 生 体 重>4 000 g或<2 500 g、低体温、喂养不足、产时缺氧、红细胞增多症、溶血性贫血等。其中最常见且最主要的4种新生儿低血糖高危因素为GDM、早产儿、SGA、LGA,非GDM的LGA需警惕有无内分泌系统疾病[10-11]。
1.2 临床表现
无症状性新生儿低血糖的发生率是症状性新生儿低血糖的10~20倍,相同BGL的低血糖不同个体的临床表现差异也可能较大。新生儿低血糖常为非特异性的临床表现,主要包括交感神经兴奋性增高所致的症状和体征,如出汗、脸色苍白、激惹、饥饿、肢体抖动(震颤)、呼吸不规则、心动过速和呕吐等;以及中枢神经系统葡萄糖缺乏所致的症状和体征,如呼吸暂停、喂养困难、肌张力低下、哭声弱或高尖、惊厥、意识水平变化(如淡漠、嗜睡、昏迷)等。交感神经兴奋性增高的临床表现出现更早,而出现中枢神经系统葡萄糖缺乏症状时的BGL会更低。其他低血糖的非特异性临床表现还包括发绀、窒息、低体温、心动过缓、气促等,易与新生儿其他疾病的临床表现混淆,需根据临床经验及BGL综合判定[5]。
1.3 新生儿低血糖相关定义
过渡期低血糖、反复低血糖、持续低血糖、严重低血糖、症状性低血糖及临床处理阈值的定义见表2。

表2 新生儿低血糖相关定义[9,12]
2 低血糖高危儿生后的早期预防
推荐意见1:生后尽早且不少于1 h母婴皮肤接触、早吸吮、早开奶(高质量证据,强推荐)。
推荐意见2:鼓励母乳喂养,母乳不足时可补充配方奶,不推荐糖水喂养(中等质量证据,强推荐)。
推荐意见3:生后第1天喂养间隔时间≤3 h[高质量临床实践声明(good practice statement,GPS)]。
母婴皮肤接触指将裸露新生儿躺在母亲无遮挡的胸部上,通过皮肤-神经系统刺激以提高并稳定新生儿BGL,兼具保暖、镇静、促进心肺系统稳定的功能。2016年Moore等[13]包含3个随机对照试验(randomized controlled trail,RCT)的系统综述(n=144)中,生后尽早(生后10 min内)长时间(持续时间>1 h)进行母婴皮肤接触组较生后未进行母婴皮肤接触组在生后75~180 min内的平均BGL高0.6 mmol/L(2.8 mmol/L vs 3.4 mmol/L),故推荐生后尽早母婴皮肤接触以稳定新生儿BGL,预防低血糖事件的发生。尽早吮吸可促进乳汁分泌,母乳量虽然较少,但有效的吮吸可通过神经-内分泌系统刺激儿茶酚胺类激素分泌,从而升高血糖。同时也可通过哺乳时的吮吸力度及节律性评估新生儿的健康状态。
母乳喂养可以升高血糖亦可刺激酮体分泌,有助于血糖稳定。美国母乳喂养医学会(Academy of Breastfeeding Medicine)在预防及治疗新生儿低血糖的指南中指出,助产机构相关医护人员应积极进行母乳喂养的宣教,并协助产妇在生后30~60 min内建立母乳喂养[14]。生后早期需进行每天不少于8~12次的母乳喂养,以促进泌乳及增加母乳喂养量,同时减少母婴分离,降低新生儿住院率及住院费用[15-16]。2014年Harris等[17]在45个医疗机构中的调查问卷显示,澳大利亚及新西兰地区92%助产机构中的低血糖高危新生儿父母同意提前使用配方奶喂养,以预防新生儿低血糖事件的发生。英国国家卫生与临床优化研究所(National Institute for Health and Care Excellence)有关GDM的指南也提出,当哺乳不足时可挤出母乳或配方奶喂养以保证稳定的葡萄糖供应,推荐每2~3 h规律地喂养母乳或配方奶[18]。
目前,我国大部分助产机构积极创建爱婴医院,部分机构错误解读爱婴医院政策,盲目禁止配方奶喂养。低血糖高危儿存在无母乳或母乳喂养不足等情况时,配方奶喂养亦可提供葡萄糖来源,符合使用配方奶喂养的医学指征,也不违背爱婴医院的母乳喂养原则。不建议使用糖水或加糖奶喂养,因为快速提升血糖可刺激自身胰岛素的分泌,导致反应性低血糖。助产机构医护人员应对家属做好关于新生儿低血糖的宣教工作,正确认识低血糖的高危因素,规范监测低血糖高危儿的血糖,及时识别并有效处理低血糖,避免新生儿低血糖脑损伤的发生。
3 低血糖高危儿监测血糖及确诊低血糖的方法
推荐意见4:建议对低血糖高危儿常规使用床旁血糖仪进行末梢血糖监测(高质量证据,强推荐)。
推荐意见5:在进行新生儿低血糖症诊断时,建议采用己糖激酶法完善血浆葡萄糖检测(高质量证据,强推荐)。
2017年Dixon等[2]的调查问卷研究显示,英国135个医疗机构的新生儿BGL检测方法中,87.4%的医疗机构采用血糖仪进行床旁检测(point-ofcare testing,POCT);68.1%的医疗机构同时具备血气分析仪可以检测BGL;兼用POCT及血气分析仪者占56.3%。POCT拥有便捷、操作简单、采血量少、血糖值读数快、痛感低等优点,在临床上易于推广。我国非新生儿专科护士很难成功进行新生儿静脉采血,所以POCT已广泛用于产后母婴同室(产科)的新生儿BGL监测。血糖仪多采用了葡萄糖脱氢酶电化学法、葡萄糖氧化酶干化学法等不同的方法,监测范围为0.6~33.3 mmol/L,BGL越低,POCT所测血糖值误差越大,误差范围高达0.6~0.8 mmol/L[19]。采取低血糖同质化管理培训、血糖仪定期校准等措施可提高POCT准确度[20-21]。
2010年Roth-Kleiner等[22]使用了3种床旁血糖仪与标准己糖激酶法对1 324个配对样本进行血糖检测。研究结果显示,所有POCT结果的精确度均未达到ISO标准,且血糖值普遍偏高,建议当BGL≤3 mmol/L时行己糖激酶法检测。英国34.6%的医疗机构则采用BGL<2.6 mmol/L作为行己糖激酶法检测的阈值,另有38.5%的医疗机构使用其他阈值行己糖激酶法检测[2]。2011年我国卫生部颁布的《WS/T 350-2011血清葡萄糖测定参考方法》亦为己糖激酶法,故建议采用己糖激酶法行血浆葡萄糖检测作为检测BGL的金标准方法。母婴同室(产科)新生儿通过病史、低血糖高危因素、临床表现等方面,综合判定是否需要静脉采血行己糖激酶法完善血浆葡萄糖检测。NICU/新生儿科的新生儿不受限于采血时,可参考床旁血气分析中的血糖值,必要时完善血浆葡萄糖检测。此外,血糖值还受标本类型、抗凝处理方法、放置时间、红细胞压积等影响,其中全血标本葡萄糖值较血浆葡萄糖值低约15%[22-23]。
连续血糖监测虽然可以实时监控新生儿血糖变化趋势、避免反复疼痛刺激,但监测范围受限,仅为2.2~22.2 mmol/L。还因缺少专用的新生儿设备、价格昂贵、精确度较低等原因,连续血糖监测在新生儿中的应用尚在临床研究阶段[24]。
4 母婴同室新生儿血糖监测的时机及频率
推荐意见6:对无低血糖高危因素的健康新生儿不常规进行血糖监测,当出现疑似低血糖症状或体征时需立即进行血糖监测(高质量证据,强推荐)。
推荐意见7:对于无症状的低血糖高危新生儿,血糖首次监测应在第1次有效喂养后30 min,且不晚于生后2 h,随后常规的血糖监测应在喂奶前进行(中等质量证据,强推荐)。
推荐意见8:若最初2次BGL≥2.6 mmol/L,随后可q3h~q6h监测喂奶前血糖(中等质量证据,强推荐)。
推荐意见9:若连续3次BGL≥2.6 mmol/L,出生24~48 h内可根据具体的低血糖高危因素适当减少血糖监测频次(中等质量证据,强推荐)。
2014年Harris等[17]的调查问卷显示,98%的医疗机构只对具有低血糖高危因素的新生儿常规进行血糖监测。目前国际上所有低血糖相关指南均建议仅在低血糖高危儿中监测血糖。对于不具备低血糖高危因素的新生儿,若出现交感神经兴奋性升高或中枢神经系统异常等疑似低血糖表现者,常规监测血糖以明确是否由低血糖(BGL<2.6 mmol/L)所致。新生儿脐带结扎后中断了母源性的葡萄糖供给,需要及时建立喂养维持正常血糖,WHO指南建议生后30~60 min进行哺乳或喂养[25]。现有的指南均推荐首次血糖监测需在喂养1次后30 min进行,且不晚于生后2 h,随后常规的血糖监测应在喂奶前进行。为了避免出生2 h内低血糖的发生及对其过度的临床干预,强调首次血糖监测需在第1次喂奶后30 min进行。若最初2次血糖监测均未发生BGL<2.6 mmol/L,可适当减少监测频次至q3h~q6h[9,12,14-15]。北美地区临床医生根据低血糖高危因素决定监测时间:对于GDM母亲分娩的新生儿,最初数小时易发生无症状性低血糖,若出生12 h内维持BGL≥2.6 mmol/L可考虑停测血糖;LGA可早至出生3 h,晚至出生10 d都可能发生低血糖;对于一般情况良好的早产儿、SGA、IUGR新生儿,均建议q2h~q3h喂养,并q3h~q6h监测喂奶前血糖,若一般情况良好,出生24 h后可停测血糖;对于出生24 h内未曾发生过BGL<2.6 mmol/L的其他低血糖高危儿,可根据具体的低血糖高危因素适当减少监测频次或减停监测;若生后24 h内出现过BGL<2.6 mmol/L,则在生后第2天再监测1~2次血糖,确保BGL>2.6 mmol/L[11]。美国儿童内分泌协会(Pediatric Endocrine Society)从神经内分泌途径指出,新生儿出生48 h后BGL稳定并接近儿童及成人BGL,故建议根据低血糖高危因素及BGL结果,可在出生24~48 h内减停血糖监测[18]。严重或反复性或症状性低血糖则需规律、频繁且长时间监测血糖,同时注意与监护人充分沟通血糖监测的重要性[9,11-12]。医护人员需在不违背医疗原则的情况下进行血糖监测,切勿过度监测,否则不仅对新生儿造成反复疼痛刺激,还会增加工作量及经济负担,造成资源浪费。
5 新生儿发生低血糖后的血糖监测
推荐意见10:在补充喂养后,或静脉推注葡萄糖后,或改变葡萄糖输注速度(glucose infusion rate,GIR)后30 min复测血糖(GPS)。
推荐意见11:建议q1h监测血糖,直至BGL≥2.6 mmol/L;若出生48 h内BGL>2.8 mmol/L或出生48 h后BGL>3.3 mmol/L,频率调整为q3h~q6h监测喂奶前血糖(中等质量证据,强推荐)。
推荐意见12:停止补充喂养和/或静脉输注葡萄糖后,出生48 h内连续3次喂奶前BGL>2.8 mmol/L或出生48 h后连续3次喂奶前BGL>3.3 mmol/L,可停止监测血糖(中等质量证据,强推荐)。
2011年美国儿科协会(American Academy of Pediatrics)建议新生儿发生低血糖后需立即进行喂养,即补充喂养[12]。2019年加拿大儿科协会(Canadian Pediatric Society)指南建议可进行哺乳或8 mL/kg的奶量作为补充喂养,喂养后30 min进行血糖复测[11]。2021年昆士兰临床指南(Queensland Clinical Guideline)建议当改变静脉葡萄糖输注量或速度后30 min也需复测血糖,用以评价血糖干预效果,而在BGL<2.6 mmol/L期间需每小时监测血糖[9]。目标血糖维持范围参考美国儿童内分泌协会提供的方案,从儿童和成人经验分析,BGL<2.8 mmol/L就可能导致低血糖脑损伤,故建议出生48 h内维持BGL>2.8 mmol/L,出生48 h后维持BGL>3.3 mmol/L。达到目标范围BGL后可考虑减少血糖监测频次[19]。
加拿大儿科协会建议无论日龄和病因,达到全肠内喂养者连续2次喂奶前血糖在正常范围内即可停止监测血糖[11]。昆士兰临床指南建议当停止补充喂养或静脉葡萄糖输注后连续3次喂奶前BGL在目标范围内,可停止监测血糖[9]。而在NICU/新生儿科住院新生儿病因复杂,如感染、休克、脏器衰竭等很可能伴有糖代谢紊乱,具体血糖监测的频次及减停时机,需根据高危因素、基础疾病、新生儿日龄等情况决定。本共识参考近年来国外低血糖管理指南及规范,仅针对胎龄35周以上单纯低血糖高危儿提供参考建议。
6 母婴同室新生儿发生低血糖后的临床管理
推荐意见13:新生儿低血糖临床处理阈值为BGL<2.6 mmol/L,若同时存在低血糖症状,应收入NICU/新生儿科,立即完善血浆葡萄糖检测,静脉推注10%葡萄糖2 mL/kg(1 mL/min)后维持葡萄糖液或肠外营养液输注[GIR 5~8 mg/(kg·min)](中等质量证据,强推荐)。
推荐意见14:对于首次BGL<2.0 mmol/L者,应收入NICU/新生儿科,立即完善血浆葡萄糖检测,静脉推注10%葡萄糖2 mL/kg(1 mL/min)后维持葡萄糖液或肠外营养液输注[GIR 5~8 mg/(kg·min)](低质量证据,强推荐)。
推荐意见15:首次2.0 mmol/L≤BGL<2.6 mmol/L者,行补充喂养,30 min后复测血糖,如果:(1)BGL<2.2 mmol/L,收入NICU/新生儿科,立即进行血浆葡萄糖检测,静脉推注10%葡萄糖2 mL/kg(1 mL/min)后维持葡萄糖液或肠外营养液输注[GIR 5~8 mg/(kg·min)];(2)2.2 mmol/L≤BGL<2.6 mmol/L,继续补充喂养,若连续2次补充喂养后复测血糖达不到BGL≥2.6 mmol/L,则收入NICU/新生儿科,立即进行血浆葡萄糖检测,维持葡萄糖液或肠外营养液输注[GIR 5~8 mg/(kg·min)];(3)2.6 mmol/L≤BGL<2.8 mmol/L,喂养频次为q2h~q3h(低质量证据,强推荐)。
1988年Lucas等[26]的多中心队列研究(n=661,平均胎龄30+5周,出生体重<1 850 g)发现,新生儿期发生过BGL<2.6 mmol/L组较未曾发生组在18月龄时Bayley评分低,且低血糖持续时间越长,Bayley评分降低越明显。此后多数指南将BGL<2.6 mmol/L作为所有新生儿低血糖临床处理阈值。2015年McKinlay等[3]的一项回顾性队列研究(n=528,胎龄>35周)显示在生后7 d内,若发生BGL<2.6 mmol/L即进行临床干预组和未曾发生过BGL<2.6 mmol/L组,在2岁的相关神经损伤(Bayley评分、视听测试、执行功能评分等)无差异(OR=0.95,95%CI:0.75~1.20),也 证 明 了 将BGL<2.6 mmol/L作为低血糖临床处理阈值安全可靠。故仍建议新生儿低血糖的临床处理阈值为BGL<2.6 mmol/L。
2006年Alkalay等[27]的Meta分析(n=723)显示,足月健康新生儿出生1~2 h第5百分位(P5)的BGL约为1.5 mmol/L,出生3~48 h内P5的BGL≥2.2 mmol/L,出生48 h后P5约为2.7 mmol/L。这提示新生儿最初2 h内的血糖生理性偏低,之后血糖趋于稳定。2002年Diwakar等[28]的队列研究(n=200,胎龄37~42周)中纯母乳喂养的足月适于胎龄儿,分别在出生3 h、6 h、24 h、72 h时测量血浆葡萄糖,其中位数均约为2.8 mmol/L,在“低”BGL时立即哺乳,BGL均可较快升高,参与研究的新生儿均未发生低血糖相关临床症状[28]。故建议可通过补充喂养方式提高BGL。
2017年McKinlay等[29]的一项前瞻性队列研究(n=614,胎龄≥32周)分析了存在至少1个低血糖高危因素的新生儿,以4.5岁(±2个月)是否发生感觉神经功能损害作为主要结局,结果显示发生过BGL<2.6 mmol/L的低血糖组与非低血糖组相比,主要结局无显著差异(RR=0.96;95%CI:0.77~1.21);而在次要结局中,低血糖组在5项执行功能上较非低血糖组稍差,提示未来发生注意力缺陷综合征、行为障碍、学习问题等风险增高;在视觉运动协调功能方面表现也欠佳,或将导致阅读、写作、数学等能力下降。低血糖亚组分析显示,BGL<2.0 mmol/L或反复低血糖时以上风险发生率显著增高[29-31]。2020年van Kempen等[32]的多中心非劣效性RCT(n=689,胎龄≥35周,出生体重>2 000 g,研究对象为低血糖高危新生儿),分别将BGL<2.0 mmol/L及BGL<2.6 mmol/L作为低血糖处理阈值。两组婴儿在18月龄时的Bayley-Ⅲ评分无显著差异,指出BGL<2.0 mmol/L作为无症状低血糖临床治疗阈值是安全的。根据以上研究结果,考虑到低血糖管理的安全性及有效性,同时避免过度治疗,结合有过渡性低血糖的存在,建议将首次BGL<2.0 mmol/L作为收入NICU/新生儿科的参考标准。我国《实用新生儿学》[5]在未区分日龄及高危因素情况下,提出当BGL<2.6 mmol/L时行葡萄糖输注[GIR 6~8 mg/(kg·min)]的要求过于积极。综合安全性和我国国情,结合Alkalay等[27]的研究,建议除首次BGL外,当BGL<2.2 mmol/L可作为收入NICU/新生儿科的参考标准。
儿童或成人发生低血糖可立即口服碳水化合物以提升血糖,40%葡萄糖凝胶是新生儿理想的碳水化合物,1992年在文献中首次被提出用于治疗新生儿低血糖[33]。2013年Harris等[34]的RCT(n=237)研究证实,出生48 h内发生低血糖事件的新生儿使用40%葡萄糖凝胶(0.5 mL/kg)涂颊黏膜,同时补充喂养,可有效提高新生儿的BGL。因40%葡萄糖凝胶易获取、价格低廉、安全有效,降低了NICU低血糖患儿住院率及母婴分离率,也提高了母乳喂养率,建议将40%葡萄糖凝胶作为晚期早产儿和足月新生儿生后48 h内低血糖的一线治疗药。目前无论是美国儿科协会,还是最新的2020年瑞典国家指南(Swedish National Guideline)、2021年美国母乳协会、2021年昆士兰临床指南等最新指南均建议无症状性低血糖新生儿(BGL 1.5~2.5 mmol/L),使用40%葡萄糖凝胶涂颊黏膜,同时补充喂养作为初始治疗方案。当BGL<1.5 mmol/L时或连续使用两次40%葡萄糖凝胶后仍然BGL<2.6 mmol/L才收入NICU/新生儿科[9,12,14-15]。目前国内尚无新生儿可用的葡萄糖凝胶,呼吁我国尽快生产安全、有效的葡萄糖凝胶制剂,可降低暂时性新生儿低血糖的住院率。母乳、捐赠母乳、配方奶都可提供碳水化合物从而提升BGL。美国儿童内分泌协会指出,48 h内理想BGL≥2.8 mmol/L,故建议当2.6 mmol/L≤BGL<2.8 mmol/L时可适当增加喂养频次[19,29]。目前国内外大多数医疗中心采取连续2次补充喂养后,仍未达到BGL≥2.6 mmol/L,作为收入NICU/新生儿科的标准。在任何喂养过程时,若出现吮吸无力或反应欠佳者,同时测量BGL<2.6 mmol/L,则按可疑低血糖症状处理收入院。关于补充喂养时的奶量:加拿大儿科协会推荐每次8 mL/kg[11];瑞典国家指南建议出生24 h内每次5~7 mL/kg,而BGL偏低时,可达7~12 mL/kg,q2h~q3h喂养[15];2021年美国母乳喂养医学会推荐出生24 h内每次2~10 mL/kg,出生24~48 h每次5~15 mL/kg[14]。
我国绝大多数医疗机构由产科护士照护生后相对健康的低血糖高危儿,既往多不能成功进行新生儿静脉采血,以及建立静脉通道;而近年来,越来越多的医疗机构开设了母婴同室的新生儿病房。鉴于此,建议医疗机构在保证安全的情况下,根据自身情况决定是否收入NICU/新生儿科。不同国家的指南对低血糖患儿收入NICU/新生儿科的标准亦不同(表3)。
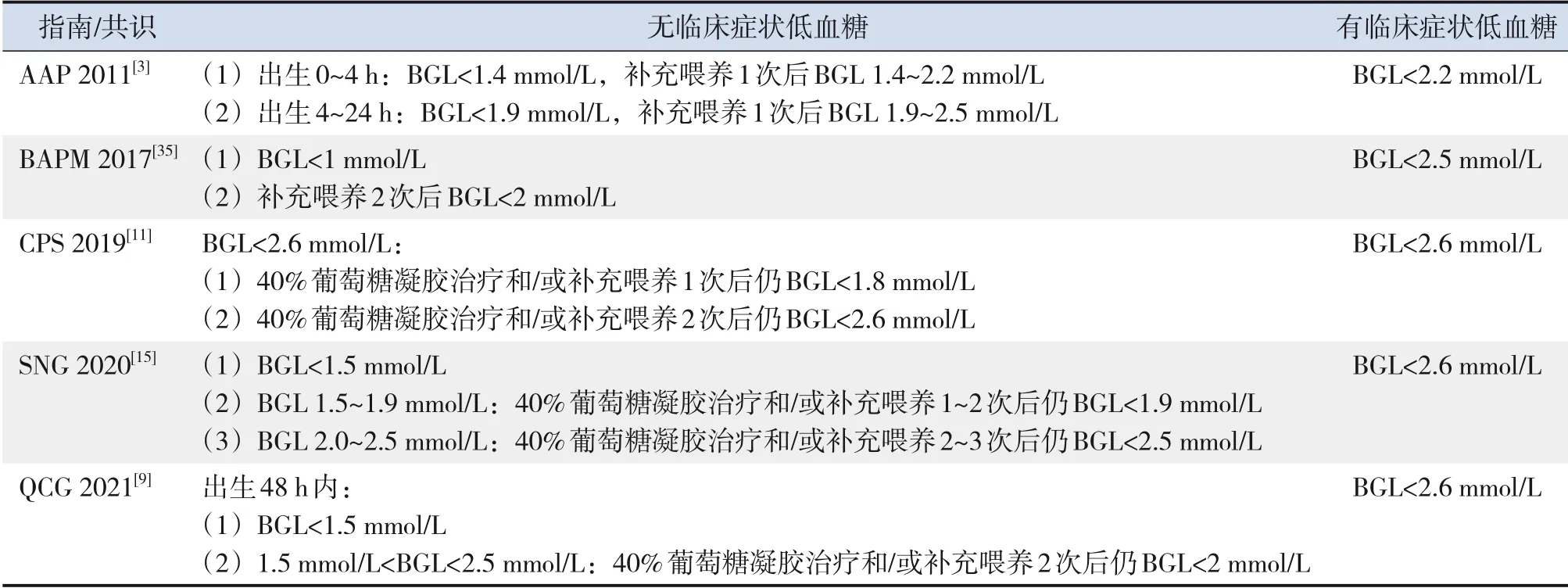
表3 不同国家新生儿低血糖收入NICU的标准
7 NICU/新生儿科发生低血糖后的临床管理
推荐意见16:建议出生2 h内尽早喂养,无条件喂养或非营养性喂养时静脉维持GIR 5~8 mg/(kg·min)(中等质量证据,强推荐)。
推荐意见17:当BGL<2.2 mmol/L或BGL<2.6 mmol/L伴低血糖症状时按低血糖症处理:立即进行血浆葡萄糖检测,静脉推注10%葡萄糖2 mL/kg(1 mL/min)后维持葡萄糖液或肠外营养液 输 注[GIR 5~8 mg/(kg·min)];当2.2 mmol/L≤BGL<2.6 mmol/L时尽快维持目标BGL,立即进行血浆葡萄糖检测,维持葡萄糖液或肠外营养液输注[GIR 5~8 mg/(kg·min)](中等质量证据,强推荐)。
推荐意见18:推荐目标BGL为:出生48 h内2.8 mmol/L<BGL≤5 mmol/L,出生48 h后3.3 mmol/L<BGL≤5 mmol/L(中等质量证据,强推荐)。
胎儿或新生儿葡萄糖利用速度明显高于成人[5~8 mg/(kg·min)vs 2~3 mg/(kg·min)][36],NICU/新生儿科的新生儿多伴有≥1个原发疾病,呈高代谢状态,需消耗更多葡萄糖,发生低血糖风险更高。无条件喂养或非营养性喂养时,应保持与新生儿葡萄糖利用速度相同的GIR[5~8 mg/(kg·min)]。随着40%葡萄糖凝胶的应用,多个最新指南均建议,当BGL<1.5 mmol/L或发生症状性低血糖时才需快速推注葡萄糖(10%葡萄糖2 mL/kg,1 mL/min)[9,11,15]。结合我国国情及住院新生儿多呈高代谢状态,建议当BGL<2.2 mmol/L静脉推注葡萄糖,同时维持GIR 5~8 mg/(kg·min)的含糖液体输注。葡萄糖是大脑能量的主要来源,在发育关键期内,新生儿尤其是早产儿的大脑,对异常波动的葡萄糖水平极为敏感且具有双重易损性。低血糖本身可导致脑损伤,但低血糖后血糖上升幅度过大也可加重神经元损伤。临床除避免发生低血糖外,还需警惕发生高血糖,维持稳定的BGL更为重要。
生后不久的新生儿,当BGL≥3.0~3.6 mmol/L可短时间内刺激胰岛素轻微升高。在幼儿、儿童、成年人群中,当BGL≥4.4~4.7 mmol/L则可较多地刺激胰岛素分泌;出生72 h后血糖-胰岛素反馈机制趋于成熟[19]。NICU/新生儿科住院新生儿无论出于何种原因均建议维持血糖在生理范围内,目前可参考的血糖范围主要为以下2种:美国儿童内分泌协会建议出生48 h内维持BGL>2.8 mmol/L,出生48 h后维持BGL>3.3 mmol/L[19];加拿大儿科协会建议出生72 h内维持2.6 mmol/L<BGL≤5 mmol/L,出生72 h后维持3.3 mmol/L<BGL≤5 mmol/L[11]。伴有原发疾病的新生儿葡萄糖消耗速率更快,对BGL需求更高;但过高的BGL会刺激胰岛素分泌。综合以上因素及国外研究,本共识建议NICU/新生儿科的新生儿血糖维持在正常高限水平,即出生48 h内维持2.8 mmol/L<BGL≤5 mmol/L,出生48 h后维持3.3 mmol/L<BGL≤5 mmol/L。
低血糖的远期不良结局的发生主要受不同病因、低血糖程度、持续时间、血糖的波动范围等因素影响,因临床大部分为一过性、暂时性低血糖,笼统诊断为新生儿低血糖症不利于远期预后的判断,故建议根据国际疾病分类进行标准化诊断[37]。
8 新生儿反复性或持续性低血糖发生后的临床管理
推荐意见19:当GIR>8~10 mg/(kg·min)仍不能维持正常BGL时,需考虑中心静脉置管;当GIR>10~12 mg/(kg·min)时,需考虑药物治疗(GPS)。
推荐意见20:反复性或持续性低血糖新生儿需进一步寻找病因(GPS)。
临床工作中低血糖新生儿起始GIR常计划过高,应使用GIR 5~8 mg/(kg·min)进行输注,并适当调节GIR以维持理想的BGL。人体外周血管耐受糖浓度约12%,为了减轻液体负荷则需要提高糖浓度,当GIR>8~10 mg/(kg·min)仍 不 能 维 持 正 常BGL,则需考虑深静脉置管(中心静脉置管、经外周静脉穿刺中心静脉置管、脐静脉置管)。当GIR>10~12 mg/(kg·min)才能维持正常BGL时,需考虑胰高血糖素、糖皮质激素、二氮嗪、奥曲肽等药物治疗(表4)[9]。反复性或持续性低血糖症对静脉葡萄糖浓度高度依赖,或需要GIR>8 mg/(kg·min)才能维持正常BGL者,需高度警惕内分泌或代谢系统疾病。此外,当BGL<1.5 mmol/L或出现低血糖症状的新生儿、有低血糖家族史、部分先天性疾病等也需要完善相关检查,寻找病因[11]。若低血糖新生儿对GIR的需求持续增加时,需要警惕先天性高胰岛素血症。胰岛素呈脉冲式分泌,诊断时需多次测定胰岛素水平。其他血液学检查包括pH、乳酸、血氨、酮体、β-羟丁酸、血斑中的酰基肉碱(脂肪酸氧化障碍)、脂肪酸、C肽、胰高血糖素、儿茶酚胺、皮质醇、生长激素等,必要时进行基因检测分析。当怀疑低血糖相关内分泌或遗传代谢疾病时,需在BGL低时采集的血标本完成上述检查,结果才有意义[38-39]。
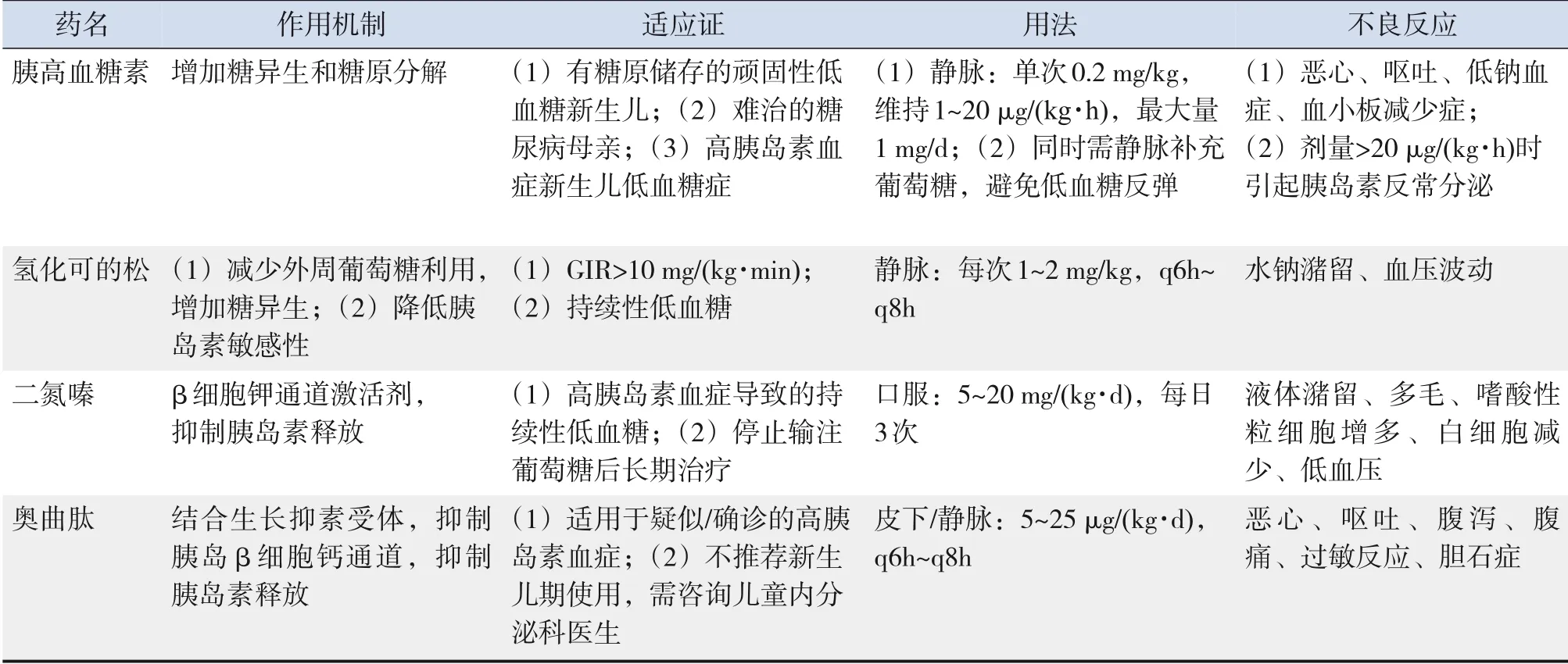
表4 新生儿低血糖的药物治疗
9 低血糖脑损伤高危儿出院前的脑损伤评估
推荐21:严重性、持续性或症状性低血糖新生儿为低血糖脑损伤高危儿,建议出院前通过振幅整合脑电图(amplitude-integrated electroencephalography,aEEG)和头颅磁共振成像(magnetic resonance imaging,MRI)评估低血糖脑损伤情况及其严重程度(GPS)。
大脑的主要能量来源是葡萄糖,其余还受乳酸、酮体、氨基酸等替代能源影响。生后48 h内新生儿大脑的酮体和乳酸水平低,在低血糖早期或急性期提供的能量无法有效代偿。早期严重性、持续性或症状性低血糖容易导致脑细胞能量缺乏,甚至衰竭[40-41]。
低血糖脑损伤后1周内头颅MRI可主要表现为双侧顶枕叶皮质及其皮质下白质梗死性损伤,部分损伤还可累及大脑半球白质、基底节、丘脑[42]。在损伤后24 h内甚至可在弥散加权成像(diffusion weighted imaging,DWI)显示出损伤区域的脑白质异常[43]。临床出现低血糖症状,尤其是惊厥表现患儿,远期可能出现发育迟缓、脑瘫、智力受损、癫痫、致盲等永久性脑损伤。因新生儿低血糖所致的癫痫还容易对抗癫痫药无效,即难治性癫痫[44]。2017年Arhan等[45]的临床研究(n=45)随访了6月龄至15岁既往有症状性低血糖症的患儿,头颅MRI均显示双侧枕叶脑损伤,其中36人后期遗留癫痫,23人发展为难治性癫痫。2019年Shah等[46]的Meta分析也显示新生儿低血糖与视觉运动受损(n=508,OR=3.46,95%CI:1.13~10.57)、执行功能障碍(n=463,OR=2.50,95%CI:1.20~5.22)及学习能力降低相关。
aEEG可以监测惊厥的发生,可以及时发现无临床症状的电惊厥。2018年Lv等[47]的一项回顾性研究分析(n=58),根据临床表现、aEEG及特征性的头颅MRI改变对低血糖新生儿诊断低血糖脑损伤,其中脑损伤组(n=13)与非脑损伤组(n=45)的最低BGL(0.3 mmol/L vs 1.4 mmol/L)、平均低血糖持续时间(13 h vs 2 h)及平均血糖波动幅度[(7.82±2.13)mmol/Lvs(4.35±1.68)mmol/L]的比较均有明显差异,提示低血糖脑损伤与上述3个因素均有关。2019年Gu等[48]的回顾性研究显示,异常头颅MRI组低血糖持续时间明显长于MRI正常组[(3.39±4.20)d vs(1.01±0.80)d],但最低BGL无显著差异。目前能够导致低血糖脑损伤的最低阈值仍然缺乏足够的临床证据,可以肯定的是,低血糖持续时间越长对脑损伤影响更大。
目前aEEG较为普及,对发生低血糖收入NICU/新生儿科的患儿应及时监测aEEG,以辅助诊断低血糖惊厥。头颅MRI尤其是DWI可在低血糖发生1周内的早期进行辅助诊断低血糖脑损伤;另外,临床研究提示神经元特异性烯醇化酶、S100蛋白和血清神经珠蛋白可作为评估新生儿低血糖脑损伤的指标,但其临床应用证据尚不充分[49-50]。
10 结语
本共识基于目前国内外能获取的最佳证据,根据GRADE方法进行证据分级,经专家组认真讨论后形成。本共识共有21条推荐意见,其中高质量证据4条,中等质量证据10条,低质量证据2条,GPS 5条,具体汇总见表5。本共识虽然参照了相关指南制订方法,但仍存在以下局限性:(1)主要针对单纯低血糖高危儿进行的临床管理(图1);(2)基于我国国情,本共识进行的医疗干预措施相对其他国家的指南仍较积极。本共识将根据最新的国内外指南及研究进展,拟每3~5年进行更新。
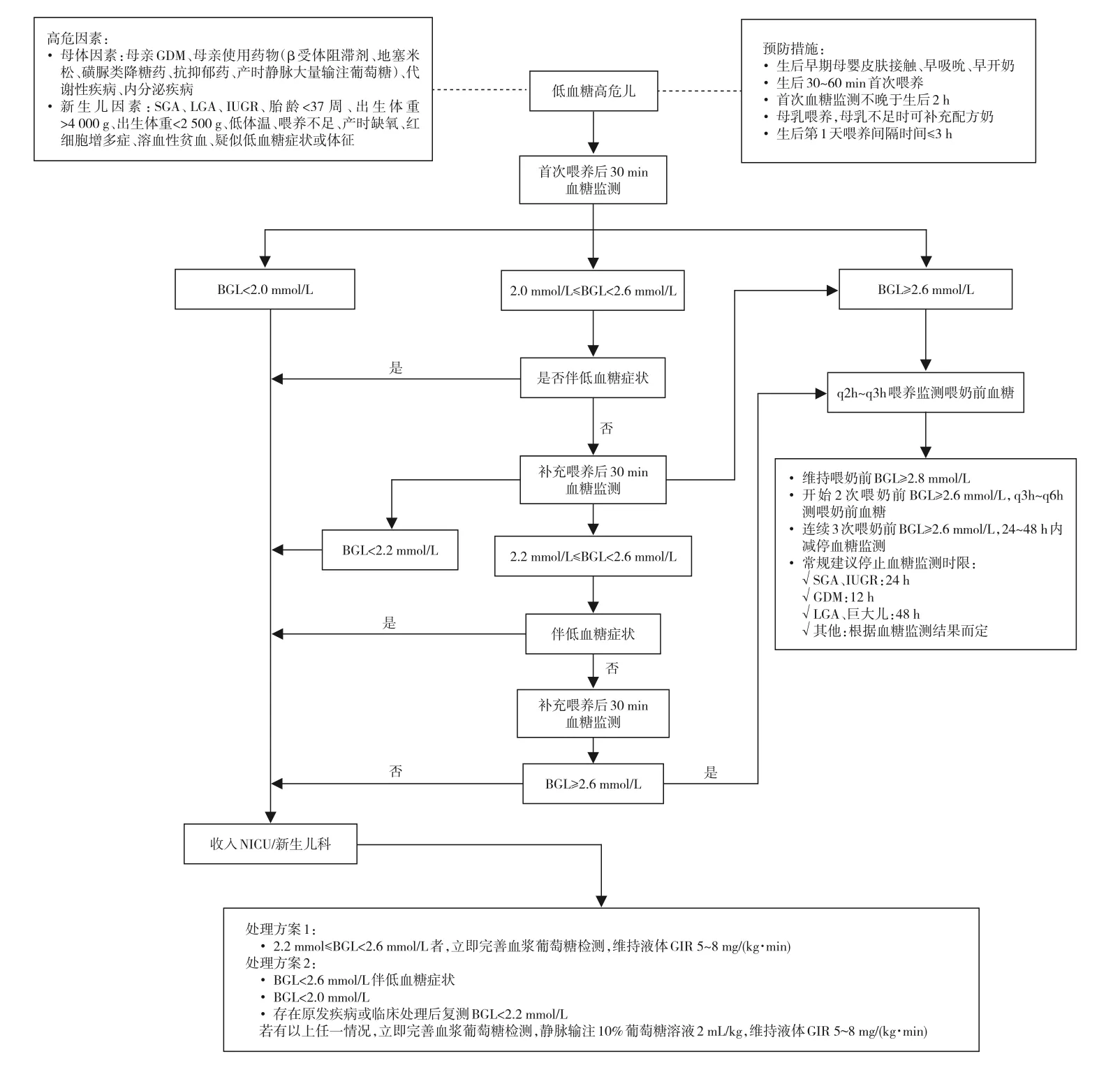
图1 母婴同室低血糖高危儿的临床管理流程 [BGL]血糖水平;[GIR]葡萄糖输注速度;[GDM]妊娠糖尿病;[SGA]小于胎龄儿;[LGA]大于胎龄儿;[IUGR]宫内生长发育迟缓。

表5 (续)

表5 新生儿低血糖临床管理专家共识推荐意见
执笔人:巨容(电子科技大学医学院附属妇女儿童医院·成都市妇女儿童中心医院新生儿科)、包蕾(重庆医科大学附属儿童医院新生儿科)、母得志(四川大学华西第二医院新生儿科)、冯星(苏州大学附属儿童医院新生儿科)、富建华(中国医科大学附属盛京医院新生儿科)、史源(重庆医科大学附属儿童医院新生儿科)、周文浩(复旦大学附属儿科医院新生儿科)
参与本专家共识讨论和修改的专家名单(排名不分先后):
北京大学第三医院(朴梅花、童笑梅、邢燕);北京大学第一医院(冯琪、姜玉武);北京协和医院(王丹华);重庆市妇幼保健院(钟晓云);重庆医科大学附属儿童医院(史源、李芳、包蕾);电子科技大学医学院附属妇女儿童医院·成都市妇女儿童中心医院(巨容、王鑫、朱玲、赵奇思、卢江溢);复旦大学附属儿科医院(周文浩、陈超、王来栓、胡梨园);广东省妇幼保健院(杨杰);甘肃省妇幼保健院(石静云);广西壮族自治区妇幼保健院(高晓燕、韦秋芬);贵阳市妇幼保健院(刘玲);广州市妇女儿童医疗中心(张华岩);河北医科大学附属医院(马莉);湖北省妇幼保健院(夏世文);湖南省妇幼保健院(曹蓓、彭湘莲);吉林大学白求恩第一医院(武辉);陆军特色医学中心大坪医院(胡章雪);南方医科大学附属深圳市妇幼保健院(杨传忠);南方医科大学附属珠江医院(王斌);南京市妇幼保健院(韩树萍);南京医科大学附属儿童医院(程锐);内蒙古医科大学附属医院(梅花);宁夏回族自治区妇幼保健院(纪永佳);宁夏医科大学总医院(邱银萍);青岛妇女儿童医院(刘秀香);泉州市儿童医院(陈冬梅);四川大学华西第二医院(母得志、唐军、石晶);首都医科大学附属北京儿童医院(黑明燕);上海市第一妇婴保健院(刘江勤);上海交通大学医学院附属新华医院(孙建华);上海市儿童医院(裘刚);山西省儿童医院(冀湧);山西省妇幼保健院(刘克战);苏州大学附属儿童医院(冯星、丁欣);天津市中心妇产科医院(郑军、田秀英);西安交通大学第一附属医院(周熙惠);西北妇女儿童医院(李占魁);厦门市妇幼保健院(林新祝);西南医科大学附属医院(董文斌);中国疾病预防控制中心妇幼保健中心(徐韬);中国人民解放军总医院第七医学中心(封志纯、李秋平);中国人民解放军总医院第五医学中心(张雪峰);中国医科大学附属盛京医院(富建华、侯阿娜);浙江大学医学院附属儿童医院(杜立中、马晓路、施丽萍);浙江大学医学院附属妇产科医院(吴明远、朱家骏);郑州大学第三附属医院(徐发林)
利益冲突声明:所有作者均声明不存在利益冲突。

