三叶青2个ThBLH转录因子cDNA的克隆及其对光质与光周期信号的响应
闻静, 刘俊, 段华平, 林国卫, 蔡红, 张莉, 赵刚
(1.上饶师范学院生命科学学院,江西 上饶 334000;2.上饶市红日农业开发有限公司,江西 上饶 334000)
三叶青(TetrastigmahemsleyanumDiels et Gilg)是中国特有珍贵药用植物,中医记述三叶青可治疗小儿高热惊厥、肺炎、哮喘、肝炎以及风湿等[1]。现代药理学研究表明,三叶青块根提取物在治疗肿瘤等方面具有良好效果[2-3],对于乳腺癌[4]、肠癌[5]、食道癌[6]等癌症中的癌细胞增殖、迁移、生长都有不同程度抑制作用。随着三叶青药用功能的深入挖掘,其经济价值逐渐被市场认同。江西省是三叶青重要的产地及栽培地之一[7],江西省怀玉山三叶青被农业部核准为地理标志农产品。因此,进一步认识三叶青块根发育的相关分子生物学基础,特别是环境光信号所参与的块根发育的分子调控机制对于三叶青的优质高产栽培具有指导意义。
相关研究表明,环境光信号所参与的块根发育的分子调控机制是由BEL1-like同源结构(BEL1-like homeodomain,BLH)转录因子所调控的,植物的BLH基因与BELL基因家族属于同源基因,是植物体内普遍存在的转录因子[8],调控植物的发育中许多生物学过程[9],如分生组织的形成及分生特性的保持[10]、苹果心皮及果实的发育[11]、营养生长阶段向生殖生长阶段的转变[12]等。BLH基因所编码的蛋白属于TALE(three amino acid loop extension)蛋白家族,具有2个保守域,其中1个结合DNA的同源结构域(homeodomain),在该区域有1个保守SKY保守盒;另外1个是与同源盒蛋白(knotted1-like homebox,KNOX)相互作用的BELL保守域(或POX superfamily),包括1个保守的VSLTLGL基元[13]。该基因家族编码的蛋白与KNOTTED1-type 转录因子结合形成异质蛋白二聚体,结合目的基因5’-UTR区的TTGAC-TTGAC序列,启动目的基因的转录[14]。
光质及光周期是影响植物的生长重要环境信号[15]。HOANG等[16]研究表明,不同起源的地下储藏器官的发育受到相似的分子网络所调控。目前,光周期调控植物地下储藏器官发育主要集中于模式植物马铃薯,马铃薯的光周期诱导表达转录组分析发现,StBEL5位于块茎形成信号分子网络的上游,可诱导匍匐茎内源激素代谢及运输相关的基因表达,甚至还包括块茎形成的移动信号分子StCDF1及StSP6A的表达从而促进块茎的形成[17],因此推测三叶青的BLH转录因子有可能在块根发育过程中起到一定作用。闻静等[18]研究表明,长日光周期有利于块根的形成与发育,蓝光及红光补充光照可显著提高三叶青块根的产量。本研究从三叶青块根发育不同时期(纤维根、初始膨大块根、膨大块根)的转录组中筛选出相对表达量显著提高的2个ThBLH基因cDNA,通过PCR方法成功进行分离,通过相对荧光定量表达(quantitative real-time PCR,qRT-PCR)方法进一步分析这2个cDNA在块根发育不同时期的表达特征,以及在不同光周期与光质处理下的表达模式,从而筛选出积极响应的ThBLH转录因子,为进一步梳理光质及光周期所调控的三叶青块根发育的分子通路提供分子水平参考基础。
1 材料与方法
1.1 材料
1.1.1 试验材料 三叶青品种为怀玉2号,由上饶市红日农业开发有限公司提供。
1.1.2 试剂与仪器 反转录试剂盒ReverTra Ace®qPCR RT Master Mix with gDNA Remover、荧光定量试剂盒THUNDERBIRD®Next SYBR qPCR Mix购自(上海)东洋纺生物公司;RNA提取试剂盒Quik RNA Isolation KitGK购自北京华越洋生物科技公司;PCR试剂2×TransTaq High Fidelity(HiFi)PCR SuperMix I 购自北京全式金生物公司;胶回收试剂盒TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0及克隆载体pMDTM18-T Vector Cloning Kit均购自宝生物工程 (大连) 有限公司(大连TaKaRa公司);其他试剂购自中国医药集团有限公司。
引物合成服务由上海生物工程股份有限公司提供,测序服务由上海尼桑生物科技有限公司提供。PCR扩增仪(AG 22331,德国艾本德Eppendorf);荧光定量PCR仪(TL988-IV型,西安天隆科技有限公司);电泳仪(PowerPac Basic,美国伯乐Bio-Rad);RNA核酸定量检测仪(Biospec Nano,日本岛津);灯架及各种波段LED灯购自徐州爱佳电子科技有限公司。
1.2 方法
1.2.1 试验方法 以2018-07-25种植的1 a生怀玉2号扦插苗为材料,于江西省上饶市五府山三叶青种植基地设施大棚(118°4′14″ N,28°0′53″ E)及上饶师范学院生态园区的日光温室内种植。
光质试验处理:自2019-08-20开始持续处理45 d,每天18:00后分别以440~445 nm的蓝光、625~630 nm 的红光及白光(混合光,CK)照射3 h。具体参考闻静等[18]光质处理方法。
光周期处理:于2020-09-18起在上饶师范学院生态园日光温室的植物培养箱中进行,从8:00开始光暗循环。培养箱内光照处理时间控制条件分为4种:CK,光照(light,L)12 h +黑暗(dark,D)12 h;短日照处理(SD),L 8 h+ D 16 h;长日照处理(LD),L16 h+D 8 h;CO:连续24 h光照。光周期驯化3 d,于2020-09-21的12:00开始采样,每隔4 h采样1次,至2020-09-22的8:00结束取样;暗期采样在黑暗中具有遮光设施的天平上进行。取3~5株叶片剪碎混合,进行3个生物学重复,用锡纸包好并标记后放入液氮速冻10 min,于-80 ℃冰箱保存用于RNA提取。
块根发育不同时期:观察时间为2020-12-22,分别取未形成块根的植株纤维根(Ⅰ期)、初始膨大的块根(Ⅱ期)、膨大块根(Ⅲ期)及具有块根植株的纤维根(Ⅳ期),发育状态如图1所示。每个处理取4~5株样品,清洗后吸干表面水分,剪碎混合后立即取100 mg,进行3个生物学重复,用锡纸包好并标记后放入液氮速冻10 min,于-80 ℃冰箱保存用于RNA提取。

注:Ⅰ,未形成块根的植株纤维根;Ⅱ,初始膨大的块根;Ⅲ,膨大块根;Ⅳ,具有块根植株的纤维根,红框内是纤维根。Note:Ⅰ. The fibrous roots of plant without tuber;Ⅱ. Initially expanded tuber;Ⅲ. Expanded tuber;Ⅳ. The fibrous roots of plant with tuber, and in the red box are the fibrous roots.图1 三叶青块根发育不同时期情况Fig.1 The different stages of root tuber development of Tetrastigma hemsleyanum Diels et Gilg
1.2.2 总RNA的提取及cDNA的合成 参照提取试剂盒说明书提取三叶青叶片及块根总RNA。在进行RNA的纯度及定量检测后,选取A为260/280 ≥1.8、260/230 ≥1.5的总RNA用于cDNA合成,参照反转录试剂盒说明书取120 ng的总RNA用于反转录。
1.2.3 三叶青ThBLH转录因子的生物信息学分析 利用 NCBI(https://www.ncbi.nlm.nih.gov/)数据库中的在线开放读码框预测软件ORF finder 程序预测ThBLH基因的开放阅读框,并获得相应推测的氨基酸序列;NCBI数据库的pblast程序在线与其他物种进行同源性比对分析,利用Conserved domains 模块预测推测蛋白序列的名称与保守域;采用在线多重比对工具Clustalw(https://www.genome.jp/tools-bin/clustalw)进行推测蛋白质序列的多重比较;采用Mega7.0软件进行多重序列比对及进化树的构建(neighbor joining)。
1.2.4 三叶青ThBLH转录因子cDNA的克隆和测序 根据前期转录组获得的unigene 序列,以转录组相对表达量差异分析结果为依据,筛选在块根发育不同时期显著差异表达且相对表达量较高的ThBLH转录因子,并经过初步生物信息学分析后具有典型的BLH转录因子保守域的cDNA序列作为目的克隆基因。利用primer3-SGD在线引物设计软件(https://www.yeastgenome.org/primer)设计2个ThBLH转录因子全长扩增引物,如表1所示。参照说明书进行PCR,反应体系为50 μL,共35个循环,反应条件为98 ℃变性10 s,55 ℃退火5 s,72 ℃延伸2 min。PCR 产物以质量分数1%琼脂糖TAE凝胶电泳检测。将纯化后的PCR产物与载体PMD-18T连接,转化大肠杆菌后挑取阳性克隆进行测序。
1.2.5 定量qRT-PCR分析 根据三叶青转录组中的ThBLH转录因子的cDNA序列,利用引物设计软件primerplus3(http://www.primer3plus.com/)设计特异扩增ThBLH的荧光定量引物,如表1所示。反应操作参照试剂盒说明书,反应体系调整为20 μL。块根发育不同时期内参基因选用18S rRNA,光周期内参基因选用ELF-α(MT731970)、TUBA(MT731969)及18S rRNA(MW296875),不同光质内参基因选用18S rRNA、TBP(MT731974)及TUBA,引物序列参照闻静等[18]所设计的荧光定量引物,内参Ct值取这3个基因的几何平均值。试验设置生物学重复、技术重复各3次。相对荧光定量数据分析采用2-△△Ct法[19],显著性分析采用SPSS软件的LSD法分析,利用字母法标注。

表1 用于ThBLH转录因子CDS克隆及相对荧光定量分析的引物序列Table 1 Primers sequences used for ThBLH transcription factors CDS cloning and relative fluorescence quantitative analysis
2 结果与分析
2.1 三叶青ThBLH转录因子的生物信息学分析
利用NCBI数据库中的 ORF finder 程序分析(表2)显示,ThBLH1开放读码框长度为2 166 bp,编码721个氨基酸,ThBLH2开放读码框长度2 100 bp,编码699个氨基酸;保守域分析表明2个ThBLH的cDNA编码的推测蛋白序列都含有POX及Homeobox KN保守域;预测的蛋白分类为BLH蛋白,主要参与生物学过程为转录调控;在2个推测的ThBLH蛋白在N端具有保守的的SKY BOX及C端的VSLTLGL BOX,这些都是BELL家族成员典型的保守结构,各保守域及保守氨基酸序列具体位置见图2;进化树分析(图3)表明,ThBEL1蛋白与银白杨(Poppulusalba)、毛果杨(Populustrichocarpa)及锦葵(Herraniaumbratica)的BLH蛋白 1亲缘进化关系最近,ThBEL2蛋白与河岸葡萄(Vitisriparia)BLH蛋白 1处于同一进化分支。

表2 ThBLH1及ThBLH2转录因子的生物信息学分析Table 2 Bioinformatics analysis of ThBLH1 and ThBLH2 transcription factors
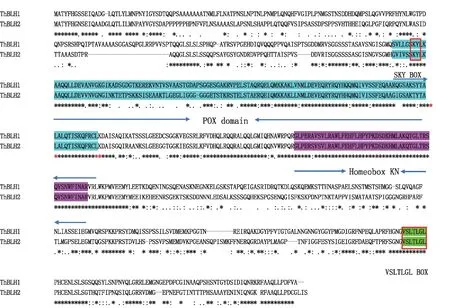
注:蓝色标注的氨基酸序列为POX结构域,标注红框的为SKY盒;紫色标注的氨基酸序列为同源结构域(Homeobox KN);绿色并标注红框的为VSLTLGL盒;*表示相同氨基酸序列。Note:Amino acids marked with blue is POX domain,red box shows SKY box;Amino acids marked with purple is Homeobox KN;Amino acids marked with blue and in the red box is VSLTLGL box; *shows the same amino acid.图2 ThBLH1及ThBLH2蛋白质序列多重比较及保守域分析Fig.2 Multiple alignment and conserved domain analysis of ThBLH1 and ThBLH2 protein sequence

注:标尺表示遗传进化距离;黑色圆点表示三叶青的ThBLH序列;括号中的内容代表蛋白序列ID。Note:The bar shows the evolutionary distance; The black circle indicates the ThBLH sequence. The content in the brackets represents the protein sequence ID numbers.图3 ThBLH1及ThBLH2蛋白进化树的构建Fig.3 Phylogenetic tree construction of ThBLH1 and ThBLH2
2.2 三叶青ThBLH基因克隆
对转录因子ThBLH基因的cDNA序列扩增,凝胶电泳结果显示(图4),ThBLH1(2 401 bp)、ThBLH2(2 299 bp)扩增产物大小与预期接近。测序得到的碱基序列与前期获得的转录组序列碱基差异较小,通过特异引物克隆得到的ThBLH序列与转录组中cDNA序列一致性在99.99%以上。

注:M: DL5000 Maker; 1:ThBLH1扩增片段;2:ThBLH2扩增片段。Note: M: DL5000 Maker; 1: The Amplified fragment of ThBLH1 2: The Amplified fragment of ThBLH2.图4 PCR方法扩增ThBLH1(A)与ThBLH2(B)基因的产物电泳结果Fig.4 The agarose electrophoresis of amplifying ThBLH1 (A)and ThBLH2(B) by PCR
2.3 三叶青块根发育不同时期ThBLH转录因子的表达模式分析
ThBLH1表达分析表明(图5),在三叶青块根Ⅲ期中ThBLH1相对表达量最高且与Ⅰ期、Ⅱ期及Ⅳ期呈显著差异,Ⅰ期、Ⅱ期及Ⅳ期间该基因相对表达量差异不显著;ThBLH2相对表达量从低到高依次为Ⅱ期、Ⅲ期、Ⅰ期及Ⅳ期,其中在Ⅱ期及Ⅲ期间差异不显著,Ⅱ期相对表达量显著高于Ⅰ期及Ⅳ期,但Ⅱ期相对表达量差异与Ⅲ期不显著,Ⅳ期中该基因相对表达量显著低于其他时期。上述分析表明三叶青块根中(块根及初始膨大块根)ThBLH1与ThBLH2基因相对表达量显著高于纤维根。

注:Ⅰ,不具有块根的植株的纤维根;Ⅱ,初始膨大的块根;Ⅲ,块根;Ⅳ,具有块根植株的纤维根;显著性水平P<0.05。Note:Ⅰ. The fibrous roots of plant without tuber;Ⅱ. Initially expanded tuber;Ⅲ. Tuber;Ⅳ. The fibrous roots of plant with tuber; The significance level was P<0.05.图5 三叶青块根发育不同时期ThBLH1(A)与ThBLH2(B)基因的相对表达量Fig.5 The relative expression of ThBLH1(A)and ThBLH2(B)in different development stage of root tuber
2.4 不同光周期处理下ThBLH转录因子的表达模式分析
不同光周期处理下ThBLH1的不同时间点的表达分析表明(图6-A),除次日8:00以外,SD处理下该基因相对表达量显著高于LD、CO处理及CK,而在次日8:00时SD处理下该基因相对表达量显著高于CO处理及CK但与LD差异不显著。ThBLH2在不同光周期处理下表达特征表明(图6-B),SD处理下ThBLH2基因相对表达量在20:00—次日8:00显著高于CK,在12:00时其相对表达量与LD及CO差别不显著,在20:00时与CO差别不显著但显著高于LD;在次日0:00—次日4:00时CO相对表达量显著提高且显著高于其他处理,其他处理间则差异不显著。不同光周期处理中CK及LD处理下ThBLH1在各时间点呈低水平表达,而ThBLH2在SD及CO处理分别在20:00及次日4:00有表达高峰。
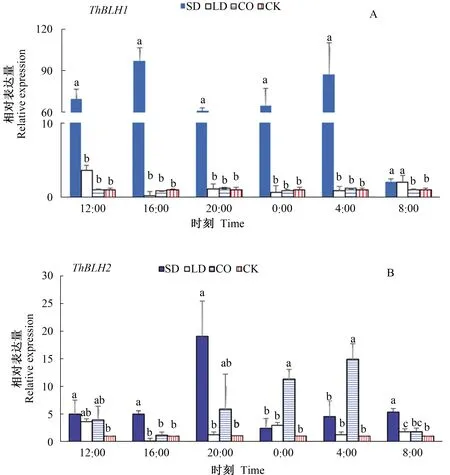
注:显著性水平P<0.05。Note:The significance level was P<0.05.图6 不同光周期处理下ThBLH1(A)与ThBLH2(B)基因的相对表达量Fig.6 The relative expression of ThBLH1(A) and ThBLH2(B) under different photoperiods treatments
2.5 不同光质补充光照处理下ThBLH1及ThBLH2在叶片及块根中的表达特征
为了研究ThBLH1及ThBLH2对光质信号的响应,对不同光质处理下叶片及块根中2个ThBLH基因相对表达量进行了分析。如图7所示,在红光处理下叶片中ThBLH1相对表达量最高且显著高于其他平行其他光质处理,白光处理下ThBLH1相对表达量与CK无显著差异但显著高于蓝光,蓝光处理下该基因相对表达量与CK无显著差异;而块根中蓝光处理下ThBLH1相对表达量显著低于其他处理,其他3个处理间表达差异不显著。对不同光质处理下ThBLH2相对表达量分析表明,叶片中该基因相对表达量在各光质处理间差异不显著,块根中白光处理下该基因相对表达量显著高于其他处理,其他处理间相对表达量差异不显著。无论叶片还是块根中蓝光处理后ThBLH1相对表达量较低,而ThBLH2相对表达量只有在块根中白光处理后显著高于其他处理,其他处理间无差异。
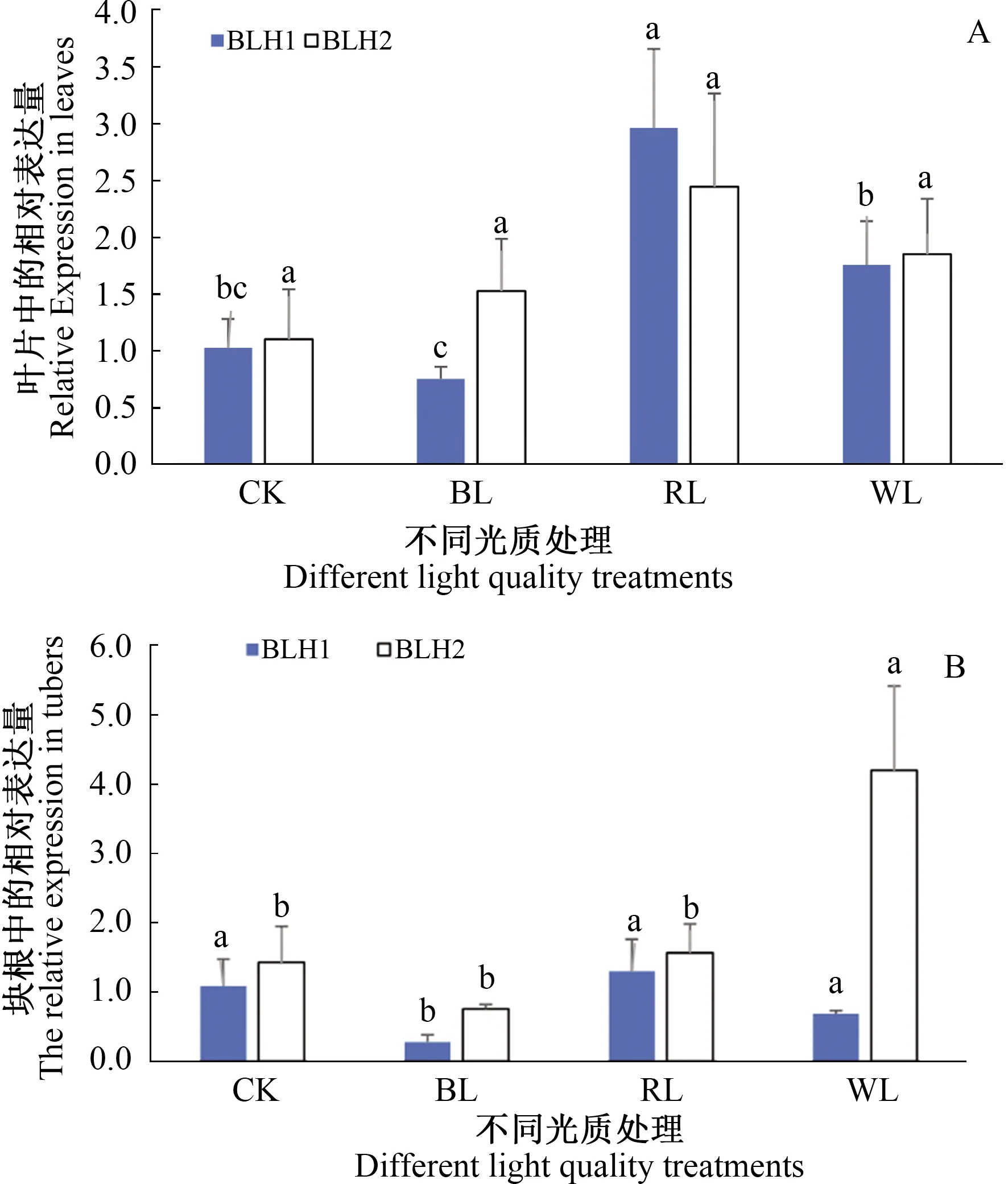
注:A.不同光质处理下ThBLH1及ThBLH2在叶片中相对表达量;B.不同光质处理下ThBLH1及ThBLH2在块根中相对表达量;CK.对照;BL.蓝光处理;RL.红光处理;WL.白光处理;显著性水平P<0.05。Note:A. Expression of ThBLH1 and ThBLH2 in leaves under different light quality treatment conditions;B. Expression of ThBLH1 and ThBLH2 in tuber under different light quality treatment conditions; CK. control; BL. blue light treatment; RL.red light treatment; WL, white light treatment; The significance level was P<0.05.图7 不同光质补充光照处理下ThBLH1及ThBLH2在叶片及块根中的表达特征Fig.7 The expression profiles of ThBLH1 and ThBLH2 under different light quality illumination supplement
3 结论与讨论
本研究中克隆的2个ThBLH的cDNA推测的蛋白保守域分析表明,ThBLH1与ThBLH2蛋白都具有POX domain及Homeodomain保守序列,POX domain的功能还是未知的,而Homeodomain KN是与DNA结合的主要位点,ThBLH是DNA结合蛋白[20]。目前,关于光周期与BELL基因家族在地下储藏器官中关系的研究仅限于马铃薯,其中,发现3个与块茎形成相关的StBEL基因,StBEL5对马铃薯块茎的形成具有促进作用,而StBEL11及StBEL29对块茎的形成及生长起到抑制作用[21]。另外,马铃薯的StBEL5及其Knox蛋白伴侣POTH1,通过调控激素水平从而介导匍匐茎中块根的形成[22]。而本研究中的ThBLH与StBEL基因属于同源结构基因,相对表达量分析表明ThBLH1在块根中的表达水平显著高于其他块根发育时期,而ThBLH2的表达水平在块根的初始膨大期及显著高于纤维根状态,说明ThBLH基因可能在块根形成中起到一定作用,这与马铃薯的情况类似。LIU等[23]研究表明,拟南芥的AtBLH6特异的与KNAT7组成复合蛋白通过调控拟南芥木质素合成基因的表达参与到次级细胞壁的建成中,从而对拟南芥的生长起到促进作用。但这2个ThBLH基因在三叶青块根发育中的具体功能还未明确,需要通过基因功能验证试验进一步证实。
模式植物马铃薯的StBEL5基因的研究表明,其5’UTR的启动子区具有大量的保守的光反应原件如GT1、GATA和AT1基元[24],推测该类转录因子基因的表达受光的调控。本研究团队前期的测产研究表明,短日处理下三叶青块根产量的最低[18],而在本研究结果中短日处理下叶片中ThBLH1相对表达量在显著高于其他处理,这与光周期所调控块根产量形成呈负相关性,因此该基因在光周期所调控的三叶青块根膨大中的功能还需要进一步的转基因试验证实。
目前,BLH类转录因子的表达与光质之间研究较少,光周期所介导的StBEL5的转录水平被白光及红光促进[25]。本研究显示,叶片中红光处理下ThBLH1相对表达量最高,而白光显著提高了ThBLH2在块根中相对表达量,与以上研究结果类似。本研究中蓝光处理下可显著抑制ThBLH1基因在叶片及块根中的表达。前期测产实验表明蓝光和红光补充光照都可以提高三叶青块根产量[18],而蓝光处理下ThBLH1基因相对表达量与块根产量表现出负相关。
本研究中ThBLH类转录因子相对表达量与块根膨大呈现出一定的正相关趋势,但在光周期及光质处理下该转录因子相对表达量与块根产量增加呈负相关趋势。由于本研究只对该基因在块根发育不同阶段、不同光周期处理及光质处理下ThBLH1与ThBLH2相对表达量进行了分析,很难直接判断该基因与块根膨大的相关性。植物地下储藏器官发育过程是复杂的生物学过程,其中不仅包括淀粉、糖的积累,还包括许多次生代谢产物如黄酮类化合物、乙酸乙酯、酚酸类化合物等次生代谢产物[26],而ThBLH类转录因子又是植物体内普遍存在的转录因子,其受光信号调控及如何作用于下游相关分子通路的分子机制还需要进一步研究。本研究结果通过初步明确了ThBLH1及ThBLH2的生物学信息学特征,并分析了光质及光周期信号对这2个转录因子表达的影响,为进一步认识ThBLH转录因子在块根发育中的生物学功能提供了初步的分子生物学参考。

