冬小麦对不同镉浓度的响应及镉吸收和亚细胞分布特点研究
秦世玉,刘红恩,梅浩,李艳行,高巍,聂兆君,李畅,赵鹏
(河南农业大学资源与环境学院/河南省土壤污染防控与修复重点实验室,河南 郑州 450002)
镉(Cd)是植物生长非必需且具有较强毒害的元素,在植物体内积累到一定浓度后对不同组织和器官引起毒害症状,进而抑制植物生长和发育。研究表明,植物受到镉毒害后一般会引起根系活力降低、植物体内氧化还原失衡、光合作用降低,从而抑制植物根系生长与矿质元素的吸收,致使叶片发黄缩卷等生长不良症状,严重者可导致植物死亡[1]。植物自身具有一些列调节措施可降低镉毒害。通过根系分泌物降低根际镉活性,减少根系对镉的吸收,降低根系镉向地上部的转运,与细胞液中的植物螯合素或金属硫蛋白络合将更多的镉区室化到液泡部位,提高抗氧化物酶活性来清除镉胁迫产生的活性氧(超氧化物阴离子、羟自由基、过氧化氢),这些植物对镉的响应也是缓解镉毒害的主要机制[2-3]。
到目前为止,越来越多的镉转运基因被发现。镉从土壤转运到作物子粒包括根部吸收、不同亚细胞储存、木质部向地上部转运、地上部镉迁移到子粒等几个关键步骤,而不同的过程均有相关的基因参与[4]。例如OsNramp5和HvNramp5参与根系对镉的吸收[5-6]。OsHMA3参与根系细胞中镉向液泡中的转运[7],OsHMA2则参与调控镉在木质部装载向地上部运输[8-9],另外OsZIP7和OsCAL1也参与镉向地上部的转运[10-11]。OsHMA2、OsLCT1、OsZIP7和OsCCX2参与了地上部镉向子粒的迁移[11-14]。
近年来,研究发现小麦种植区域土壤重金属镉含量超标严重,同时引起小麦子粒镉含量超标现象也较为严重[15-16]。苗期镉吸收与成熟期子粒镉积累具有显著的正相关性关系[17],且前期研究发现,污染土壤上冬小麦在整个生育期都存在镉吸收的情况,且子粒镉含量很容易超过食品中镉限量标准(0.1 mg·kg-1,GB 2762—2005)。因此,本研究以苗期小麦为材料,通过不同镉浓度胁迫探究冬小麦生长、镉吸收转运和亚细胞分布,以期探明冬小麦对镉的吸收分布特征。
1 材料与方法
1.1 试验设计
试验供试冬小麦品种为百农207。选取饱满均匀一致的种子,1% NaClO消毒15 min,然后用去离子水洗净后均匀摆放到育苗盘(长×宽×高:29 cm×24 cm×6 cm)。避光催芽,育苗7 d后,挑选10株长势一致的幼苗转移到含营养液的培养盘(长×宽×高:22 cm×14 cm×7 cm)中培养,光照培养室参数为温度(25±2)℃,湿度75%,光强度180 μmol·m-2·s-1,光/暗时间14/8 h。营养液浓度为:4.0 mmol·L-1Ca(NO3)2·4H2O,6.0 mmol·L-1KNO3,1 mmol·L-1NaH2PO4·2H2O,2.0 mmol·L-1MgSO4·7H2O,100 μmol·L-1EDTA-Fe,46.2 μmol·L-1H3BO3,9.1 μmol·L-1MnCl2·4H2O,0.3 μmol·L-1CuSO4·5H2O,0.8 μmol·L-1ZnSO4·7H2O 和0.2 μmol·L-1(NH4)6Mo7O24·4H2O。1/2营养液浓度培养第一周,随后全营养液浓度培养,并设置0、5、50 μmol·L-13个Cd浓度,Cd源为CdCl2·2.5H2O。试验所涉及试剂均为分析纯和去离子水。每个处理4次重复,4 d换1次营养液。胁迫生长至23 d,分根系和地上部收获小麦幼苗,测定生理指标和镉元素含量。
1.2 测定方法
1.2.1 根系形态测定 根系形态参数包括总根长、总根系表面积、平均直径、总根系体积、总根尖数,测定方法参考秦世玉等[18],具体步骤如下:取收获小麦幼苗1株,用干净剪刀减掉根系,然后将根系浸泡到装有去离子水的三角瓶中。用根系扫描仪(WinRHIZO 2009,Canada)对根系扫描成像,ImageJ软件分析计算总根长、总根系表面积、平均直径、总根系体积、总根尖数。
1.2.2 叶绿素含量测定 叶绿素含量测定参考李合生等[19]的方法,具体步骤:取小麦新鲜叶片样品,剪碎混匀后称取0.25 g,共3份,加入体积分数95%乙醇25 mL避光室温浸提48 h。用紫外分光光度计(TU-1901,北京,中国)测定过滤液在波长665、649和470 nm下吸光度。
1.2.3 光合参数测定 样品收获前用便携式光合测定仪(Li-6400P,Li-Cor,USA)测定净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)和胞间二氧化碳浓度(Ci)等光合参数。光合测定仪采用LED光源,并进行光源矫正,光强设置为饱和光强度(约为1 200 μmol·m-2·s-1),重复2次取平均值。
1.2.4 镉的亚细胞分布 细胞壁、细胞器和细胞液组分通过差速离心法进行分离:称新鲜叶片1 g,放入预冷的研钵中,加入12 mL缓冲液,研磨成匀浆后用高速冷冻离心机(Eppendorf 5810 R,德国)2 057×g离心10 min,沉淀物为细胞壁及细胞壁组分。上清液转移到新的离心管后12 857×g离心50 min,沉淀物为细胞器组分,上清液为胞液。缓冲液组分为:250 mmol·L-1蔗糖、50 mmol·L-1tris-HCl (pH 7.5)、1 mml·L-1MgCl2和10 mmol·L-1半胱氨酸。所有操作在低温条件下进行。
1.2.5 Cd 含量测定 将一部分鲜样105 ℃杀青30 min,70 ℃烘干至质量恒定,粉碎干样后称取0.100 0 g左右样品。亚细胞组分电炉烘至微干。所有样品均加入5 mL HNO3-HClO4混酸(4∶1,v/v)进行消化。消煮完全后过滤定容,原子吸收分光光度计(ZEEnit 700; Analytik Jena AG,Germany)测定样品Cd 含量。Cd迁移系数=地上部Cd含量(mg·kg-1)/根部镉含量(mg·kg-1)。
1.3 数据处理
所有数据采用Excel 2007和SPSS 20.0(IBM,SPSS Statisitcs,V20.0)软件进行处理和统计分析,处理间比较采用单因素方差分析,各处理平均数采用最小显著差数(LSD)法在0.05显著水平下进行多重比较。SigmaPlot 12.0作图。
2 结果与分析
2.1 不同浓度镉处理对小麦生长的影响
如图所示,从形态上可以看出镉处理显著抑制冬小麦根和地上部的长度(图1-a,b)。从生物量积累情况可以看出,相对于Cd0处理,Cd5和Cd50处理小麦鲜重分布降低了40.19%和67.29%(图1-c),小麦干物质重分别降低29.31%和51.65%(图1-d)。另外,相对于Cd0处理,Cd5和Cd50处理显著降低了小麦的单株含水量,降低幅度分别为2.23%和5.80%(图1-e)。说明镉抑制了冬小麦生物量的积累,且高浓度镉抑制更显著。
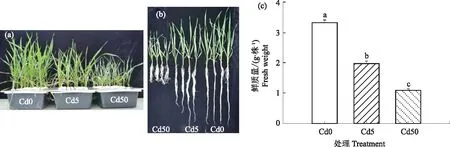

注:不同字母表示处理间差异显著(P<0.05)。下同。Note:Different letters indicate the significant differences among treatments(P<0.05).The same as below.图1 不同镉处理下冬小麦生长状况(a)、鲜质量(b)、干质量(c)和含水量(d)Fig.1 The growth status (a),fresh weight (b),dry weight (c) and water content (d) of winter wheat under different Cd treatments
2.2 不同浓度镉处理对小麦根系生长的影响
通过分析根系形态参数同样发现,镉显著影响到根系发育,且高浓度镉影响更显著(图2)。相对于不施镉处理(Cd0),Cd5和Cd50处理下总根长分别减少27.82%(P<0.05)和70.19%(P<0.05);总根表面积分别降低23.27%和64.23%(P<0.05);根直径分别增加4.59%和15.68%(P<0.05);根体积分别减少18.82%和57.16%(P<0.05);根尖数分别减少53.60%(P<0.05)和67.83%(P<0.05)(表1)。说明施镉通过降低根系伸长、增粗及侧根生长进而影响根系发育。

图2 不同浓度镉处理条件下根系扫描图像(a,不施镉;b,Cd5处理;c,Cd50处理)Fig.2 The root scanning images under different Cd concentrations (a,without Cd; b,Cd5 treatment; c,Cd50 treatment)

表1 不同浓度镉处理条件下根系参数Table 1 The root parameters under different Cd concentrations
2.3 不同浓度镉处理对小麦叶片叶绿素含量和光合参数的影响
不同浓度镉对叶片色素(叶绿素a、叶绿素b、类胡萝卜素及总叶绿素含量)含量及光合参数(光合速度、气孔导度、胞间二氧化碳浓度、蒸腾速率)的影响如表2,结果显示相对于不施镉处理,施镉对色素含量及光合参数(蒸腾速率除外)没有显著影响。然而随镉浓度增加叶绿素a、叶绿素b含量呈增加趋势,且总叶绿素含量在Cd50处理下具有最大值。另外,蒸腾速率也随着镉溶度增高而显著提高,Cd5和Cd50处理下提高幅度分别为27.52%和25.06%。色素含量及光合蒸腾速率的增加可能是缓解镉毒害的生理响应。
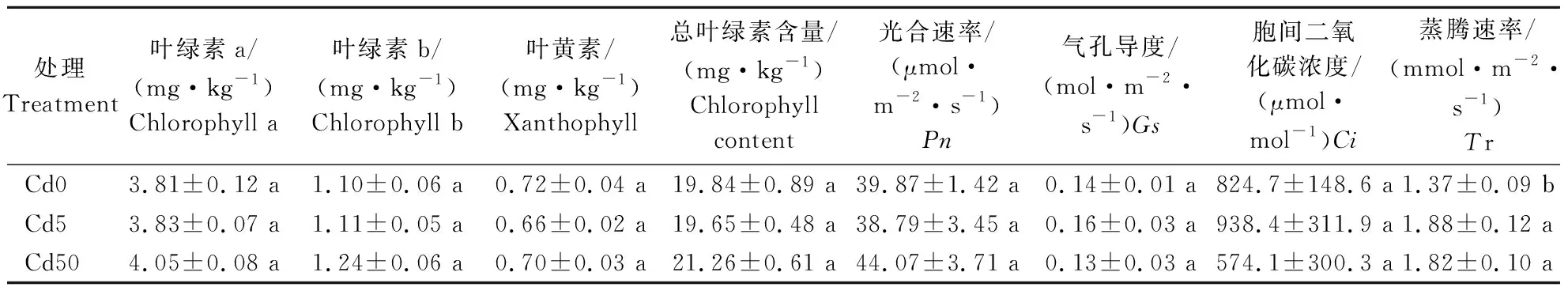
表2 不同镉浓度处理条件下叶片色素含量和光合参数Table 2 The leaf pigment concentrations and photosynthetic parameters under different Cd concentrations
2.4 不同镉浓度处理对小麦镉含量的影响
随着镉浓度的增加,冬小麦根系和地上部镉含量均呈增加趋势(图3)。Cd5和Cd50处理条件下根部镉含量分别为786.23和1 294.33 mg·kg-1,地上部镉含量分别为94.6和211.0 mg·kg-1。说明冬小麦随着镉处理浓度的提高而增加对镉的吸收,且根部具有更高的镉积累。进一步分析镉在小麦中的迁移系数发现,Cd5和Cd50处理条件下镉的迁移系数分别为0.122和0.161,说明随着镉浓度的增加提高了镉在小麦体内的迁移,而低的迁移系数同样也说明了镉在小麦体内具有低的向地上部迁移能力。
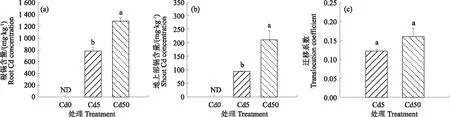
图3 不同镉处理条件下根部镉含量(a)、地上部镉含量(b)和迁移系数(c)Fig.3 Cadmium concentrations in root (a),shoot (b) and migration coefficient (c) under different Cd treatments
2.5 不同镉浓度处理对小麦镉的亚细胞分布的影响
不同亚细胞组分镉含量如图4。结果表明,随着镉浓度的增加根系和地上部不同亚细胞组分镉含量均呈增加趋势。Cd5和Cd50处理条件下地上部细胞壁组分镉含量分别为47.03和92.79 mg·kg-1,细胞器组分镉含量分别为7.58和13.54 mg·kg-1,细胞液组分镉含量分别为114.18和246.13 mg·kg-1; Cd5和Cd50处理条件下根部细胞壁组分镉含量分别为172.58和321.05 mg·kg-1,细胞器组分镉含量分别为38.88和44.63 mg·kg-1,细胞液组分镉含量分别为732.7和1 209.42 mg·kg-1。不同亚细胞组分镉含量数据表明镉含量分布具有以下趋势:根部>地上部,可溶性组分>细胞壁组分>细胞器组分。

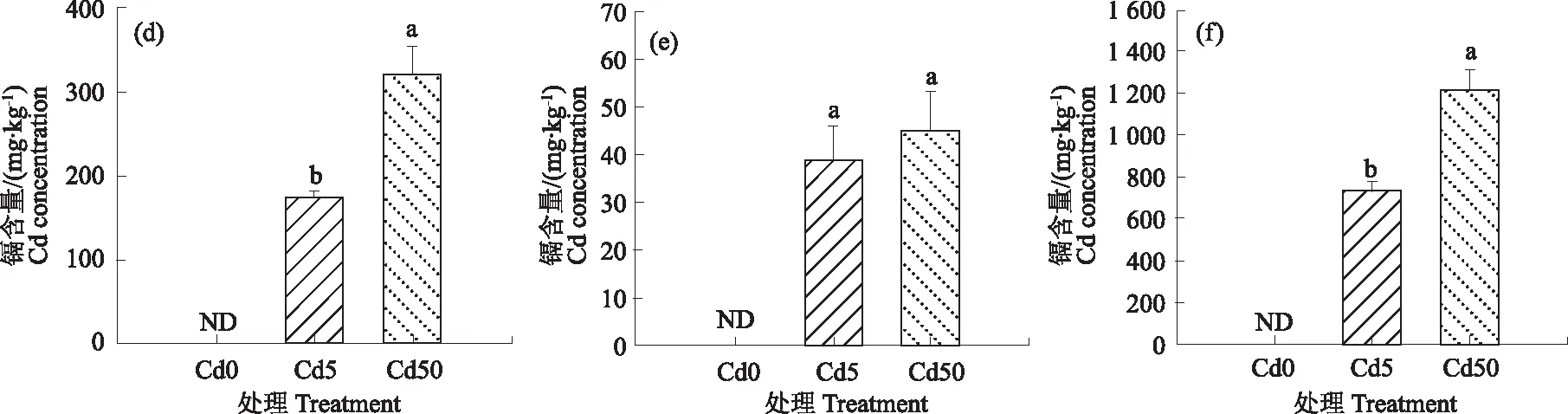
图4 不同镉处理条件下地上部亚细胞组分镉含量(a细胞壁组分、b细胞器组分、c可溶性组分)和根部亚细胞组分镉含量(d细胞壁组分、e细胞器组分、f可溶性组分)Fig.4 The Cd concentrations of subcellular components (a cell wall component,b organelle component,c soluble component) in shoot and root (d cell wall component,e organelle component,fsoluble component) under different Cd treatments
进一步分析不同亚细胞组分镉含量比例,同样可以发现具有可溶组分>细胞壁组分>细胞器组分的趋势(图5)。在根部,随着镉浓度的增加细胞壁组分镉含量显著增加,细胞液组分和细胞器组分镉含量呈下降趋势。而镉浓度的增加对地上部不同细胞器组分镉含量比例影响不大。

图5 不同镉处理条件下地上部(A)和根部(B)亚细胞组分镉含量比例Fig.5 The percentage of Cd concentration in subcellular components of shoot (A) and root (B) under different Cd treatments
3 讨论
3.1 镉对冬小麦生长的影响
镉是毒性较强的元素,植物吸收镉危害植物的生长、产量和品质。其中干物质积累量是植物光合作用和营养吸收等生长的综合体现,也是产量高低的养分库。本研究中相对于Cd0,Cd5和C50处理下鲜质量、干质量和含水率均显著降低,且高浓度处理降低幅度更大,说明镉作为植物毒害元素抑制植物干物质的积累和水分吸收。根系作为植物吸收营养元素的器官,同时也是吸收重金属的主要部位。因此,根系参数的变化也说明了镉对植物的胁迫程度。本研究发现施镉抑制小麦总根长、总根表面积、根体积和根尖数,增加了根系直径。表明施镉通过降低根系伸长、增粗及侧根生长进而影响根系发育。研究表明,镉对根系的毒害主要是镉胁迫后产生的过氧化物对根细胞核仁产生毒害,抑制核糖核酸酶的活性,改变RNA合成等途径抑制根系伸长,使根系细胞老化[20]。而根直径的增加可能与Cd处理可诱导小麦幼苗根系皮层细胞增多、薄壁细胞增大以及内皮层细胞壁木质素的沉积有关[21]。另外,研究发现镉处理可显著降低水稻幼苗光合作用,且随镉浓度增加水稻幼苗净光合速率(Pn),气孔导度(Gs),蒸腾速率(Tr),气孔限制值(Ls)逐步下降[22]。在本研究中发现镉胁迫有提高冬小麦光合素色及光合参数的趋势,但没有达到显著水平,这可能与不同作物对镉的耐性和生理响应存在差异有一定关系。
3.2 冬小麦镉吸收分布特征分析
一般条件下,小麦体内镉含量随根系环境镉含量增高而增高,不同器官具有不同的镉贮存能力,小麦各部位镉富集系数大小顺序为根>叶>茎>子粒[22-23]。本研究中植物体内镉含量随处理镉浓度增高而增高。其中根部镉浓度在Cd50处理下高达1 294.33 mg·kg-1,是地上部镉含量(211.0 mg·kg-1)的6倍多。说明冬小麦在镉吸收过程中将更多的镉截留在根部,降低镉向地上部的迁移。进一步分析Cd5和Cd50处理条件下镉的迁移系数也发现,在小麦中镉具有较低的迁移系数(分别为0.122和0.161)。李乐乐等[23]对47个冬小麦品种镉吸收分析发现,转运系数介于0.10~0.60之间。说明冬小麦对镉的迁移与品种有一定的关系,也可能与根系细胞细胞壁阻控和液泡贮存及根系向木质部装载有关[24-25]。进一步分析不同亚细胞组分镉含量及镉积累量比例发现,镉浓度的增加对地上部不同细胞器组分镉含量比例影响不大,根系和地上部不同亚细胞组分镉含量都随镉处理浓度增加而增加,且不同亚细胞组分镉含量数据可以看出根部>地上部,可溶性组分>细胞壁组分>细胞器组分。细胞壁作为镉进入植物细胞内的第一道屏障,且细胞壁富含亲镉物质和阳离子交换位点,使镉能够固定在细胞壁上。镉在液泡的贮存能够防止细胞质中过多的镉对植物细胞器官造成损害,同时也可以防止镉向地上部的转运。因此细胞壁组分对镉的吸附和液泡对镉的贮存可有效降低镉对植物生长的伤害,也是降低冬小麦子粒镉积累的有效措施[26]。
4 结论
镉显著抑制生物量和根系参数的生长,且高浓度镉抑制效果更明显。不同部位镉含量分析表明冬小麦大量镉阻控在根系,降低镉向地上部的迁移,减轻镉对地上部的毒害及向子粒的富集。不同亚细胞组分镉含量分析发现小麦吸收更多的镉分布在可溶性组分(液泡部位)和细胞壁组分,通过将镉合理的区室化进而降低镉对细胞器官的伤害。总之,镉作为重金属对植物生长产生胁迫效应,而植物则可以通过优化镉的吸收和分配来降低毒害效应。
——可作为磷酸盐库再利用!

