桂枝加葛根汤通过SDF-1/CXCR4信号轴改善大鼠椎间盘终板软骨细胞退变的研究*
蒋伟,王镌,任政
(1.新疆医科大学第六附属医院创伤骨科,乌鲁木齐 830002;2.新疆医科大学第六附属医院中医科,乌鲁木齐 830002)
目前,随着全球人口老龄化以及生活节奏的加快,颈背部疼痛严重影响了人们的日常生活质量,甚至导致残疾发生,给社会带来了沉重的经济负担[1-2]。而椎间盘退变是引起颈背部疼痛的主要病因,其起源于终板软骨,终板软骨对于椎间盘的营养供应、代谢过程以及功能维持等方面均发挥重要作用[3]。终板软骨由终板软骨细胞组成,作为终板软骨中唯一的细胞类型,其在细胞外基质的合成与分解中起到主要的调控作用[4],研究终板软骨细胞行为学变化对于椎间盘退变意义重大。
桂枝加葛根汤来源于《伤寒论》,是治疗太阳中风证的经典方剂,已有研究表明,其具有镇痛、减轻局部炎性肿胀的作用[5],此外,对于薄型子宫内膜所致的月经过少具有良好的治疗效果[6]。根据桂枝加葛根汤的改善血液流变学、扩充血管、调节平滑肌活动等药理作用,并能够明显缓解神经根型颈椎病大鼠的疼痛[7],目前已将其运用于颈椎病、肩周炎、落枕等临床治疗当中,但其相关的作用机制尚未完全明确。基质细胞衍生因子1(SDF-1)/CXC趋化因子受体4(CXCR4)参与炎症反应、癌性骨痛、术后疼痛等一系列生理生化和病理过程,关于该信号轴在椎间盘方面的作用研究也已有报道,通过阻断SDF-1/CXCR4信号通路可促进软骨终板细胞增殖和基质形成,抑制软骨终板细胞凋亡,对椎间盘退变具有一定的治疗作用[8]。因此,本文通过观察桂枝加葛根汤含药血清对体外力学刺激诱导的大鼠椎间盘终板软骨细胞退变中的作用,并探讨其可能机制,以期在临床用药中更加有效的发挥作用。
1 材料与方法
1.1 主要材料与试剂 健康清洁级SD雄性大鼠,体质量(180±20)g,由新疆医科大学实验动物中心提供,生产批号:SCXK(新)2018-0002,本研究获得医院动物伦理委员会的批准。Ⅱ型胶原酶购自美国Sigma公司,胎牛血清与DMEM/F12培养液购自美国 Gibco公司,CCK-8试剂盒、BCA试剂盒和Annexin V-FITC/PI试剂盒购自上海碧云天公司,鬼笔环肽试剂购自上海翊圣生物公司,化学发光液ECL、甲苯胺蓝试剂和免疫荧光染色试剂购自北京索莱宝生物公司,Trizol试剂、cDNA试剂盒与SYBR Premix Ex TaqTM II试剂盒购自日本TaKaRa公司,BioFlex TM 6孔板购自美国 Flexcell公司,抗体CXCR4、COL2A1、SOX9、GAPDH 购自英国 Abcam公司,HRP标记山羊抗兔购自北京博奥森生物技术有限公司。
1.2 大鼠终板软骨细胞的分离培养 参考文献[9]方法分离大鼠终板软骨细胞,取5只健康清洁级SD大鼠,处死后使用75%乙醇全身消毒,并在无菌条件下取出胸腰段脊柱,剔除附着韧带与其他组织,分离终板软骨,使用磷酸缓冲盐溶液(PBS)清洗,并剪成碎片,加入0.25%的胰蛋白酶消化30 min,接着加入0.3%Ⅱ型胶原酶消化1 h。收集悬液,以1 000 r/min(离心半径为10 cm)离心5 min,去消化液,PBS清洗后,加入含10%胎牛血清的DMEM/F12培养液重悬细胞,接种于无菌培养皿内,置于37℃、5%CO2培养箱内培养,每隔3 d换液1次,待细胞融合度达到80%以上时,按1∶3的比例进行传代。本研究使用第3代软骨细胞进行实验。
1.3 桂枝加葛根汤含药血清制备 桂枝加葛根汤按《伤寒论》原方(葛根 12 g,桂枝 9 g,芍药 9 g,生姜 9 g,甘草 6 g,大枣 12枚,麻黄 9 g)比例制备成0.5 g/mL的浓缩液,具体操作为:加水浸泡药物30 min,文火分别煎熬40 min和30 min,将两次的煎液混合后,以4 000 r/min(离心半径为10 cm)离心10 min,取浓缩的上清液,并保存于4℃冰箱。取10只SD大鼠,参考文献[10]方法给药,每只以4 mL的桂枝加葛根汤灌胃,每日1次,连续灌胃4 d,在末次灌胃2 h后,给予乙醚吸入麻醉,通过腹主动脉及心脏采血,分离血清,保存于-20℃冰箱。
1.4 大鼠终板软骨细胞体外力学诱导退变模型建立与处理 参考文献[11]方法诱导大鼠终板软骨细胞退变模型,取生长状态良好的终板软骨细胞,调整细胞密度以1×105个/孔接种至Ⅰ型胶原覆盖处理的6孔BioFlexTM加力板上,置于37℃、5%CO2培养箱内培养,待细胞融合度达到80%以上时,将细胞随机分为4组进行实验:对照组、模型组、桂枝加葛根汤组、桂枝加葛根汤+SDF-1α组。桂枝加葛根汤组细胞在力学刺激前使用制备的桂枝加葛根汤含药血清处理细胞24 h,桂枝加葛根汤+SDF-1α组细胞使用桂枝加葛根汤含药血清和含100 μg/L SDF-1α无血清培养液处理细胞24 h。除对照组外,其余各组细胞在 37℃、5%CO2培养箱内通过Flexcell FX-5000TM细胞应力加载系统给予力学刺激(0.5 Hz,10%伸长率,8 h/d),过程中对照组细胞正常培养,不进行任何处理。
1.5 CCK-8法检测终板软骨细胞活性 收集处理后的各组终板软骨细胞,按1×105个/孔的密度接种至96孔细胞培养板中,置于37℃、5%CO2培养箱内培养,分别在培养12、24、48、72 h后,每孔加入10 μL CCK-8试剂,在培养箱中继续孵育2 h后,采用酶标仪测定波长450 nm处吸光度值,每个样本设置3个复孔。
1.6 流式细胞术检测终板软骨细胞凋亡 收集处理后的各组终板软骨细胞,将细胞消化离心后,使用Annexin V-FITC结合缓冲液重悬细胞,再在细胞悬浮液中加入5 μL的Annexin V-FITC轻轻混匀,接着加入10 μL的碘化丙啶染色液,在25℃室温下避光孵育30 min,通过流式细胞仪检测细胞染色情况,利用Flow JO软件分析终板软骨细胞的凋亡情况,实验独立重复3次。
1.7 细胞染色 1)甲苯胺蓝染色检测终板软骨细胞形态变化:收集处理后的各组终板软骨细胞,调整密度为2×104个/mL,取100 μL铺在装有盖玻片的6孔板中,当细胞融合达到80%~90%时,移去盖玻片,将细胞采用4%多聚甲醛溶液固定30 min,PBS清洗,每孔加入2 mL 1%甲苯胺蓝染色1 h,洗去多余染料,在荧光显微镜下观察并拍照。2)鬼笔环肽染色检测终板软骨细胞形态变化:将各组细胞使用4%多聚甲醛溶液室温固定30 min,PBS清洗,加入0.3%Triton X-100透膜处理10 min,接着添加100 μL鬼笔环肽溶液,在室温下避光孵育1 h,弃去溶液并使用PBS缓冲液清洗,添加100 μL DAPI,室温下避光孵育5 min,PBS再次清洗后,采用激光共聚焦显微镜下观察细胞中F-actin变化并拍照。3)免疫荧光染色检测终板软骨细胞CXCR4表达:将各组细胞使用4%多聚甲醛溶液室温固定30 min,PBS清洗,滴加0.3%TritonX-100透膜处理10 min,加入10%山羊血清室温封闭2 h后,滴加CXCR4(1∶200)一抗,4℃下孵育过夜,次日弃去一抗,滴加荧光二抗,室温避光孵育1 h后,PBS再次清洗,滴加DAPI室温染色10 min,PBS洗涤后封片,在荧光显微镜下观察CXCR4阳性表达并拍照。
1.8 蛋白免疫印迹法(Western blot)检测终板软骨细胞COL2A1、SOX9蛋白表达 收集处理后的各组终板软骨细胞,加入RIPA缓冲液裂解细胞,4℃下以12 000 r/min(离心半径10 cm)离心10 min,收集上清,BCA试剂盒测定提取蛋白浓度。取50 μg蛋白进行10%SDS-PAGE电泳,将分离的蛋白电转移至PVDF膜上,加入5%脱脂奶粉封闭2 h,TBST溶液清洗膜后,加入稀释的一抗COL2A1(1∶1 000)、SOX9(1∶1 000),在 4 ℃下孵育过夜,TBST 溶液清洗膜,加入稀释的HRP标记山羊抗兔(1∶5 000)为二抗,室温孵育1 h,TBST再次洗膜后,滴加发光液ECL,凝胶成像系统中曝光、拍照,Quantity-One软件分析蛋白含量,并以GAPDH作为内参蛋白。
1.9 逆转录-聚合酶链式反应(qRT-PCR)检测终板软骨细胞COL2A1、SOX9 mRNA表达 收集处理后的各组终板软骨细胞,使用Trizol试剂提取各处理组细胞总RNA,紫外分光光度计检测总RNA浓度与纯度。通过反转录试剂盒对总RNA进行逆转录获得cDNA,按照SYBR Premix Ex TaqTM II试剂盒说明进行qRT-PCR反应,以β-Actin作为内参基因。反应条件为:95℃预变性3 min,循环1次;95℃变性20s,60℃退火15s,72℃延伸45s,循环40次。采用2-ΔΔCt法计算各基因mRNA相对表达量,实验重复3次。引物序列如下:COL2A1上游引物5'-CCTGAAACTCTGCCACCCAG-3',下游引物 5'-GTTCTTCCGAGGCACAGTCG-3';SOX9 上游引物5'-ATCTGAAGAAGGAGAGCGAG-3',下游引物5'-TCAGAAGTCTCCAGAGCTTG-3';β-actin 上游引物5'-ATCGTCCACCGCAAATGCTTCT-A-3',下游引物5'-AGCCATGCCAATCTCATCTTGTT-3'。
1.10 统计学方法 本研究实验结果采用SSPS23.0软件进行数据分析,计量资料用(±s)表示,多组间比较采用单因素方差分析,方差齐性检验采用Levene检验。以P<0.05为差异有统计学意义。
2 结果
2.1 桂枝加葛根汤对力学刺激下终板软骨细胞增殖活性的影响 CCK-8实验结果显示,在24、48、72 h时,力学刺激下的模型组终板软骨细胞增殖活性较对应时间点的对照组细胞增殖活性均显著下降(P<0.05);与模型组比较,桂枝加葛根汤组细胞增殖活性显著升高(P<0.05),而桂枝加葛根汤+SDF-1α组与模型组各时间点的增殖活性均无统计学差异(P>0.05)。见表1。
表1 各时间点下各组终板软骨细胞吸光度值比较(±s)Tab.1 Comparison of the absorbance values of endplate chondrocytes in each group at each time point(±s)
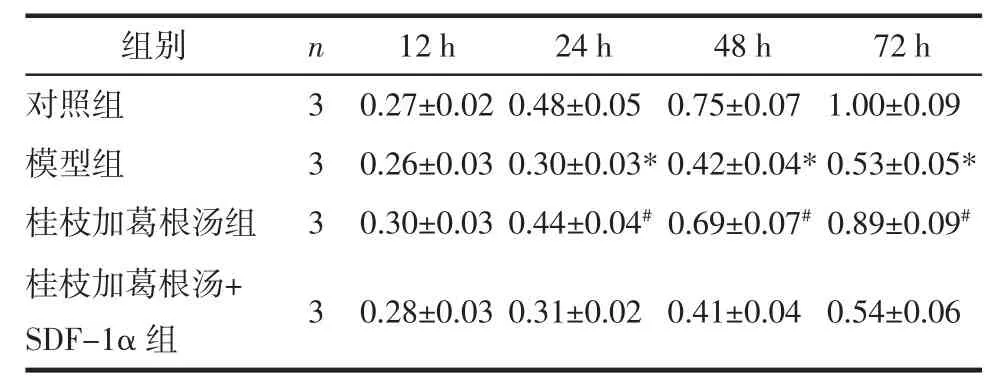
表1 各时间点下各组终板软骨细胞吸光度值比较(±s)Tab.1 Comparison of the absorbance values of endplate chondrocytes in each group at each time point(±s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
组别 n 12 h 24 h 48 h 72 h对照组 3 0.27±0.02 0.48±0.05 0.75±0.07 1.00±0.09模型组 3 0.26±0.03 0.30±0.03*0.42±0.04*0.53±0.05*桂枝加葛根汤组 3 0.30±0.03 0.44±0.04#0.69±0.07#0.89±0.09#桂枝加葛根汤+SDF-1α 组 3 0.28±0.03 0.31±0.02 0.41±0.04 0.54±0.06
2.2 桂枝加葛根汤对力学刺激下终板软骨细胞凋亡的影响 流式细胞术检测结果显示,模型组终板软骨细胞凋亡率较对照组显著增加(P<0.05);桂枝加葛根汤组细胞凋亡率较模型组显著减少(P<0.05),同时,桂枝加葛根汤+SDF-1α组与模型组的细胞凋亡率无统计学差异(P>0.05)。见图1。
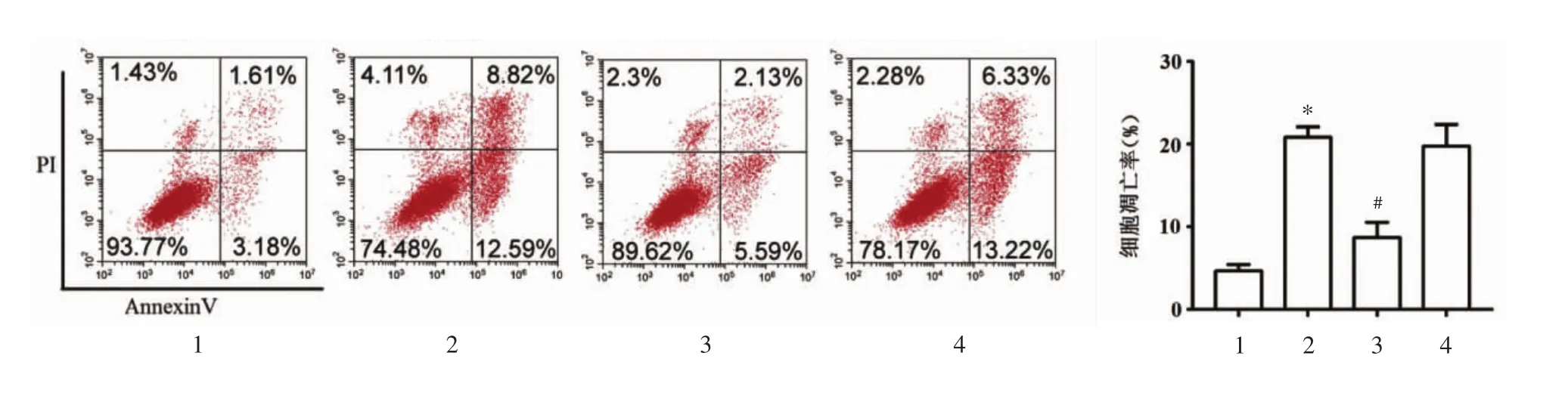
图1 流式细胞术检测各组终板软骨细胞凋亡情况(±s)Fig.1 Flow cytometry detection of endplate chondrocyte apoptosis in each group(±s)
2.3 桂枝加葛根汤对力学刺激下终板软骨细胞形态变化的影响 甲苯胺蓝染色后细胞核被染成深蓝色,细胞质被染成蓝色。对照组终板软骨细胞较短,细胞分布均匀,细胞核清晰,细胞外基质染色明显。模型组细胞形态发生明显变化,呈纺锤形,细胞核边界不清晰,细胞基质染色程度较轻。桂枝加葛根汤组细胞形态有所恢复,边界较为清楚,而桂枝加葛根汤+SDF-1α组细胞形态变化与模型组相似。见图2。

图2 甲苯胺蓝染色观察各组终板软骨细胞形态变化(×100)Fig.2 Toluidine blue staining to observe the morphological changes of endplate chondrocytes in each group(×100)
此外,鬼笔环肽染色结果显示,对照组终板软骨细胞呈多边形,模型组和桂枝加葛根汤+SDF-1α组细胞形态发生改变,由多边形变为纺锤状,可见细胞骨架明显拉长。桂枝加葛根汤组细胞形态有所恢复,细胞骨架拉伸较模型组缩短。见图3。

图3 鬼笔环肽染色观察各组终板软骨细胞形态变化(×200)Fig.3 Phalloidin staining to observe the morphological changes of endplate chondrocytes in each group(×200)
2.4 桂枝加葛根汤对力学刺激下终板软骨细胞中CXCR4表达的影响 免疫荧光染色结果显示,对照组终板软骨细胞中CXCR4阳性荧光表达较弱,模型组细胞中CXCR4阳性荧光表达较对照组明显增强。与模型组比较,桂枝加葛根汤组CXCR4阳性荧光表达明显减弱,而桂枝加葛根汤+SDF-1α组CXCR4阳性荧光表达与模型组比较,CXCR4阳性荧光表达无明显差异。见图4。
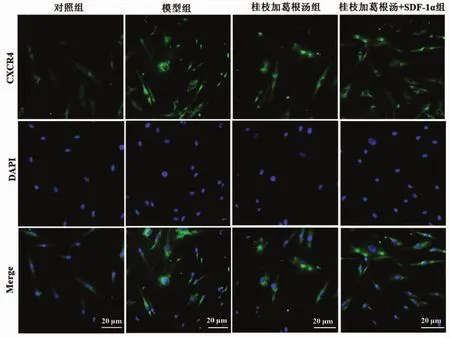
图4 免疫荧光染色检测各组终板软骨细胞中CXCR4表达(×100)Fig.4 Immunofluorescence staining to detect the expression of CXCR4 of endplate chondrocytes in each group(×100)
2.5 桂枝加葛根汤对力学刺激下终板软骨细胞中COL2A1、SOX9 mRNA与蛋白表达的影响 qRTPCR和Western blot实验结果显示,与对照组比较,模型组终板软骨细胞中COL2A1、SOX9在mRNA与蛋白表达水平上均显著下降(P<0.05)。与模型组比较,桂枝加葛根汤组细胞中COL2A1、SOX9 mRNA与蛋白的相对表达量均显著升高(P<0.05),而桂枝加葛根汤+SDF-1α组与模型组细胞中的COL2A1、SOX9 mRNA与蛋白的相对表达量无统计学差异(P>0.05)。见图5与图6。

图5 qRT-PCR检测各组终板软骨细胞中COL2A1、SOX9 mRNA表达水平(±s)Fig.5 qRT-PCR detection of COL2A1 and SOX9 mRNA expression levels of endplate chondrocytes in each group(±s)

图6 Western blot检测各组终板软骨细胞中COL2A1、SOX9蛋白表达水平(±s)Fig.6 Western blot detection of COL2A1 and SOX9 protein expression levels of endplate chondrocytes in each group(±s)
3 讨论
椎间盘退变被认为是导致慢性椎间盘源性下背痛和坐骨神经痛的主要原因,严重影响着患者的生活质量[2]。椎间盘是由髓核、纤维环和终板软骨组成的无血管组织,软骨终板是椎间盘和椎骨之间的一层薄薄的透明桥接物,不仅允许营养物质和代谢产物通过椎骨血管,而且能够分散椎间盘之间的压力以提供生物力学支持[12]。目前,关于软骨终板和椎间盘之间的相互作用关系已经开展了较多的研究。Rade等[13]通过大量的人群调查结果显示,腰椎椎间盘水平上的终板缺损均与椎间盘退变成显著且独立相关性。Xiao等[14]通过磁共振成像的研究报道指出,终板凹角和终板Modic改变引起的终板变化与椎间盘退变程度呈正相关。因此,终板软骨细胞退变可能是与椎间盘退变直接相关的主要病理学基础之一,这对于椎间盘退变的诊治提供了潜在的治疗靶点。然而,对于介导治疗终板软骨的特定分子机制目前仍知之甚少。
终板软骨组织变性会阻碍养分的输送并影响机械转导,而营养供应的减少在椎间盘退变的发展过程中起着至关重要的作用[3]。Wong等[15]证明了终板软骨组织成分极大地影响了髓核细胞的存活和功能发挥,其缺乏后阻止了溶质的通过并阻碍了正常的营养供应,这也可能阻碍了椎间盘退变治疗过程中的一些措施。Zehra等[16]提出营养不足会损害椎间盘对增加负荷或受伤的反应能力,并使椎间盘易变性。此外,终板软骨变性可能使炎症细胞因子的分泌增加和基质降解酶的基因表达,从而诱发椎间盘退变[17]。提高终板软骨的抗应力性可能是延迟或逆转终板软骨退变并有效治疗椎间盘退变的关键。然而,终板软骨细胞对张力刺激非常敏感,低强度和低频率的拉伸张力下已证明终板软骨细胞具有一定的抗炎功能,有助于表型软骨基因的表达和细胞外基质的合成[18-19]。相反,高强度和高频率的拉伸张力会抑制软骨形成并引起降解[20]。本研究结果显示,体外力学刺激下的终板软骨细胞形态发生了明显改变,由多边形被拉长为纺锤形,细胞增殖活性下降,同时也促进了细胞凋亡的发生。而经过桂枝加葛根汤含药血清预先处理的细胞形态改变程度较轻,细胞增殖活性有所升高,并抑制了细胞的凋亡。由此说明,桂枝加葛根汤含药血清对终板软骨细胞退变起到了一定的改善作用。
SOX9是软骨形成所必需的转录因子,并且在软骨细胞分化过程中的各个阶段均发挥关键作用。SOX9能够抑制软骨细胞向肥大性软骨细胞的转化,从而阻止软骨内骨化的发生[21]。已有研究证明了SOX9与椎间盘之间的相关性,SOX9的缺失或减少会引发终板软骨的变性从而导致椎间盘退变,SOX9的过表达可显著延迟椎间盘退变的发生,表明SOX9在椎间盘退变进程中具有保护作用,能够增加软骨细胞外基质聚集蛋白聚糖和胶原II的表达[22-23]。在本研究中,经过桂枝加葛根汤含药血清预先处理的细胞中COL2A1与SOX9的表达水平较模型组明显增加,进一步说明了桂枝加葛根汤对体外力学刺激诱导的大鼠终板软骨细胞退变的影响作用。
但是,终板软骨退变的机制十分复杂,对于在退变过程中发挥积极作用的关键分子如SOX-9的基本调控机制尚不清楚,导致SOX-9启动子发生表观遗传变化的特定调控途径有待进一步研究。SDF-1是一种趋化因子,通过与7个跨膜G蛋白偶联受体CXC趋化因子受体4型(CXCR4)结合而发挥作用。SDF-1可触发骨关节炎促进软骨细胞死亡,并能够增加体外软骨中基质金属蛋白酶13的表达来诱导基质降解[24]。作为CXCR4唯一已知的配体,两者结合并参与肿瘤发生发展、血管生成和细胞内信号转导[25]。近年来,SDF-1/CXCR4轴在骨科疾病发病机制中的作用得到越来越多的关注。例如,SDF-1/CXCR4信号通路下调SRY-box 9和II型胶原蛋白的表达以抑制软骨细胞的分化[26]。本研究中探究了SDF-1/CXCR4信号通路在大鼠终板软骨细胞退变中的调节作用,通过桂枝加葛根汤联合SDF-1α预先处理终板软骨细胞后力学刺激细胞退变确认SDF-1/CXCR4轴参与了大鼠终板软骨细胞退变,SDF-1α抑制了桂枝加葛根汤对大鼠终板软骨细胞退变的改善作用。由此说明,在力学刺激下激活了SDF-1/CXCR4轴参与到细胞退变过程。
综上所述,桂枝加葛根汤在力学刺激引起的大鼠终板软骨退变中能够提高细胞活性,抑制细胞凋亡,达到改善细胞退变的现象,这一作用可能与抑制SDF-1/CXCR4轴相关。但此过程是否涉及其他分子机制或者作用靶点,在体内实验中是否发挥同样疗效仍无法明确,这将是下一步进行深入研究的方向。