复合绿茶对高脂血症小鼠的降脂作用
梅 鑫,文治瑞,刘金香,杨再波,周才碧,
(1.黔南民族师范学院生物科学与农学院, 贵州都匀 558000;2.贵州师范大学生命科学学院, 贵州贵阳 550000;3.黔南民族师范学院化学化工学院, 贵州都匀 558000)
长期食用高热量食物会使过多的脂肪沉积在人体或肝脏内导致肥胖,从而引起各种慢性疾病如高脂血症、糖尿病、心脑血管疾病的发生。高脂血症是脂质代谢性疾病,与脂肪肝、糖尿病、冠心病等多种疾病密切相关[1-2],其发病率逐年上升且呈低龄化趋势,已发展为全球性公共卫生问题[3]。高脂血症的发病与血清中的TC(总胆固醇)、TG(甘油三酯)、LDL(低密度脂蛋白)、HDL(高密度脂蛋白)的指标异常息息相关[4-5],长期高脂血症作用下,LDL-C(低密度脂蛋白胆固醇)可通过受损内皮进入血管内膜,引起内皮细胞一系列的化学反应,促进氧化脂质的积累,并影响CRP (C-反应蛋白)、TNF-α(α肿瘤坏死因子)、IL-10 (白介素10)等前炎症因子的释放[6-7]。相关研究报道脂代谢异常与基因的表达存在一定的关系,与AMPKα-2、HMGCR、FXR、PPARa、LDLR、LPL、CETP等基因表达成正相关且与ACC1、SREBP1C、ACC、PPARr、FAS等基因表达成负相关[8-11]。此外,高脂血症发病是多种代谢通路异常的综合结果,主要包括脂类代谢、糖类代谢、氨基酸代谢以及氧化应激等[12],其差异代谢产物相关信息有助于诊断高脂血症的发病过程。
目前,市场上品种繁多的降脂药物,大多成本高价格贵,且易出现肝脏毒性、剂量依赖性等副作用[13];低毒性或保肝的降血脂药物开发是一个具有良好前景的发展方向,茶作为一种仅次于水的世界上最广泛消费的饮料因其降脂减肥功效备受人们的关注[14]。人体脂质代谢过程复杂,茶叶中的茶多酚、咖啡碱、儿茶素茶多糖等[15-20],通过调节脂质代谢关键转录因子[21],抑制FAS基因的表达[14],激活肝脏中的脂肪分解代谢[22-23],减少肝脏内脂质沉积和血清TC的水平[24],从而达到降脂、减肥的功效。敬娜娜等[25]研究了茯砖茶对高脂血症小鼠脂代谢的影响,发现茯砖茶水提物能抑制体内脂肪合成的关键基因表达,减少脂肪的堆积,从而达到降脂的效果。有报道称,普洱茶能抑制体重增加、缓解氧化损伤和低度炎症、调节脂代谢相关基因的mRNA和蛋白表达水平等[26]。
代谢组学是对有机酸、脂类、氨基酸、糖类等相关代谢产物分析的一门技术[27],与其他三大组学(mRNA转录组学、蛋白组学及DNA基因组学)共同构建成生物系统四大组学;其具有整体性、动态性、系统性、综合性等特点[28],且代谢产物的种类较少、相似性高以及研究手段与技术在各个领域中通用等优点[29]。本研究以高脂血症小鼠为实验对象,灌胃不同浓度复合茶水提物,饲养30 d后;利用超高效液相色谱技术检测小鼠肝脏脂类代谢物,通过PCA分析、OPLS-DA模型分析以及代谢通路分析等挖掘不同浓度复合茶水提物处理小鼠肝脏的差异脂代谢物,旨在于探索复合茶的降脂作用与机理,为该复合茶的研究开发和利用提供一定参考。
1 材料与方法
1.1 材料与仪器
复合绿茶由都匀古树绿茶、都匀阔叶苦丁、都匀原树甜茶、荷叶、野薄荷、金银花拼配而成,其比例为2:2:1:1:1:1 贵州碧竖科技服务有限公司;乙醇、乙腈、甲醇 均为色谱纯,德国Merck;雄性KM小鼠(SPF级) 5周龄,体重(30±2)g,许可证号:SCXK(湘)2016-0002,湖南斯莱克。
IT-TOF质谱仪(含系统控制器、自动进样器、在线脱气机)、CTO-20AC柱温箱、LC-30AD液相输液泵 日本岛津公司;超纯水器、超低温冰箱、Hettich MIKRO-22R低温高速离心机 美国Thermo公司。
1.2 实验方法
1.2.1 茶样制备 将复合茶干茶样品粉碎400目,按茶叶与水的重量比1:10(w/v)置于100 ℃沸水中浸提30 min,过滤后减压浓缩。茶渣按相同的方法再提取一次,后将两次滤液混合。置于-80 ℃下预冷12 h后真空干燥30 h,然后收集干粉并贮存于-20 ℃冰箱中。
1.2.2 动物试验 将SPF级雄性KM小鼠,喂养7 d,将其随机分成复合茶高剂量组(DH)、复合茶低剂量组(DL)和模型对照组(NK),每组10只小鼠;NK组饲喂高脂饲料+灌胃蒸馏水(0.1 mL/10 g),DL组饲喂高脂饲料+灌胃210.0 mg/kg复合茶汤,DH组饲喂高脂饲料+灌胃840.0 mg/kg复合茶汤。实验室内相对湿度为50%~60%,温度为20~26 ℃,光照12 h/d,将各组小鼠分开饲养。每天更换一次垫料,每周更换饮用蒸馏水。实验30 d期间,如实记录实验前后小鼠的生理状况和体重等变化。
1.2.3 样品制备 饲养结束后,取出小鼠肝组织,取50 mg,加入1000 μL预冷提取剂(70%的甲醇水溶液,含1 μg/mL的2-氯苯丙氨酸作为内标),匀浆3 min(加入预冷钢珠);取出钢珠,涡旋1 min,冰箱静置15 min,再4 ℃离心(12000 r/min)10 min,取上清液,用于LC-MS/MS分析。
1.2.4 色谱及质谱条件
1.2.4.1 LC条 件 色 谱 柱:Waters ACQUITY UPLCHSS T3C18,1.8 μm×2.1 mm×100 mm;柱温40 ℃;流动相:A为超纯水(0.04%乙酸),B为乙腈;洗脱梯度见表1;进样量2 μL。

表1 洗脱梯度Table 1 Elution gradient
1.2.4.2 MS条件 质谱条件:GSI(离子源气体I)55 psi、温度为500 ℃电喷雾离子源、气帘气26 psi、气体II(GS II)60 psi、质谱电压为-4500 V(negative)和500 V(positive)、Collision-Activated Dissociation,CAD参数设置为高。在三重四极杆(Qtrap)中,每个离子对是根据DP(优化的去簇电压)和CE(碰撞能)进行扫描检测。
1.3 数据处理
利用Analyst1.6.3软件及三重四极杆质谱的多反应监测模式(Multiple Reaction Monitoring,MRM)处理质谱数据及进行定量分析,对所有代谢物进行峰提取和峰校正。所有数据集经过处理后用OPLS-DA模型进行分析,以预测参数R2X、R2Y和Q2的值来评价模型的有效性,它们的大小直接反映了模型的可靠程度。
2 结果与分析
2.1 复合茶对高脂血症小鼠体重的影响
经过1个月的试验干预,观察高脂饲料喂养的小鼠体重变化(表2),高脂模型组小鼠的最终体重比造模初期的体重增加(22.2±1.7)g,且比常规饲料组显著增重,前期研究结果表明高脂模型建模成功[30]。而经过不同浓度复合茶灌胃,DL组和DH组小鼠的最终体重较NK组极显著下降(P<0.01),说明复合茶能够控制由高脂饮食诱导的小鼠体重增加,且呈剂量依赖模式。
表2 复合茶对高脂血症小鼠体重的影响(±s,n=10)Table 2 Effect of compound tea on the body weight of hyperlipidemia mice (±s, n=10)

表2 复合茶对高脂血症小鼠体重的影响(±s,n=10)Table 2 Effect of compound tea on the body weight of hyperlipidemia mice (±s, n=10)
注:同一指标不同小写字母表示差异显著,P<0.05;不同大写字母表示差异极显著,P<0.01。
?
2.2 样本质谱分析总离子流图
利用软件Analyst 1.6.3处理质谱数据。为了监控分析过程的可重复性,在分析过程中每10个测试样品插入1个混合样品提取物制备的质量控制(QC)样品。质谱法总离子流图(Totalionscurrent,TIC)可通过叠加显示来分析代谢物的可重复性和准确性。MRM代谢物检测多峰图,用纵坐标和横坐标分别表示为:离子检测的离子流强度和代谢物检测的保留时间。每种颜色的质谱峰代表检测到的不同代谢物,峰面积代表相应物质的相对含量(图1)。

图1 混样质控QC样本的总离子流图Fig.1 Total ion flow pattern of QC samples with mixed quality control
2.3 定性和定量代谢物
基于数据库MetWare databa(MWDB)、KEGG和多反应监测(MRM)进行定性和定量质谱分析,由样品的代谢物检测多峰图(MRM)可知,共检测到110种脂代谢物,包括溶血卵磷脂酰胆碱18:2、(±)17-羟基-5Z,8Z,11Z,14Z-二十碳四烯酸、前列腺素E2、溶血卵磷脂酰乙醇胺14:0、(±)12(13)环氧-9Z-十八碳烯酸、十四烷二酸、溶血卵磷脂酰丝氨酸22:5、2-甲基丁酰肉毒碱、DL-苄基琥珀酸、枯茗醛、溶血卵磷脂酰胆碱20:2、前列腺素D2等代谢物质。根据保留时间与峰型的信息,校正不同样本中每个代谢物的色谱峰,以确保定性定量的准确性,比较110种脂代谢物中每个代谢物在不同样本中的物质含量差异(图2)。

图2 代谢物定量分析积分矫正Fig.2 Integral correction chart for quantitative analysis of metabolites
2.4 PCA分析
根据mix即上方提到的质控样本,分析显示:样品具有相似的代谢特性,每组处理内样品间的差异都很小,测试结果稳定且可重复。茶样处理之间的分离趋势很明显,表明不同浓度茶样处理之间存在明显的代谢差异(图3d);三组处理的代谢物在第一个成分(PC1)中明显分离,表明茶样处理对高脂小鼠的脂代谢有明显影响(图3a~c)。
根据PCA得分图分析NK、DL组,NK、DH组和DL、DH组都能形成部分分离,表明不同浓度的茶样处理组与模型组在小鼠的代谢上具有一定的差异(图3a~c)。

图3 主成分分析(PCA)得分图和三维图Fig.3 Principal component analysis (PCA) score map and 3D map
2.5 OPLS-DA模型分析
OPLS-DA可最大程度地区分组间差异,有助于发现差异代谢物。对OPLS-DA模型进行了200次排列组合试验(图4),水平线对应于原始模型的R2和Q2,而红色和蓝色点分别代表替换后的R2’和Q2’;验证结果表明该模型是有意义的,并且可以在随后的分析中根据VIP值分析筛选差异代谢物。
在DL组对NK组、DH组对NK组、DH组对DL组的比较中,R2Y和Q2的分数均大于0.99(图4a~c),表明茶样处理导致高脂小鼠的脂代谢差异。此外,OPLS-DA模型显示,DH组小鼠的代谢物分布较为分散,这可能与高浓度复合茶处理的小鼠体内代谢之间产生的个体差异有关,同时也反应了代谢组学技术能够准确反映个体代谢物差异特征的优点(图4b~c)。

图4 OPLS-DA模型的评分、验证图Fig.4 Scoring and validation of OPLS-DA model
2.6 差异代谢物筛选
随着茶样浓度的增加,代谢物的差异加大(图5d)。HCA可以评价复合茶样处理导致代谢物积累的特性差异,包括处理内同质性和处理间变异性。火山图中的点代表代谢物,纵坐标和横坐标代表代谢物VIP值和两个样品中代谢物定量差异的对数。选择折叠变化≥2,折叠变化≤0.5,VIP≥1的代谢物作为显著差异代谢物。由差异代谢火山图可知大多数代谢物的表达没有差异,上调和下调的差异代谢物个数相近(图5c);NK VS DL组中上调5个,NK VS DH组中下调15个,上调1个,DL VS DH组中下调11个。
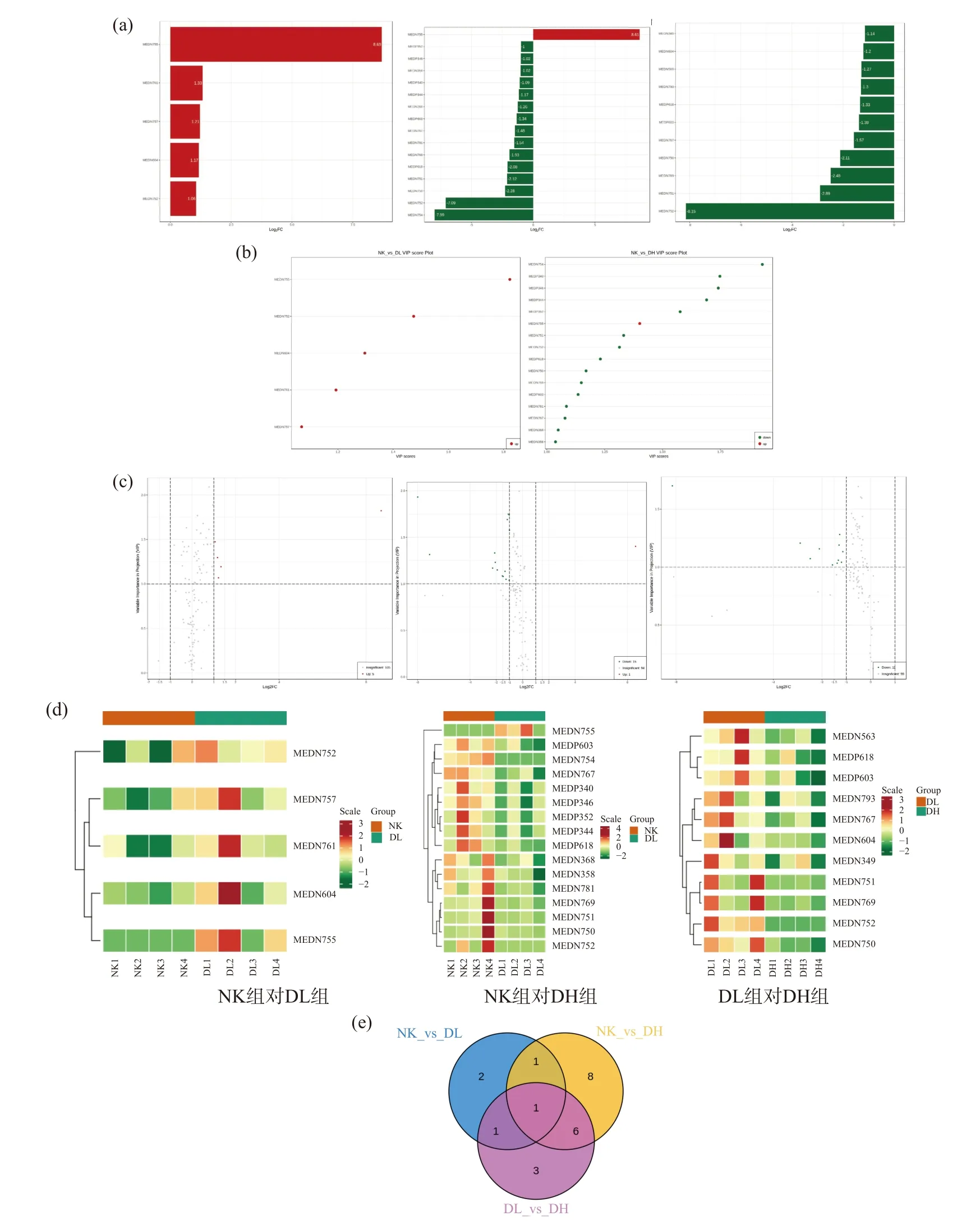
图5 差异代谢物的条形值图、VIP值图、相关性热图、火山图、各组差异韦恩图Fig.5 Bar graph, VIP value map, correlation thermogram, volcano map and Venn diagram of different metabolites
2.7 差异代谢物的统计分析

续表 3
由表3可知,共检测到110个代谢物,其中22个代谢物差异明显(表3)。与模型对照组小鼠相比,复合茶低浓度处理组中:(±)7-羟基-4Z, 8E, 10Z,13Z, 16Z, 19Z-二十二碳六烯酸、十四烷二酸和(±)-15-羟基-5Z, 8Z, 11Z, 13E, 17Z-二十碳五烯酸等代谢产物上调。复合茶高浓度处理组中的溶血卵磷脂酰乙醇胺14:0(LPE14:0)、溶血卵磷脂酰胆碱16:1(LPC16:1)、溶血卵磷脂酰胆碱18:1(LPC18:1)、溶血卵磷脂酰胆碱18:2(LPC18:2)、溶血卵磷脂酰胆碱20:2(LPC20:2)、溶血卵磷脂酰丝氨酸22:5(LPS22:5)、6-酮前列腺素F1α、前列腺素D2等代谢物质下调,而(±)17-羟基-5Z, 8Z, 11Z, 14Z -二十碳四烯酸上调。

表3 差异显著的代谢物Table 3 The metabolites with significant difference
2.8 代谢物的代谢通路分析
利用KEGG数据库中的代谢通路分析差异代谢产物(图6~图9)。其代谢途径的类型分为:二甲苯降解、甘油磷脂代谢、芳香化合物降解、亚油酸代谢和花生四烯酸代谢等代谢途径。其中,LPS(22:5)、LPE(14:0)、DL-苄基琥珀酸、甘油、前列腺素D2、前列腺素E2、LPC(16:1)等代谢产物的含量在这些代谢通路抗氧化降脂分解和维持体内血糖平衡方面发挥重要作用。并从DH组差异代谢的明显可知(图7):复合茶对高脂小鼠的降脂与浓度有一定关系。

图6 差异代谢物的功能注释和富集分析Fig.6 Functional annotation and enrichment analysis of different metabolites

图7 茶样处理高脂小鼠肝脏脂质代谢反应Fig.7 Lipid metabolism in liver of high fat mice treated with tea

图8 差异代谢物KEGG通路图Fig.8 KEGG pathway of different metabolites

图9 茶样处理下高脂小鼠肝脏代谢反应的研究概况Fig.9 Research overview of liver metabolic reaction of high fat mice under tea like treatment
3 讨论与结论
基于UPLC-MS/MS 检测平台,方便、快速、准确的质谱定量测定代谢物在肝脏、血液中的浓度发生的一系列变化[31]。该方法为差异代谢物质引起高脂血症的变化状况的评估提供有价值的参考依据。
本研究通过高脂饮食诱导的高脂血症小鼠模型探讨了复合茶提取物的降脂减肥功效。结果表明,复合茶能够抑制肥胖小鼠的体重增长,以高剂量组的效果最佳。
溶血卵磷脂(Lysophosphatidylcholine,LPCs)可分为LPC,LPE,LPI,LPA等,它是细胞膜和介导信号转导的重要组成部分,临床上根据其水平变化来诊断病理病因。多项研究表明,LPCs在许多疾病中发挥着关键性作用,包括高脂血症、高血糖、动脉粥样硬化及炎症等。有相关报道,血脂水平的变化与LPCs存在紧密相联且复杂的关系[32],当LPCs与胆固醇及胆汁酸三者的比值达到一定程度时,胆固醇因饱合而结晶;且LPCs的形成是通过卵磷脂在磷脂酶A的作用下生成的[31],其含量改变与高脂血症引起的脉粥样硬化的发生、发展有着密切的联系。因此,肥胖小鼠体内LPCs的变化可作为诊断高脂血症的潜在标志物[33]。在本研究中,与高脂模型组对比,高 剂 量 复 合 茶 组 的LPC(16:1)、LPC(18:1)、LPC(18:2)、LPC(20:2)、LPS(22:5)和LPE(14:0)的水平显著降低,因此,可推测复合茶提取物对LPCs的作用可能有助于降低血脂,其机理有待进一步验证。
十八碳烯酸、二十碳四烯酸、二十碳五烯酸、二十二碳六烯酸等是不饱和脂肪酸。其中,二十二碳六烯酸是二十四碳六烯酸经过C24: 6n-3到 C22: 6n-3的脂肪酸的β氧化反应产生的[5],降低的二十二碳六烯酸与脂肪酸β-氧化有关,高剂量复合茶提取物改善了高脂饮食小鼠代谢物的脂肪酸β-氧化异常症状。此外,二十碳五烯酸能改善血清脂肪质量,有效降低血液中LDL-C和中性脂肪的含量,增加HDL-C含量。本研究中高浓度复合茶对二十碳五烯酸的作用可能有助于改善血脂异常。
前列腺素是一种炎症介质,通过环氧合酶产生花生四烯酸,该物质具有生物活性。且相关研究报道:炎症介质和胰岛素敏感性在小鼠疾病模型中存在正相关关系[34]。本研究中,与高脂模型组对比,高浓度复合茶处理组小鼠体内前列腺素的含量有所下调。因此推测,复合茶可以一定程度的控制高脂膳食诱导引起的机体炎症反应并且可以进一步改善花生烯四酸的代谢途径。
综上所述,基于UPLC-MS/MS检测平台的靶向代谢物,分析不同复合茶样浓度下高脂血症小鼠的代谢差异。从代谢组学的角度全面分析了代谢途径及代谢产物的反应,可以灵敏地刻画出生命体发生的一系列的病理状态变化。其最主要的特征就是筛选出潜在的治疗高脂血症的物质,为研究复合茶对高脂血症的降脂机理提供有价值的参考信息。

