白细胞介素1受体拮抗剂治疗痛风急性发作有效性及安全性的Meta分析*
赵尹瑜,刘懿贤,吴逢波
(1.四川大学华西医院临床药学部,四川 成都 610041;2.四川大学华西药学院,四川 成都 610041)
痛风是一种晶体相关性关节病,由单钠尿酸盐沉积而导致,与嘌呤代谢紊乱和(或)尿酸排泄减少所致的高尿酸血症有直接关系,主要表现为急性发作性关节炎、痛风石形成、痛风石性慢性关节炎、尿酸盐肾病和尿酸性尿路结石,严重者可出现关节残疾和肾功能不全[1]。同时,痛风常伴有腹型肥胖、高脂血症、高血压、2型糖尿病、心血管病等临床表现[2]。痛风患者滑膜组织和关节软骨释放的尿酸钠晶体被关节液的白细胞吞噬,白细胞被破坏而释放出蛋白酶和炎性因子进入滑液。白细胞介素(IL)是诱发急性痛风性关节炎发作的关键因子,会诱导IL-1产生[3]。IL-1受体拮抗剂通过竞争性抑制IL-1与IL-1受体结合,阻滞其生物活性,最终抑制痛风炎性反应的级联反应,以此缓解患者的疼痛。目前,临床用于治疗痛风急性发作的IL-1受体拮抗剂主要有阿那白滞素、利纳西普、卡那单抗等,尚缺乏数据证明其在痛风急性发作中的有效性和安全性。为此,本研究中收集相关文献进行Meta分析,以期为临床合理使用IL-1受体拮抗剂提供参考。现报道如下。
1 资料与方法
1.1 文献纳入与排除标准
1.1.1 纳入标准
研究类型:随机对照试验(RCT),语言类型为中文和英文。
研究对象:年龄≥18岁,符合原发性痛风诊断标准[4];非同日2次空腹血尿酸>420μmol/L,即受影响关节穿刺液镜检发现单钠尿酸盐,或满足2020美国风湿病学会(ACR)制订的痛风指南诊断标准[5]12条中6条以上;由其他疾病引起的潜在痛风。
干预措施:试验组患者采用阿那白滞素、利纳西普、卡那单抗、康奈单抗等IL-1受体拮抗剂,剂量与疗程不限;对照组患者给予安慰剂或其他治疗药物。
结局指标:1)有效性。①C反应蛋白(CRP);②血清淀粉样蛋白A(SAA);③血清尿酸盐;④典型痛风发作的持续时间;⑤痛风发作天数;⑥痛风发作次数;⑦痛风发作患者比例;⑧视觉模拟评分法(VAS)评分;⑨0~10分数字评分量表评分大于5分的天数;⑩Likert五分量表评分;⑪11点数字评分法(NRS-11),评分大于5分的天数。2)安全性。○12药品不良反应(ADR)。
1.1.2 排除标准
综述;会议论文;动物实验;重复发表的文献;无法提取关键数据的研究。
1.2 文献检索策略
计算机检索Medline和Embase,以及中国知网、万方、维普数据库中关于IL-1受体拮抗剂治疗痛风的文献,检索时限均为自建库起至2020年9月。中文检索词为“痛风”“白介素-1抑制剂”“白介素-1受体拮抗剂”“IL-1受体拮抗剂”“阿那白滞素”“阿纳白滞素”“利纳西普”“康奈单抗”“卡那单抗”“随机对照试验”等,英文检索词为“gout”“Interleukin-1 inhibitor”“Interleukin-1 receptor antagonist”“anakinra”“rilonacept”“canakinumab”“randomized controlled trial”“RCT”等。
1.3 文献筛选与资料提取
由2名评价员独立筛选文献,提取纳入研究的相关信息,并进行交叉核对。如遇争议,通过讨论或由第3名评价员裁定。首先,阅读文献题目,排除明显无关的文献后,再阅读摘要和全文,最后确定是否纳入该文献。信息提取内容包括基本信息(第一作者、发表时间等)、方法学质量信息、病例特征(纳入人群、样本量、干预措施、疗程等)、结局指标、ADR等。
1.4 质量评价
采用Cochrane系统评价员手册5.1.0推荐的偏倚风险评估工具评价纳入文献的质量,评价内容包括随机方法、分配方案隐藏、受试者和研究人员的盲法、结果数据的完整性、选择性报告研究结果、其他偏倚的来源,每项均分为“低风险”“不清楚”“高风险”[6]。
1.5 统计学处理
采用Cochrane协作网提供的RevMan 5.4软件进行Meta分析。连续性变量结果采用加权均数差(WMD)表示效应量,非连续性变量结果采用比值比(OR),均采用95%置信区间(95%CI)。P≥0.1,I2<50%提示各个研究为同质来源,采用固定效应模型;P<0.01,I2>50%提示研究间存在异质性,采用随机效应模型。P<0.05为差异有统计学意义。
2 结果
2.1 文献筛选流程及结果
共检索720篇文献,阅读全文后最终纳入10项研究[7-16],均为英文文献。文献筛选流程见图1。
2.2 纳入研究的基本特征
纳入研究包含10项RCT,5项为卡那单抗、4项为利纳西普、1项为阿那白滞素。纳入研究的基本特征见表1。
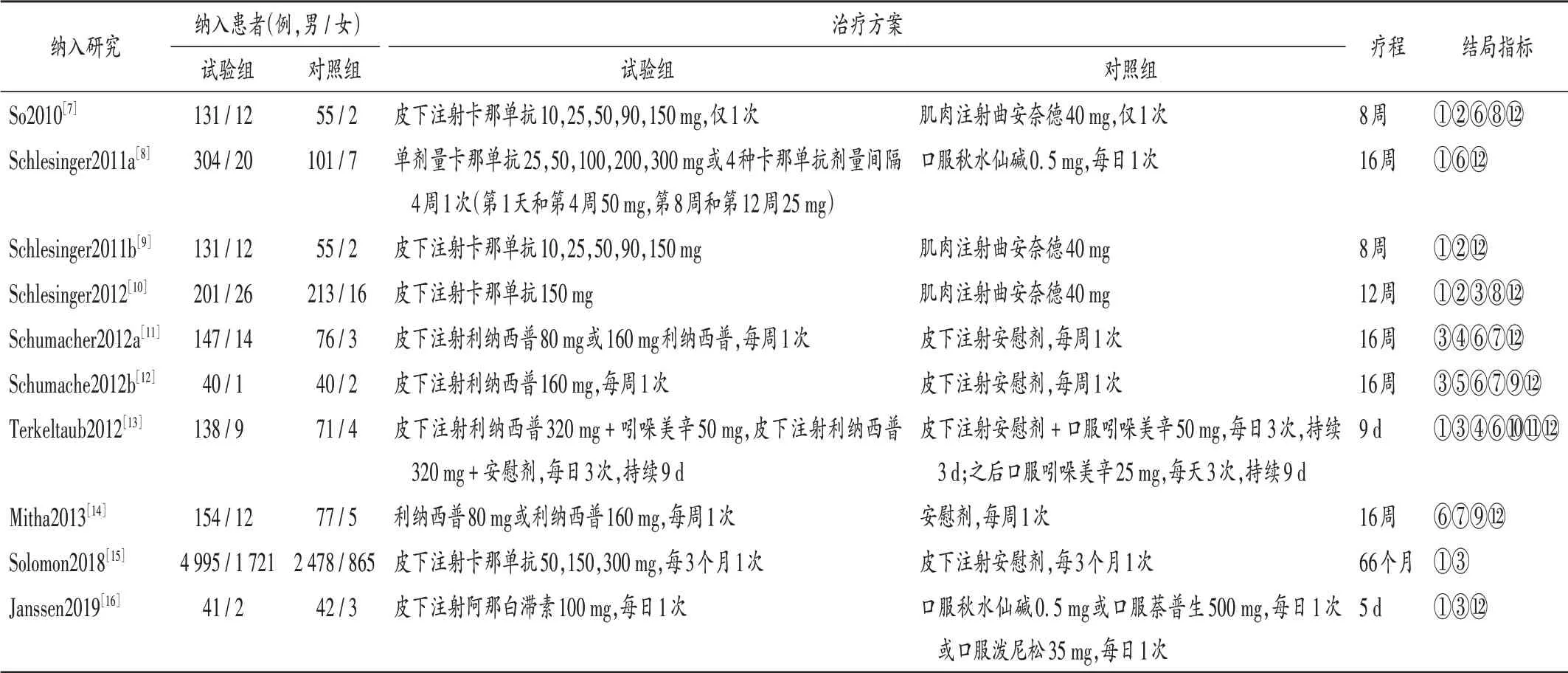
表1 纳入研究的基本特征Tab.1 Basic characteristics of included studies
2.3 偏倚风险评价结果
5项研究[7-8,12,14-15]采用正确的随机方法,1项研究[13]采用错误的随机方法,其余均不清楚;1项研究[15]使用正确分配隐藏,1项研究[9]的分配方案隐藏方法不完善,其余均不清楚;6项研究[9-10,12-14,16]中受试者和研究者使用正确盲法,1项研究[15]盲法不正确,其余均不清楚;2项研究[8,16]的结果数据完整性不清楚,其余均完整;8项研究[7,9-15]没有选择性报告结局指标,其余均不清楚;4项研究[7-9,15]存在其他偏倚来源,其余均不清楚。纳入研究的偏倚风险见图2。
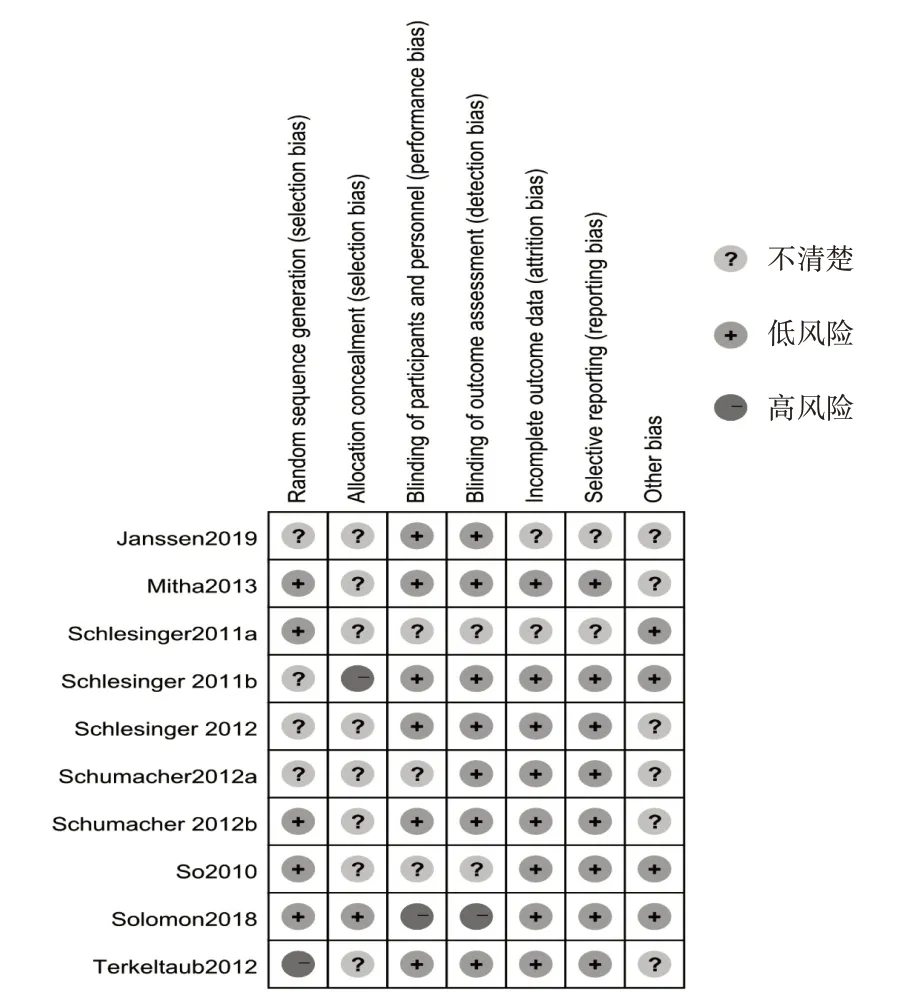
图2 纳入研究偏倚风险Fig.2 Bias risk of included studies
2.4 Meta分析结果
2.4.1 有效性
CRP:有6篇文献报道,但部分文献缺失治疗后数据,最终纳入2项研究[7,9]。试验药物均为卡那单抗,对照药物均为曲安奈德,按照卡那单抗使用剂量10,25,50,90,150 mg进行分组,共得到5组研究。经异质性检验,P>0.1,I2<50%,故采用固定效应模型分析。Meta分析结果显示,与对照组相比,10 mg组[MD=2.44,95%CI(-9.75,14.63),P=0.69],25 mg组[MD=4.78,95%CI(-7.79,17.34),P=0.46],50 mg组[MD=1.59,95%CI(-14.62,17.79),P=0.85],90 mg组[MD=8.55,95%CI(-3.76,20.85),P=0.17],150 mg组[MD=2.60,95%CI(-10.25,15.46),P=0.69],各亚组CRP水平相当,差异均无统计学意义。详见图3。
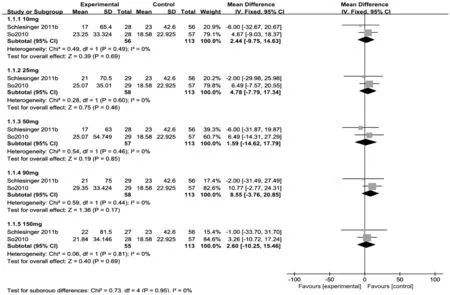
图3 两组患者治疗后CRP水平Meta分析森林图Fig.3 Forest plot of Meta-analysis:The CRP levels after treatment in the two groups
痛风发作次数:有3项研究[11-12,14]报道。SCHUMACHER等[11]的研究表明,在16周的治疗期内,痛风发作累计次数分别为安慰剂组84次、利纳西普80 mg组23次,利纳西普160 mg组17次,安慰剂组每例患者痛风发作的平均次数为1.06次[95%CI(0.71,1.42)],利纳西普160 mg组患者痛风发作次数的平均值为0.21次[95%CI(0.09,0.33)],组间比较差异显著(P<0.05)。SCHUMACHER等[12]的另1项研究显示,160 mg利纳西普组患者痛风发作次数平均为0.15次(代表6次总发作),安慰剂组为0.79次(代表33次总发作),组间比较差异显著(P<0.05),且在延长治疗期4周内及治疗后6周的随访期内一直保持。MITHA等[14]的研究表明,治疗结束时,痛风累积发作次数为安慰剂101次,80 mg利纳西普组29次,160 mg利纳西普组28次,与安慰剂组[MD=1.23,95%CI(0.89,1.58)]相比,利纳西普160 mg组患者的痛风发作次数显著减少[MD=0.34,95%CI(0.15,0.52)],降低率为72.6%[95%CI(58.4,82.0)]。可见,IL-1受体拮抗剂利纳西普可降低痛风发作次数。
Likert量表和NRS-11评估:有1项研究[13]报道。TERKELTAUB等[13]采用Likert量表评估,利纳西普联合吲哚美辛组的疼痛平均减轻值为1.55分,吲哚美辛单药治疗组的平均疼痛减轻值为1.40分,组间比较差异不显著[MD=-0.14,95%CI(-0.44,0.15),P=0.333],则无需对利纳西普单药治疗组(0.69分)和吲哚美辛单药治疗组(1.40分)的疼痛减轻程度进行比较;采用NRS-11量表进行评估,利纳西普联合吲哚美辛组疼痛减轻3.87分,吲哚美辛单药治疗组减轻4.33分,利纳西普单药治疗组减轻1.81分,与治疗前比较,疼痛均显著减轻(P<0.000 1)。虽然利纳西普联合吲哚美辛的NRS-11变化与单用吲哚美辛相似(P=0.253 3);但与单用利纳西普相比,单用吲哚美辛的疗效更好(P<0.000 1)。可见,IL-1受体拮抗剂利纳西普减轻疼痛效果不显著。
2.4.2 安全性
所有不良反应:有9项研究[7-14,16]报道,试验组共1 393例,对照组共774例。经异质性检验,P>0.1,I2<50%,故采用固定效应模型分析。Meta分析结果显示,试验组和对照组所有不良反应发生率比较,差异有统计学意义[OR=1.22,95%CI(1.02,1.47),P=0.03]。详见图4。
上呼吸道感染:有4项研究[8,11-12,14]报道,试验组共692例,对照组共311例。经异质性检验,P>0.1,I2<50%,故采用固定效应模型分析。Meta分析结果显示,试验组和对照组上呼吸道感染发生率比较,差异无统计学意义[OR=1.22,95%CI(0.70,2.12),P=0.48]。详见图4。
鼻咽炎:有3项研究[7-9]报道,试验组共610例,对照组共222例。经异质性检验,P>0.1,I2<50%,故采用固定效应模型分析。Meta分析结果显示,试验组和对照组鼻咽炎发生率比较,差异无统计学意义[OR=2.50,95%CI(0.96,6.55),P=0.06]。详见图4。
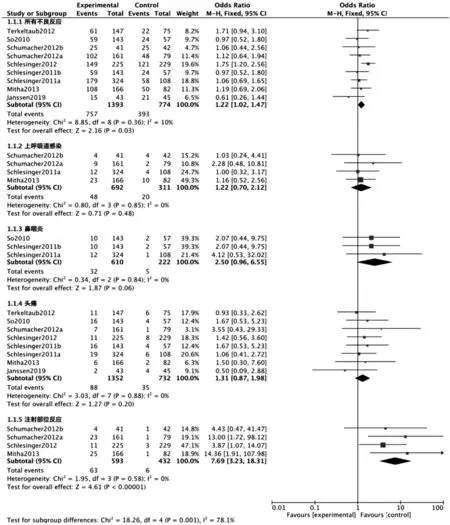
图4 两组患者治疗后不良反应(除总感染)Meta分析森林图Fig.4 Forest plot of Meta-analysis:The incidence of ADR after treatment in the two groups(except total infections)
头痛:有8项研究[7-11,13-14,16]报道试验组共1 352例,对照组共732例。经异质性检验,P>0.1,I2<50%,故采用固定效应模型分析。Meta分析结果显示,试验组和对照组头痛发生率比较,差异无统计学意义[OR=1.31,95%CI(0.87,1.98),P=0.20]。详见图4。
注射部位反应:有4项研究[10-12,14]报道,试验组共593例,对照组共432例。经异质性检验,P>0.1,I2<50%,故采用固定效应模型分析。Meta分析结果显示,试验组和对照组注射部位反应发生率比较,差异有统计学意义[OR=7.69,95%CI(3.23,18.31),P<0.000 01]。详见图4。
总感染:有4项研究[10-12,14]报道,试验组共593例,对照组共432例。经异质性检验P<0.1,I2>50%,故采用随机效应模型分析。Meta分析结果显示,试验组和对照组总感染发生率比较,差异无统计学意义[OR=1.04,95%CI(0.61,1.76),P=0.90]。详见图5。
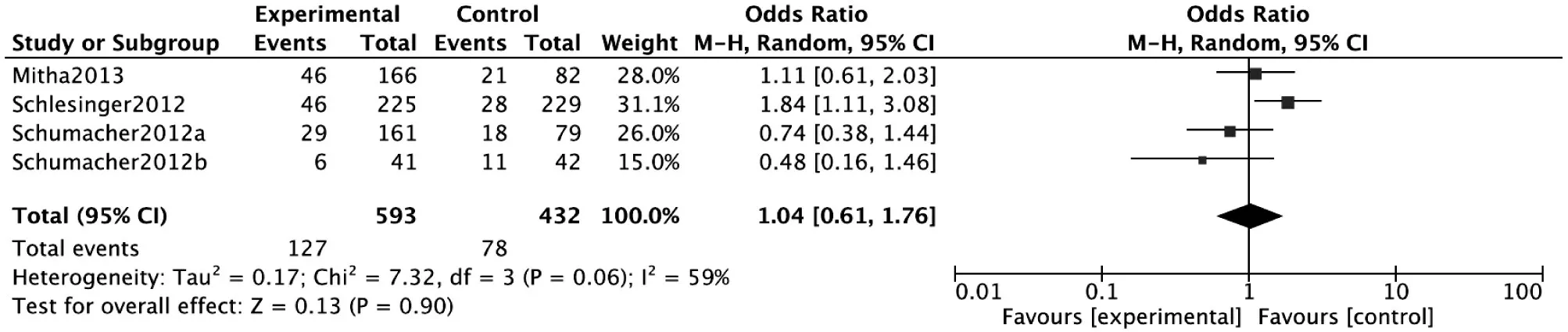
图5 两组患者治疗后总感染发生率Meta分析森林图Fig.5 Forest plot of Meta-analysis:The incidence of total infections after treatment in the two groups
肿瘤:有2项研究[11-12]报道,认为其与治疗无关。SCHUMACHER等[11]研究结果表明,试验组和对照组腿部鳞状细胞癌发生率分别为0.62%(1/161)和0;SCHUMACHER等[12]另1项研究显示,试验组和对照组前列腺癌发生率分别为2.44%(1/41)和0。但研究者均认为上述不良事件与治疗无关。
3 讨论
目前,秋水仙碱、非甾体抗炎药(NSAID)和糖皮质激素是治疗痛风性关节炎急性发作的一线药物,用于降低血尿酸水平和消炎镇痛。IL-1受体拮抗剂治疗痛风急性发作疗效较好,但价格昂贵,受经济因素限制,目前主要适用于疼痛反复发作、常规用药治疗无效或有用药禁忌证的患者[17]。
本研究中共纳入10项IL-1受体拮抗剂治疗痛风的RCT,试验药物包括卡那单抗(5项)、利纳西普(4项)、阿那白滞素(1项)。Meta分析结果显示,皮下注射各剂量卡那单抗CRP水平与40 mg曲安奈德相比差异不显著[7,9],试验组(利纳西普)痛风发作次数比对照组(安慰剂)显著减少[12];利纳西普止痛效果可能比吲哚美辛差[13];IL-1受体拮抗剂治疗组的不良反应发生率显著高于对照组,其不良反应涉及全身器官组织,包括各部位疼痛、肾功能改变、肌肉骨骼和结缔组织疾病、呼吸道感染、注射部位反应等。可能因为IL-1受体拮抗剂为皮下注射药物,其注射部位可能出现反应。此外,炎性级联反应的阻断可能与感染总风险的增加有关。目前尚不清楚恶性肿瘤的发生风险,纳入研究出现的2例肿瘤不良反应(腿部鳞状细胞癌、前列腺癌)均被认为与治疗无关,但不能排除潜在的风险,仍需深入研究。注射性蛋白质的严重过敏反应较常见,使用该药物时必须谨慎[18]。
本研究存在以下局限性:1)所有文献均为国外文献,缺少中国临床试验数据,可能增加选择性偏倚风险;2)纳入的试验多数分配隐藏不清楚、样本量少,且约有1/2的试验随机分配方法不清楚,一定程度上影响了结果的稳定性;3)纳入文献的结局指标不统一,且无试验前后数据的比较,使多数指标无法开展Meta分析,一定程度上影响了结果的准确性;4)缺乏IL-1受体拮抗剂与常用一线治疗药物的临床试验数据,影响对急性痛风发作用药的进一步评价与推荐。
综上所述,IL-1受体拮抗剂临床效果较好,但受其不良反应及成本限制,目前证据不推荐作为痛风的一线治疗药物。受纳入研究数量和质量的限制,仍需开展针对不同人种和国家/地区的多中心、大样本、高质量RCT,且需收集治疗前后相关指标的数据。此外,后续研究可加强IL-1受体拮抗剂药物经济学的讨论,增加更多成本-效益数据,并开展与痛风急性发作常用一线治疗药物疗效比较的临床试验,为临床决策提供更多依据。
——纳西琵琶

