Cu基材料电催化二氧化碳深度还原研究进展
谢水奋, 孔伟强, 王秋祥
(1. 华侨大学 材料科学与工程学院, 福建 厦门 361021;2. 华侨大学 实验室与设备管理处, 福建 厦门 361021)
自工业革命以来,人类对化石燃料的使用量激增,过度使用有限的化石资源不仅带来严重的能源问题,还对人类赖以生存的自然环境造成不可逆的破坏[1-3].大气中二氧化碳(CO2)含量(体积分数)呈现逐年快速上升的趋势[4],打破了原本自然界碳循环的动态平衡.由此造成的一系列环境问题让人们意识到降低大气中CO2含量迫在眉睫[5-9].
为解决CO2含量激增这一问题,目前主要有两种解决措施:首先是节能减排,从源头上减少CO2温室气体的排放;其次是收集大气中的CO2气体并加以利用[10].2020年第75届联合国大会上,我国向世界郑重承诺力争在2030年前实现碳达峰,努力争取在2060年前实现碳中和.节能减排是实现碳达峰的主要手段,而捕集大气中的CO2并加以利用是实现碳中和的必经之路[11].近年来,研究人员不断探索CO2的还原转化方式[12].根据驱动能源的不同,现有的CO2还原反应(CO2reduction reaction,CO2RR)可分为4个类别:生物催化[13]、热催化[14]、光催化[15]和电催化[16].其中,电催化CO2还原反应操作方便、装置简单[17-18],可通过风能、太阳能和潮汐能等可再生能源生成的电力作为能量源电催化CO2还原.该技术不仅有望解决目前大气中CO2含量过多的问题,还能在温和的条件下实现高附加值化学品的合成,因而受到科研工作者的广泛关注[19].
20世纪50年代,Teeter等[20]发现可以通过电催化CO2RR实现含碳化合物的合成.90年代初,Hori[21]发现多种金属材料具有催化CO2还原的性质,但是其对不同产物的选择性存在巨大差异:In,Sn,Hg和Pb等倾向于将CO2转化为甲酸(盐),Au,Ag和Zn对CO具有较高的选择性,而金属Cu是唯一一种可以将CO2还原为多碳产物的材料.按照含碳数量分类,CO2RR产物可分成以下3类:C1产物,包括一氧化碳(CO)、甲烷、甲酸(盐)和甲醇;C2产物,如乙烯、乙烷和乙醇等;C3产物,如正丙醇、丙酮等.相对于C1产物,C2+(包括C2和C3等)产物被称为深度还原产物,它们具有更高的能量密度,同等体积或质量条件下可以储存更多能量;同时,深度还原产物的用途广泛、市场需求大、商业价值更高,运输和使用也更便捷[22-23].作为多碳烷烃类的代表产物,乙烯是合成纤维、橡胶、塑料等高聚物的重要化工原料.而在传统生产方式中,多碳烷烃类产物大多由化石能源裂解和催化重整而来,在生产过程中不可避免地产生温室气体,造成环境污染.若使用电催化还原CO2方法取代传统方法制备多碳烷烃,可以从源头减少温室气体的排放.因此,通过CO2RR制备得到深度还原产物具有非常重要的工业意义.

本文综述了近年来使用Cu基催化剂进行ECR反应,选择性生成深度还原产物的最新进展.其中,主要对CO2深度还原反应机理、Cu基催化剂的设计策略和电解池系统优化等3个方面进行阐述.
1 CO2深度还原反应机理
电催化CO2还原生成多碳产物是一个复杂的过程.首先,深度还原产物的生成通常涉及多种中间物种的多个基元反应步骤,反应路径复杂,在还原电位下会受到氢析出(HER)竞争反应的影响[29].其次,CO2电还原产物种类繁多,CO2存在2e-,4e-,6e-,8e-或12e-还原途径,在电催化过程中可能多种途径同时进行,产生如甲酸盐(HCOO-)、一氧化碳(CO)、甲烷(CH4)、乙烯(C2H4)、甲醇(CH3OH)和乙醇(C2H5OH)等多种产物[30-31].此外,不同形貌、结构和组成的催化剂会极大地影响催化反应的热力学和动力学过程,即使是同一种还原产物也可能来自不同的反应路径[32-34].上述3个原因使CO2RR生成深度还原产物机理的研究充满挑战.得益于现代表征技术的发展,研究人员通过原位X射线衍射、X射线光电子能谱、电子显微镜及同步辐射等表征技术,探究反应过程中催化剂的结构和成分变化,利用原位拉曼和原位红外光谱等技术捕捉反应过程中中间体及其动态变化过程,再结合密度泛函理论(density functional theory,DFT)计算,从理论角度对ECR的反应机理进行深入研究[35].


图1 CO2电还原生成不同还原产物的简要路径[36]Fig.1 Brief pathways of CO2 electroreduction to obtain different reduction products[36]

图2 CuAg双金属材料串联催化CO2生成乙烯的模型[38]Fig.2 Model of CuAg bimetallic tandem catalyst for conversion of CO2 to ethylene[38]
在实际体系中,催化剂的结构、形貌和成分非常复杂,这使得反应机理的研究显得格外困难.幸运的是,随着表征技术的不断进步及理论计算的迅速发展,通过构建模型催化剂进行机理研究成为一个非常有效的途径.以乙烯形成为例,早期的研究人员认为C2H4是通过2个*CH2的直接耦合而形成[37].然而,Schouten等[32]使用不同晶面的Cu单晶电极对CO还原生成乙烯的选择性进行研究,发现*CO二聚体才是真正的关键反应中间体.在过电位较高时,Cu(111)面倾向于形成*CHO中间体,并转化生成甲烷和乙烯两种产物;而Cu(100)晶面上能够得到大量的*CO中间体,从而高选择性地生成乙烯.因此,在催化剂表面生成和富集*CO能够极大促进C-C偶联步骤,提高多碳产物的选择性.除此之外,利用串联催化剂通过串联催化机制将CO2RR分为两步是提高多碳产物的一种有效策略.CuAg双金属材料串联催化CO2生成乙烯的模型[38],如图2所示.利用AgCu两种不同催化特性的金属催化剂进行CO2还原,在Ag表面形成大量的*CO并溢流到邻近的Cu表面,然后在Cu表面将*CO聚合形成多碳产物[38].通过串联催化剂这种拆分反应步骤的策略,可以大大提高Cu基催化剂的C-C偶联能力.
通过研究材料的构效关系,结合原位表征技术和理论计算,不仅能对已提出的机理进行验证,还能通过实验得到的结论提出新认识,从而推动机理研究的深入.同样地,对反应机理的深入理解可以为催化剂的设计合成提供建设性的指导,以*CO中间体二聚理论为例,对Cu基材料进行改性提高催化剂表面的局域CO浓度,可有效改善乙烯产物的选择性[39-40].受限于现有的模型催化剂制备技术和原位光谱时空分辨率,许多关键中间体仍未在实验中得到验证,特别是深度还原产物的生成机理尚不明确.
此外,影响CO2分子活化方式的因素有很多,比如局部的pH环境[41]、电解池系统结构[42]、过电势的大小[29]及催化剂的种类[43]等,在探究ECR的具体反应机理时,需要充分考虑这些影响因素.整体而言,目前的CO2RR反应机理的研究仍处于一个初级阶段[35].
2 Cu基催化剂改性策略
相对其他金属催化剂,Cu表面对*CO,*CHO和*COH等关键反应中间体具有相对适宜的吸附能,有利于将CO2深度还原为乙烯、乙醇和正丙醇等多种产物[44].然而,Cu基催化剂进行ECR反应生成多碳产物仍然面临巨大挑战.一方面,虽然Cu具有一定的C-C偶联能力,纯Cu电极对C2+产物的选择性并不理想[45].另一方面,Cu基材料往往需要较高的过电位,且电化学稳定性较差,限制了其工业化应用.为了促进Cu基催化剂的发展和应用,研究者从晶面、尺寸、载体和缺陷等方面对Cu基材料进行改性,以促进C-C偶联能力,提高深度还原产物选择性.
2.1 晶面效应
在早期的研究中,研究人员主要是使用Cu单晶模型电极进行ECR的构效关系研究.2003年,Hori等[46]在KHCO3溶液中对不同单晶Cu电极的ECR性能做了系统探索,研究发现,相比于Cu(111)晶面,Cu(100)晶面对乙烯具有更高的选择性,而将Cu(110)晶面引入Cu(100)能够进一步提高乙烯的选择性.单晶电极体系对于建立清晰的构效关系和进行机理研究具有非常重要的意义,但是这种电极的几何面积较小、电流密度低,无法满足实际生产需要[44,47].而纳米级的Cu基催化剂颗粒尺寸小,能够极大地提高电化学活性面积(electrochemical active surface area,ECSA),可以通过物理化学方法有效调控其表面结构,整体上提高ECR的反应活性和选择性[48].因此,合成具有特定晶面裸露的纳米晶,进行ECR性能研究具有非常重要的意义,也逐渐成为一个研究热点.
Suen等[49]制备了3种不同晶面裸露的Cu纳米晶体,即主要以(100)面为主的纳米立方体(C-Cu)、主要裸露Cu(111)晶面的八面体(O-Cu)和同时包含Cu(100)和(110)晶面的六方十二面体(H-Cu),并比较了3种Cu纳米晶催化剂的ECR性能.在电位较正的区域(>-0.8 V),3种材料的HER反应都比较激烈,法拉第效率(FE)均在50%以上.随着过电势变大,3种材料的ECR产物选择性开始出现明显差异:C-Cu的产物以乙烯为主,O-Cu的产物以乙烯和乙醇为主,H-Cu的产物以甲烷为主.与Hori等[46]在单晶电极中得出的结论不同,Suen等[49]发现,同时存在Cu(100)和Cu(100)晶面的H-Cu主要产物是甲烷而非乙烯,这说明单晶电极和纳米晶电极存在差异,其结论并不能完全适用于纳米晶.
2.2 尺寸效应
纳米晶的尺寸变化不仅会显著影响其比表面积,还会导致处于不同位置的表面原子比例发生显著变化,这些都会对ECR性能产生深刻影响.Loiudice等[50]合成了平均粒径分别为24,44,64 nm的3种Cu纳米立方体,在0.1 mol·L-1KHCO3溶液中对3种材料进行ECR测试.3种粒径Cu纳米立方体的法拉第效率[50],如图3所示.图3中:d为粒径.由图3可知:在-1.1 V电位下,3种粒径的Cu纳米立方体对乙烯的选择性呈火山型曲线关系,其中,粒径为44 nm的Cu纳米立方体对乙烯的选择性最高,其法拉第效率可达到41%.
同时,为了揭示该性能背后的原因,他们探究了Cu纳米立方体的边和角上Cu原子与Cu(100)面上Cu原子比例(Nedge/N100)与ECR性能的关系.不同粒径的Cu纳米立方体的面、角、边的原子比例[50],如图4所示.由图4可知:粒径为44 nm的Cu纳米立方体的Nedge/N100值为0.025,结果证明,当Nedge/N100高于0.025时,Cu纳米立方体的HER增强,数值较小则会导致样品乙烯选择性降低.此外,Handoko等[51]制备了不同尺寸的Cu2O衍生的Cu催化剂用于ECR测试,结果表明,在-0.98 V电位下,随着催化剂尺寸从41 nm减小到18 nm,其选择性生成乙烯的FE由10%显著提升至43%.通过分析催化过程中催化剂表面局部的pH值,研究者发现,随着Cu2O催化剂尺寸的减小,其表面的局部pH值明显升高,这可能是导致不同粒径催化剂选择性产生差异的重要原因.

图3 3种粒径Cu纳米立方体的法拉第效率[50] 图4 不同粒径Cu纳米立方体的面、角、边的原子比例[50] Fig.3 Faradic efficiency of Cu nanocubes Fig.4 Atomic ratios of faces, corners and edges of with three particle sizes[50] Cu nanocubes with different particle sizes[50]
2.3 载体效应
不同材料和结构的载体与催化剂的结合力差异较大,在电催化过程中会显著影响催化过程中的电子传导和溶液中的传质过程,因此,载体是ECR一个很关键的影响因素.Grosse等[52]使用电化学原子力显微镜(EC-AFM)和原位的X射线吸收光谱(in-situXAS),探究碳纸和多晶Cu箔两种载体对Cu纳米立方体的CO2RR性能的影响,结果如图5所示.图5中:RHE为相对可逆氢电极电位.由图5可知:当Cu纳米立方体负载到碳纸上时,随着电解的进行,Cu纳米立方体粒径逐渐变小,退化成不规则颗粒,并且被完全还原成金属Cu0,其乙烯选择性也逐渐降低,而甲烷等C1产物选择性提高;当载体为多晶Cu箔时,Cu纳米立方体的形貌则得到了很好的保持,即使经过长时间电解仍有部分Cu+得以保留.通过表征和分析,研究者认为Cu箔与Cu纳米立方体结合力比碳纸更强,使Cu纳米立方体能够更好地保持原本的尺寸和形貌,从而得到更好的催化稳定性.
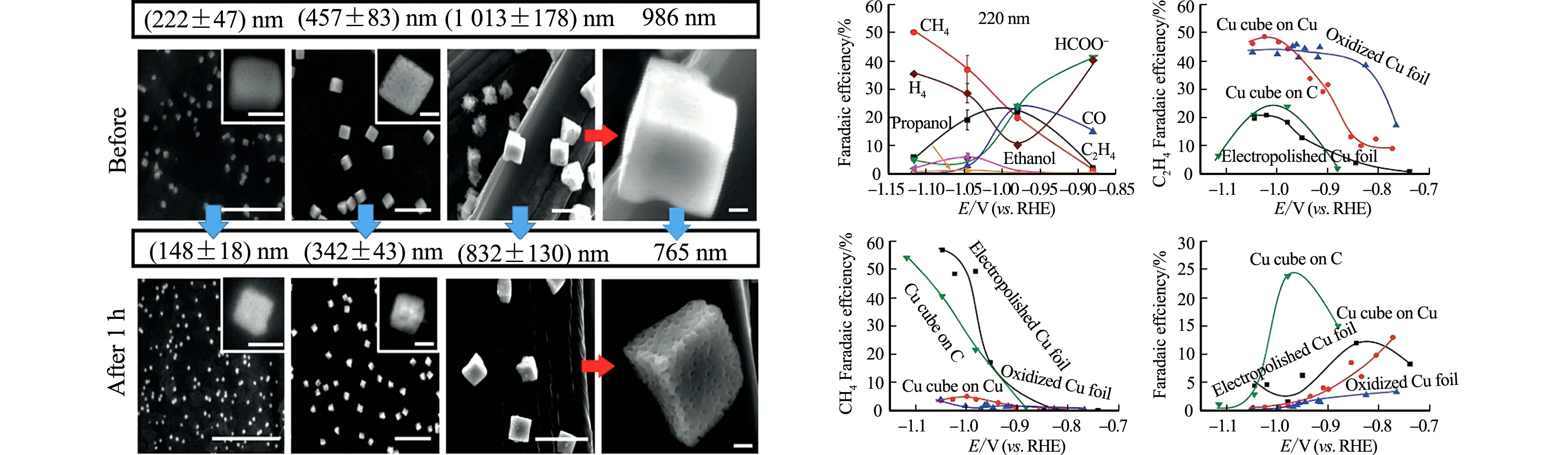
(a) Cu立方体在电催化过程中的退化 (b) 不同载体Cu纳米立方体的FE图5 载体对Cu纳米立方体ECR性能的影响[52]Fig.5 Effect of carriers on ECR performance of Cu nanocubes[52]
此外,一些功能性碳材料也常被用作ECR催化剂的载体.Dongare等[53]研究发现,当用氮掺杂石墨烯(nitrogen-doped graphene,NDG)作为载体时,相较于没有负载的Cu纳米颗粒,其电催化CO2RR生成液体产物的活性和选择性明显提高.同时,实验表明,Cu纳米颗粒的负载量与ECR性能呈现火山型曲线关系,当负载量为20%时,催化活性最高,在-1.0 V电位下的乙醇FE可达25.72%,电流密度为7.7 mA·cm-2.当负载量过低时,裸露的NDG会发生强烈的HER而消耗电能,抑制ECR的进行;当负载量过高时,大量的Cu纳米颗粒很容易发生聚集,导致ECSA降低,从而影响催化性能.除此之外,如果能利用石墨烯载体将催化剂颗粒包裹其中,也能够显著提高催化材料的结构稳定性.Phan等[54]使用石墨烯对多晶Cu表面进行包覆,随后采用电化学方法进行活化,使其表面形成大量尺寸可控的Cu立方体,研究发现,石墨烯层能够很好地保护电极表面的立方体结构,使具有C2+产物选择性的Cu(100)晶面得到保留,从而提高了活化后电极的稳定性.因此,选择合适的载体对于提高Cu基催化剂的电化学活性、选择性和稳定性具有非常重要的意义,甚至可以利用“封装”Cu基催化剂进一步提高催化稳定性.
2.4 缺陷效应
在晶体生长过程中往往会伴随缺陷的产生,而这些缺陷位置通常具有更高的能量,更有利于催化反应的进行.因此,很多研究者在催化剂中引入缺陷来调控催化性能,并探索富含大量缺陷纳米晶的可控合成.在ECR领域,富含缺陷的Cu基催化剂也受到了广泛关注.Choi等[55]合成了裸露Cu(100)面的纳米线(NWs),并对Cu NWs进行原位电化学活化,制备表面含有丰富台阶位的A-Cu NWs.富含缺陷Cu纳米线的模型和高分辨透射电镜图[55],如图6所示.由图6(b)可知:原本表面光滑的Cu线经过电化学活化后表面明显粗糙.这种富缺陷的Cu NWs在ECR测试中表现出优异的乙烯选择性,在-1.01 V电位下,其乙烯的FE高达77.4%.通过系统表征和DFT计算发现,在CO2RR反应过程中,A-Cu NWs的台阶状面(Cu(511)面)上的C1路径能垒比C2更高,更不容易发生HER,同时比Cu(100)或Cu(111)面具有更高的热力学稳定性,这充分解释了A-Cu NWs催化剂高ECR性能的原因.

(a) 模型 (b) 高分辨透射电镜图图6 富含缺陷Cu纳米线的模型和高分辨透射电镜图[55]Fig.6 Model and high-resolution transmission electron microscopy of defect-rich Cu nanowires[55]
除了表面晶格缺陷外,在催化剂中引入异质原子形成点缺陷,即形成异质原子掺杂的Cu基催化剂,也能够有效调控催化剂的电子结构及局部配位环境,从而改善ECR性能.Ma等[56]使用F-对Cu颗粒进行改性,极大提升了Cu材料选择性生成C2+产物的能力,在-0.8 V电位下,C2+产物的FE超过80%.研究者通过原位红外和DFT计算对反应机理进行研究,探究F-改性对乙烯路径的影响,提出乙烯生成路径.F-改性Cu催化剂表面ECR生成乙烯的反应路径及反应能垒图[56],如图7所示.Cu-F表面活化H2O产生的*H促使*CO进行质子耦合反应,生成*CHO中间体,随后经过C-C偶联生成乙烯的关键中间体*OCHCHO*.经DFT计算发现,相比于未经改性Cu表面生成*OCCO的反应路径,Cu-F表面生成*OCHCHO*能垒明显更低(图7(b)).通过F-对Cu进行改性,使得Cu-F具有活化水分子产生质子的能力,优化了乙烯和乙醇的反应路径,极大提高了Cu材料对C2+的选择性.

(a) 反应路径 (b) 反应能垒图图7 F-改性Cu催化剂表面ECR生成乙烯的反应路径及反应能垒图[56]Fig.7 Reaction pathways and reaction energy barrier diagram of ethylene generation by ECR on surface of F--modified Cu catalyst[56]
同样地,Li等[57]采用水热合成的方法制备含有卤素前驱体的纳米片,随后在原位的电化学条件下制备有Cl掺杂的多孔Cu纳米片,在经过原位的电化学活化后,这种材料的HER竞争反应受到明显的抑制,其C2+产物选择性的FE高达53.2%;经过长达240 h的长时间电解,Cl修饰后的Cu纳米片显示出极高的催化稳定性.通过对测试前、后的材料进行表征,发现多孔纳米片的形貌没有明显变化,Cl元素和Cu+在长时间电解后仍得到了保留,催化剂中的Cl元素稳定Cu+物种,从而保持极佳的催化稳定性.这些例子充分说明通过对缺陷的调控可以成为改性Cu基催化剂得到高ECR性能的有效途径.

图8 CTAB修饰对Cu电极表面电催化过程的3种影响[58]Fig.8 Three effects of CTAB modification on surface electrocatalytic process of Cu electrode[58]
2.5 配体效应
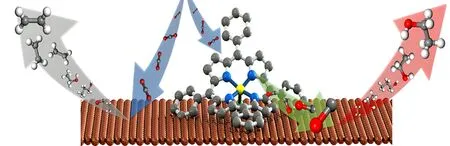
图9 四苯基卟啉铁(Ⅲ)氯化物对Cu材料增强机理示意图[59]Fig.9 Schematic diagram of enhancement mechanism of Cu materials by tetraphenylporphyrin iron (Ⅲ) chloride[59]
配体修饰可以调控纳米晶裸露晶面的表面能从而达到可控合成纳米粒子的目的,是纳米合成领域的常用策略之一.然而,配体同样会影响纳米晶催化剂的催化性能,可以通过改变配体的类型、浓度和键合强度等对催化剂性能进行调控.在ECR反应中,Banerjee等[58]研究了阳离子表面活性剂对Cu箔催化选择性的影响(图8),使用十六烷基三甲基溴化铵(CTAB)对Cu箔进行修饰,发现CTAB能够显著抑制Cu电极表面的析氢反应,提高表面活性剂浓度和增加烷基链长度能够提高碳酸氢钠溶液中CO2RR的选择性.研究者创造性地使用了电化学阻抗谱,用于监测CTAB存在下电极-电解质界面的演变,揭示了阳离子表面活性剂在催化剂表面的作用.相比于未经配体修饰的Cu箔,CTAB在电化学双层中积累置换了原本的H3O+和水合Na+,有效减少HER的可用质子源,极大优化了铜箔在催化体系中的催化环境,从而抑制HER反应,提高ECR性能.Li等[59]通过DFT计算,发现Cu(111)面上CO覆盖度的提高会极大增强其选择性生成乙醇的能力,并使用四苯基卟啉铁(Ⅲ)氯化物(FeTPP[Cl])分子催化剂(图9)对Cu表面进行修饰,这种分子催化剂在较宽的电势窗口下都能以60%的FE将CO2转换为CO;使用膜电极组件在水相系统下测试该分子催化剂修饰催化剂的催化性能,实验结果表明,使用FeTPP[Cl]进行修饰后,催化剂生成乙醇的过电位由-0.5 V提前到-0.4 V,选择性生成乙醇的活性和选择性都有了明显的提升.
就ECR领域而言,配体修饰多起到调控催化剂表面微环境的作用.相较于未经修饰的材料催化剂本身性质没有发生明显变化,而受配体影响,催化剂表面H2O,H+局部浓度的降低使材料局部pH值提高,CO2溶解度也随之增大,极大优化了CO2在催化体系中的传质过程.此外,一些具有活性的配体还能将CO2转换为CO,相较于未经修饰的Cu材料,其表面具有更高通量的CO,间接提高了Cu基材料选择性生成深度还原产物的能力.
2.6 双金属效应
合理构筑双金属催化剂能够充分发挥两种金属各自的优势,相互协同产生更加优异的性能,赋予催化剂更加丰富的电子结构.例如,一些非Cu基ECR催化剂(如Ag,Au等)只能将CO2还原为CO,但将此类金属引入Cu催化剂后能极大地提高Cu基材料对深度还原产物的选择性.究其原因,当产物为CO时,这类金属表面对*CO具有最适的结合能,因而能够高效率地将CO2转换为CO,而生成C2+产物则需要更高的结合能.当这种金属与Cu结合时,其表面生成的高通量*CO热力学自发地溢流至*CO结合能更高的Cu位点上进行C-C偶联,进而提高了Cu选择性生成C2+产物的能力.就晶体结构而言,向Cu基催化剂引入另一种金属时,由于晶格常数的差异,两者界面因应力会产生大量缺陷,如台阶表面、点空位、边缘/螺旋位错等.丰富的晶格缺陷可以作为高活性催化位点,进而极大地提高Cu基材料ECR的本征活性.此外,由于电负性的差异,该类金属的引入会使两种金属d轨道电子的数量及d带的填充发生变化,进而引起表面原子对特定物种(如*COH,*COOH,*CO)的吸附强度发生变化,Cu基催化剂的活性和选择性也随之发生改变.根据这个策略,研究人员通过引入客体金属合成一系列双金属Cu基异质串联催化剂,很好地增强了ECR性能.
Lü等[60]使用电沉积的方法,在Cu基底中掺杂Ag合成了AgCu双金属催化剂(图10(a)).Ag的引入导致Cu基底的粒径变大、Cu(100)面比例降低,并使Cu基底处于一种缺电子状态.在-0.95 V电位下,Ag掺杂后的样品对乙醇的FE由未掺杂时的0.5%提高到63%,极大地增强了Cu材料选择性生成乙醇的能力.值得注意的是,双金属纳米晶的元素分布方式和几何结构会对CO2RR产物的活性和选择性产生较大的影响.为了探究具体的影响,Ma等[61]分别制备了有序、无序合金和相分离3种Cu1Pd1双金属纳米颗粒.在电催化测试中,与有序和无序CuPd合金颗粒对比,相分离的CuPd颗粒具有较低的甲烷选择性及更高的乙烯和乙醇选择性.通过对机理的深入研究发现,Cu和Pd原子充分混合颗粒中Cu原子吸附的CO可能会与相邻Pd原子吸附的O原子结合生成CHO中间体,并进一步加氢还原成甲烷;而在相分离的CuPd颗粒中,相邻排列的Cu原子会促进CO发生二聚反应,从而更有利于C2+产物的生成.同时,Lü等[62]使用Pd二十面体为晶种合成具有五角双锥体、十面体、截角双四面体形貌的PdCu双金属异质催化剂.在ECR性能表征中,3种材料都表现出比单一Cu催化剂更优异的催化性能.其中,十面体的Pd-Cu选择性生成C2+产物的能力最佳,在-0.7 V电位下对C2+产物的选择性高达51%.在原位的衰减全反射傅里叶红外吸收光谱的表征过程中,发现PdCu异质催化剂比单金属Cu在更低的过电位下就出现了CO红外吸收信号,说明表面裸露的Pd促进了CO的生成,这为C2+产物的生成提供了丰富的*CO中间体;并且,富含孪晶界的Cu具有优异的C-C偶联能力,可以高效率地将Pd位点上溢流的CO进一步还原为多碳产物.
除了合金化或构筑异质双金属结构,单纯地将两种金属颗粒进行物理混合似乎也能很好地提高ECR性能.Iyengar等[63]将9 nm的Ag颗粒分别与Cu纳米立方体和Cu纳米八面体进行物理混合,在ECR测试中发现,添加Ag颗粒的Cu催化剂的HER反应活性都受到了极大的抑制;并且,在-1.3 V电位下,混有Ag颗粒的Cu纳米八面体对甲烷的高选择性转变为高的乙醇选择性,最高可达23.1%.除了双金属纳米晶,多金属催化剂具有更多变的成分和催化位点结构也引起了催化学家的兴趣.Xiong课题组[64]通过化学法合成三元AuAgCu金属框架(图10(b)),在CO2电还原过程中,AuAg上生成的CO被Cu充分利用,在-1.2 V电位下对乙烯的FE高达70%.

(a) CuAg双金属的制备及ECR过程[60] (b) CuAuAg三元金属框架的制备及表征[64]图10 Cu基多金属催化剂的制备及表征示意图Fig.10 Schematic diagram of preparation and characterization of Cu-based multimetallic catalysts
随着更多纳米合成领域研究者的加入,相信将会有越来越多的双金属甚至多金属ECR催化剂被成功合成,而随着纳米晶模型催化剂在性能测试中的广泛应用,ECR性能与纳米晶之间的构效关系也会逐渐清晰,使真正从理论上指导高效催化剂的理性构筑成为可能.
3 电解池系统优化
催化剂是电催化性能的核心,然而选择合适的测试系统及测试条件对充分发挥催化剂催化性能同样具有非常重要的意义.ECR一般使用传统的H型电解池(H-Cell)作为反应器,电解质为CO2饱和的碳酸氢盐溶液,随着ECR的发展,H型反应器的缺陷也日渐凸显[65].首先,H-Cell是一个传统的两相界面反应体系(电解质溶液和固体催化剂),反应效率较低.其次,电解质溶液中有限的CO2溶解度使得原料气的传输速度成为了速控步,极大地限制了催化剂催化性能的发挥[66].
为了解决上述问题,研究者试图从优化电解质溶液角度改进催化系统.1991年,Murata等[67]系统考察了不同阳离子对催化剂电催化CO2还原性能的影响,使用2 cm×2 cm的Cu箔作为工作电极,以锂、钠、钾、铷和铯5种阳离子的碳酸氢盐作为电解质溶液,测试其催化性能.研究发现,随着阳离子半径的增大,CO、乙烯和乙醇的FE提高,而甲烷的选择性降低,HER也得到了抑制;但是,如果使用高浓度的阳离子电解质溶液,无论哪种阳离子均会导致C2产物的选择性降低.研究者认为不同碱金属阳离子的水合能力及与电极的亲和性不同,导致电极表面的化学环境不同造成了性质上的差异,这意味着通过改变电解质离子改变催化过程的催化剂表界面会对ECR性能产生显著影响.
传统的H型电解池因CO2原料气直接通入溶液,无法使用高浓度碱液进行反应,气体扩散电极(gas-diffusion electrodes,GDEs)就可以使用高浓度的碱液来提高催化剂合成深度还原产物的能力.根据Dinh等[68]的研究,使用GDEs及流动池(flow-cell)相结合构成反应系统(图11(a)),其中,GDEs可以形成高效的气-液-固三相反应界面,使用气态的CO2气体直接作为反应原料突破了传统的电解质溶液的溶解度限制,而流动池可以保证CO2气体及还原产物的高效传输;在电解质方面,相较于KHCO3,高浓度的碱液如KOH溶液可以极大地提高催化剂C-C偶联的能力以提高C2+产物的选择性(图11(b)).Yang等[69]使用静电纺丝的方法制备单原子镍修饰的多孔碳膜,得益于其相互连接的纤维,自制的多孔碳膜催化剂具有良好的柔性,分层的多孔结构则提供了大量活性位点;分别在H-Cell和flow-cell系统中进行电化学测试,并对比催化剂在两种反应系统的性能表现.结果表明,在所有电势窗口下,使用GDEs测试表现出来的催化活性都明显优于H-Cell;在选择性上,催化剂在flow-cell中表现稳定,但是在H型电解池系统中,当电位低于-0.7 V后,对CO选择性就开始降低.通过构筑三相界面,GDEs能够显著提高催化剂的性能,同时抑制较负电位下的HER,扩宽催化剂的工作电势窗口.但是,在稳定性方面,由于高浓度碱液的存在,气体扩散层的疏水性能在较高电流下会逐渐减弱甚至消失,三相界面的消失使催化剂的活性迅速衰减.为了解决这一问题,Zhang等[70]将GDEs中常用的KOH更换为中性的KCl溶液(使用0.01 mol·L-1的KHCO3溶液作为缓冲液),使用自制电沉积Cu的GDEs在150 mA·cm-2的高电流下进行测试.测试结果显示,采用KCl电解质时,负载Cu的气体扩散层(gas diffusion layer,GDL)对C2+产物的FE由67.0%提升到80.4%;催化剂能够保持长达30 h的高电流的催化稳定性,而在KOH电解质中的样品对深度还原产物的选择性迅速衰减至初始的1/3.

(a) 气体扩散电极结构 (b) 不同浓度碱液下的ECR性能比较图11 气体扩散电极结构和不同浓度碱液下的ECR性能比较[68]Fig.11 Comparison of gas diffusion electrode structure and ECR performance under different alkali concentrations[68]
4 总结及展望
总结近期Cu基材料催化ECR深度还原产物的研究进展.CO2气体分子本身的化学惰性及其在水相反应体系中的低溶解度极大地限制了ECR效率,而反应路径复杂和HER竞争反应,导致通过C-C偶联及后续质子电子转移步骤生成深度还原产物变得格外困难.从多碳产物生成机理的3个关键步骤出发,结合实例简要介绍深度还原产物的反应路径.以催化机理为指导引出Cu基催化剂改性策略,比如,晶面效应、尺寸效应、缺陷效应、载体效应和双金属效应等,通过提高活性中间体的浓度降低C-C偶联反应的能垒,促进多碳产物的生成.使用气体扩散电极、提高阳离子浓度及提高碱液浓度等优化ECR测试系统的相关工作提高催化剂对C2+产物的选择性.但是,Cu基材料的ECR活性和稳定性问题及深度还原产物的反应机理研究仍然面临巨大的挑战,可以从以下2个方面进一步推进电催化CO2深度还原的研究.
1) 开发高活性和稳定性的Cu基纳米晶催化剂.高电流下长时间电解,Cu基催化剂易发生结构重构现象,其表面的价态也会发生变化,如原本高活性的Cu0/Cu1+混合态被还原为单一的Cu0导致催化剂失活,极大地限制了Cu基材料的实际应用.一方面,可以采取修饰策略对Cu材料进行改性,如掺杂卤素和引入杂原子,通过调控材料电子结构增强材料的ECR活性和稳定性.另一方面,构建双金属或者多金属Cu基金属间化合物,不仅能够充分利用多种金属原子间的协同作用,并且具有很高的化学稳定性;除此之外,使用石墨烯、Au壳层等高导电性、高稳定性的材料对Cu基催化剂进行包覆,可以有效保护其形貌不受破坏,进而提高催化剂的稳定性.
2) 利用原位表征技术深入研究催化机制.催化剂活性中心的结构对CO2RR性能起决定性作用,因此,确定及监测催化剂的活性组分及其在反应过程中的动态演化至关重要.然而,在ECR过程中Cu基材料的形貌和价态通常会随着反应的进行而变化,这就使传统的表征技术很难监测其演化过程进而识别真实的活性中心.虽然目前已经有一些报道使用原位电镜和原位光谱等手段对催化材料和反应中间体进行表征,但是深度还原产物的生成机理复杂、步骤复杂、反应中间体繁多,原位的监测技术还不够成熟,并没有形成公认的反应机理.因此,进一步提高原位检测技术的时空分辨率,能够为形成反应路径的闭环提供实验依据,真正指导高效工业催化剂的制备.

