嵌入TiO2微球中的CoO八面体有效增强可见光下光催化全分解水性能研究
时君友,刘亚楠,王静波,栾皓幄,林 雪
(北华大学 材料科学与工程学院,吉林 吉林 132013)
0 引言
随着时代的发展和科技的进步,人类将面临着能源短缺、环境污染等问题[1-4].因此,发展清洁无污染的可再生能源势在必行,尤其是将太阳能转化为最理想的氢能已成为人类需要突破的重要目标[5-7].为此,在不添加任何牺牲剂或助催化剂的情况下,使用由太阳光驱动的半导体光催化剂直接光催化分解水以产生H2和O2是一项非常有前途的技术[8-9].然而,光催化水分解不仅需要在热力学上克服237 kJ/mol的吉布斯自由能,而且涉及相对复杂和困难的多步四-电子/空穴转移过程,这导致开发高效且完全水解的光催化剂在这个领域仍然是一个巨大的挑战[10].
自1972年A.Fujishima等[11]报道二氧化钛(TiO2)可以在太阳光的驱动下进行水氧化还原反应生成氢气和氧气以来,由于其合适的能带结构、无毒性、良好的化学稳定性、低成本和高活性而受到人们广泛关注,并被认为是最有前景的光催化剂.然而,TiO2由于自身的缺陷而具有较宽的带隙(Eg=3.2 eV),仅在紫外范围内具有较高的光催化活性且光生电子容易快速复合[12].因此,需要设计和开发多种方法,如构建TiO2异质结、改变表面形貌、掺杂元素来抑制光生电子的复合,拓宽TiO2的吸收范围,使其吸收更多的可见光,进而提高其光催化活性[13-16].研究发现,构建异质结不仅拓宽了其光吸收范围,而且提高了光生电子分离和转移的效率,如ZnMn2O4/TiO2、BiVO4/TiO2、Cu2O/TiO2、CuO/TiO2等异质结光催化剂[17-20].Y.Fang等[21]制备了锐钛矿/金红石型TiO2/g-C3N4多异质结构光催化剂,随着复合材料的成功制备,锐钛矿型TiO2、金红石型TiO2和g-C3N4光生载流子的分离和转移效率得到显着提高,制氢性能也得到了显着提高.W.Zhang等[22]通过在TiO2/ZnTe同轴纳米棒表面均匀装饰Au纳米粒子制备了Z型TiO2/ZnTe/Au纳米棒异质结,该异质结可以有效利用太阳光,提高电子-空穴对的分离效率,从而提高光催化性能.
众所周知,CoO是一种高活性、完全水解的光催化剂,在可见光区具有很强的吸光性[23-24].CoO具有很强的光催化能力,并表现出前所未有的太阳能转换效率(STH=5%)[25].CoO带隙较窄(Eg=2.6 eV),并且TiO2在紫外区有很强的光吸收[26].因此,CoO和TiO2的复合结构不仅可以拓宽其光吸收范围,而且可以利用更多的太阳光.另外,它还可以抑制光生电子和空穴的复合,提高光催化活性,并获得高效的水分解性能[27].
本文通过简单的水热法成功制备了八面体CoO并负载在TiO2上.与单独使用CoO或TiO2相比,由于形成异质结,复合材料可以显著提高光催化全解水的效率.通过一系列测试与表征,分析了样品的结构和性能,最后提出了CoO/TiO2复合光催化剂的光催化机理.
1 实验
1.1 合成CoO/TiO2异质结光催化剂
采用简单的水热法合成了具有不同CoO质量比(0.5%、1%、3%、5%、10%)的CoO/TiO2复合材料,如图1所示.在磁搅拌下,向烧杯中添加64 mL正辛醇和16 mL乙醇,然后添加一定量的Co(CH3COO)2·4H2O和2 g TiO2粉末并搅拌2 h.将所得混合溶液转移到100 mL高压反应釜中,220 ℃加热4 h.当高压反应釜自然冷却至室温时,将所得产品离心并用乙醇洗涤数次,最后在真空烘箱中于60 ℃干燥.除了不加入TiO2粉末,纯相CoO的制备方法与上述操作类似.
图1 CoO/TiO2制备过程示意图Fig.1 Illustration of the preparation process of CoO/TiO2
1.2 表征手段
通过使用Cu-Kα辐射的X射线衍射(XRD)测定所制备样品的晶体结构(D/MAX-2500衍射仪,日本).使用拉曼光谱仪(LabRAM HR Evolution,HORIBA JobinYvon,法国)在室温下以532 nm为激发波长获得拉曼光谱.在加速电压为20 kV的FEI quanta 200显微镜下获得了扫描电子显微镜(SEM)图.使用150 W Al-KαX射线源,用Thermo ESCALAB 250X(美国)电子光谱仪测定了X射线光电子能谱(XPS).利用场发射电子显微镜(JEM-2100F,日本)在200 kV加速电压下观察了透射电子显微镜(TEM)、高分辨率TEM(HRTEM)图和选区能量色散X射线光谱(EDX).利用紫外-可见分光光度计(UV-2450,日本岛津)测量了样品的紫外-可见漫反射光谱(DRS).电化学阻抗谱(EIS)测试是使用CHI 660 C(中国辰华仪器)电化学工作站在标准三电极配置下进行.使用荧光分光光度计(Perkin Elmer LS 55)在室温下分析样品的光致发光(PL)光谱.
1.3 光催化实验
对于光催化反应,将50 mg光催化剂溶解在100 mL去离子水中.上述所有实验步骤均在磁搅拌下进行.可见光由配备有λ>420 nm长通波长滤光片的氙灯提供.氮气和空气作为载气,冷却循环系统中的冷却水温度保持在5 ℃.在线GC-7920气相色谱仪(GC)配备热导检测器(TCD)和0.5 nm分子筛柱,用于检测逸出气体.
2 结果与讨论
2.1 XRD和拉曼分析
利用XRD分析了CoO、TiO2和不同质量比的CoO/TiO2复合材料的晶相.如图2(A)所示,可以看出,36.4°、42.3°、61.6°、73.7°和77.6°处的纯CoO样品特征峰可以与CoO(JCPDS 70-2855)的(111)、(200)、(220)、(311)和(222)平面一一对应[28-29].同时可以看出,TiO2纳米颗粒具有纯锐钛矿结构,衍射峰位于25.3°、37.8°、48.0°、53.9°、55.1°、62.7°、68.8°和70.3°,对应于(101)、(004)、(200)、(105)、(211)、(204)、(116)和(220)晶面(JCPDS 65-5714).由此可见,CoO/TiO2复合材料没有额外的衍射峰,表明已经合成了高纯度的CoO/TiO2复合材料.然而,由于复合材料中的CoO含量较低,低百分比的CoO/TiO2复合材料显示出与纯TiO2相似的XRD谱图.CoO、TiO2和CoO/TiO2复合材料的拉曼光谱如图2(B)所示.TiO2纳米颗粒的特征峰为B1g(398 cm-1)、A1g+B1g(515 cm-1)、Eg(638 cm-1),对应于锐钛矿型TiO2的特征谱带[30].观察到的特征峰Eg(470 cm-1)、T2g(520 cm-1)、A1g(670 cm-1)与CoO的面心立方结构一致[31-32].由于CoO含量较低,在CoO/TiO2复合材料的拉曼光谱中没有观察到明显的CoO特征峰,这与XRD结果相似.
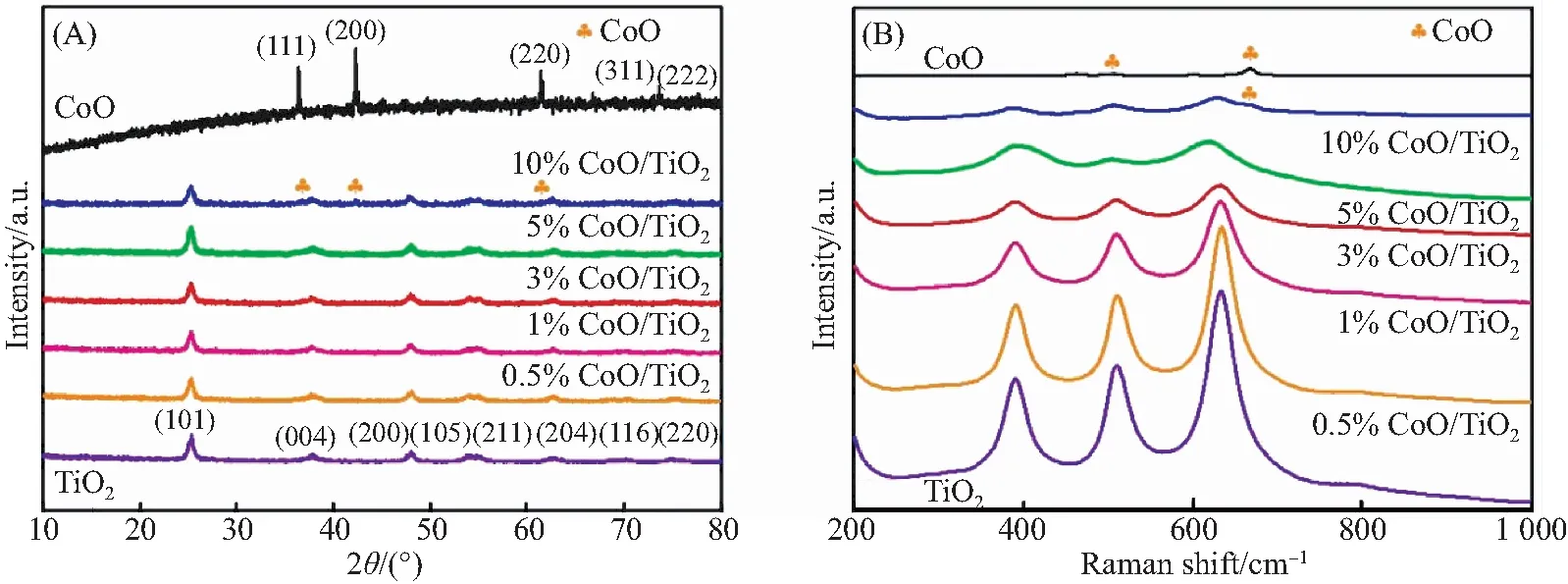
图2 CoO、TiO2和CoO/TiO2的XRD谱图(A)及拉曼谱图(B)Fig.2 XRD patterns (A) and Raman spectra (B) of CoO,TiO2 and CoO/TiO2
2.2 SEM和TEM分析
通过SEM和TEM获得了CoO、TiO2和CoO/TiO2复合材料的微观形貌和微观结构.如图3(A)所示,CoO具有规则的面心立方结构、光滑的表面、均匀的尺寸和良好的分散性.TiO2是不规则的大颗粒,具有明显的团聚(图3(B)).图3(C—D)为3% CoO/TiO2复合样品的SEM图.可以观察到八面体CoO已成功加载到TiO2表面.图4是该复合样品的TEM图.HRTEM(图4(B))显示,CoO和TiO2的晶格间距分别为0.254 nm和0.348 nm,对应于CoO的(111)表面和TiO2的(101)表面,这些表面与XRD结果一致[9].图4(C—F)是复合样品3% CoO/TiO2的元素映射图.Co、O和Ti存在于3% CoO/TiO2中,这证实了3% CoO/TiO2的成功制备.

图3 CoO (A)、TiO2(B)、3% CoO/TiO2(C—D)的SEM图Fig.3 SEM images of CoO (A),TiO2 (B) and 3% CoO/TiO2 (C—D)

图4 3% CoO/TiO2的TEM(A)、HRTEM(B)及元素映射(EDS)图谱(C—F)Fig.4 TEM (A),HRTEM (B) and EDS spectra as elemental mapping of Ti,O and Co (C—F) for 3% CoO/TiO2
2.3 XPS谱图分析
为了确定CoO、TiO2和3% CoO/TiO2复合材料的化学状态和表面组成,进行了X射线光电子能谱(XPS)分析.图5(A)为XPS全光谱测量,证明3% CoO/TiO2复合材料由三种元素组成:Co、O、Ti.如图5(B)所示,Co 2p的高分辨率光谱分别显示了780.3 eV和796.4 eV的两个典型峰值及其卫星特征,这归因于Co的Co 2p3/2和Co 2p1/2自旋轨道峰值[33].引入TiO2后,特征峰没有明显移动.图5(C)显示Ti 2p轨道在458.9 eV和464.4 eV处出现峰值,这可归因于Ti 2p3/2和Ti 2p1/2[34].引入CoO后,峰值位置没有明显移动.图5(D)显示了样品O 1s的高分辨率XPS光谱,其中CoO拟合峰的中心位于529.4 eV和531.1 eV,分别对应于晶格氧和吸附氧[35].位于530.3 eV和531.6 eV的TiO2典型O 1s峰分别归因于TiO2的Ti—O键和C—O化合物的存在[36].3% CoO/TiO2复合材料中O 1s的特征峰与纯相CoO和TiO2的特征峰一致,且未发生明显移动,表明复合材料的制备成功且不存在任何杂质.
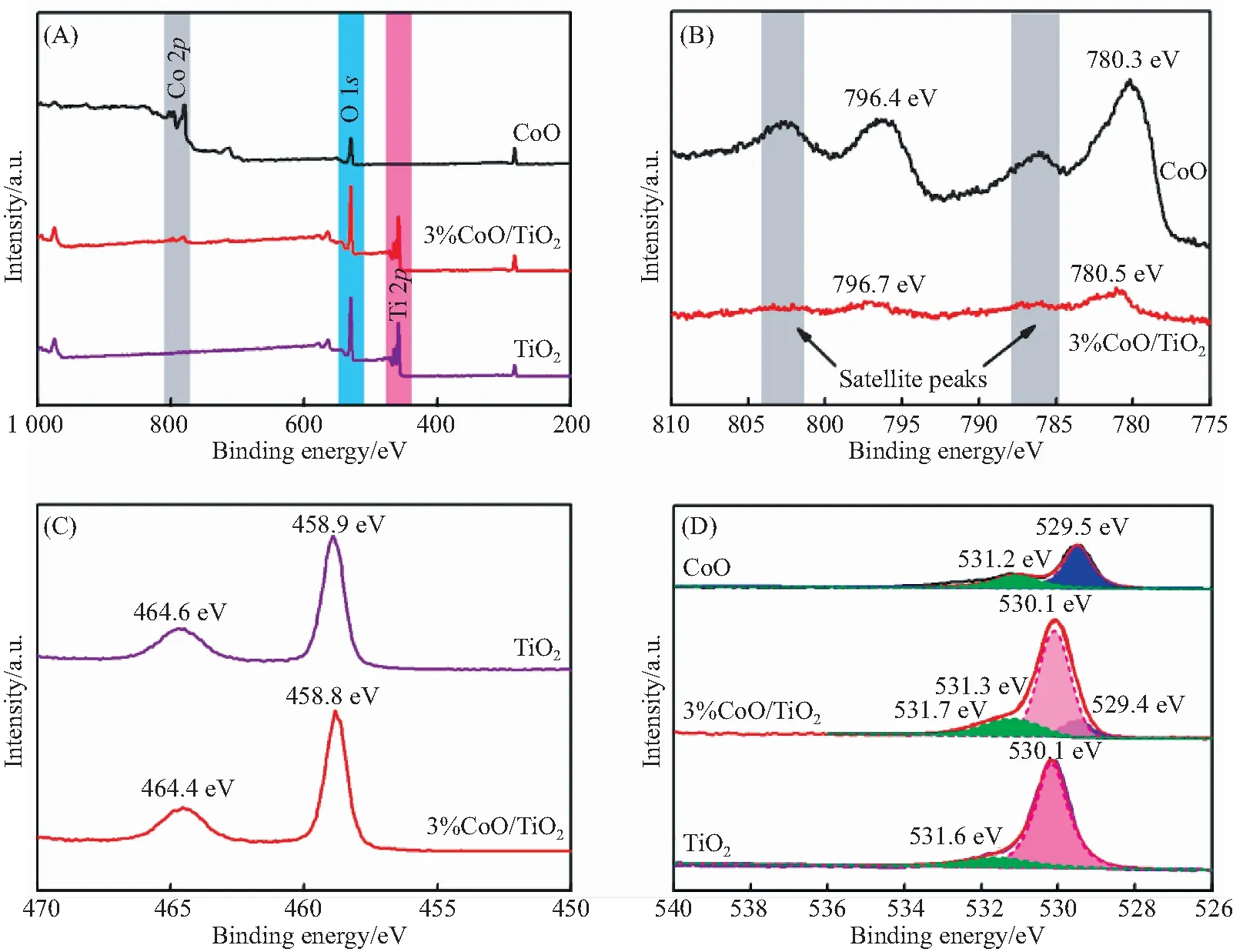
(A)全光谱;(B)Co 2p;(C)Ti 2p;(D)O 1s图5 CoO、TiO2和3% CoO/TiO2的XPS光谱Fig.5 XPS spectra of CoO,TiO2 and 3% CoO/TiO2
2.4 紫外可见光谱和光学带隙
如图6(A)所示,通过紫外-可见光分光光度计测试了CoO、TiO2和CoO/TiO2的光学性质.在CoO/TiO2的光谱中,可以观察到可见光区域的吸收增强.通常,半导体中的带隙与吸收波长范围有关,其中带隙随着吸收边的增加而减小.纯CoO在整个波长范围内具有很强的可见光吸收能力,具有两条明显的吸收边.一个是源于带隙吸收,而另一个是由Co2+到CoO的d轨道导带电子激发产生.TiO2吸收紫外线区域的光,其带状边缘为388 nm[37].与单组分样品相比,CoO/TiO2复合材料在吸收边缘没有明显的红移,但CoO/TiO2样品在可见光区域的吸收强度显著增强.这些结果表明,CoO和TiO2的组合将拓宽光吸收范围,并且可以使用更多的可见光,这更有利于光催化活性.根据Kubelka-Munk函数,计算出CoO、TiO2和CoO/TiO2的带隙分别为2.83、3.19、3.13 eV(图6(B)).
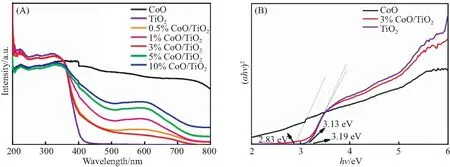
图6 CoO、TiO2和CoO/TiO2的紫外可见光谱(A)及光学带隙(B)Fig.6 UV-vis spectra (A) and optical bandgaps (B) of CoO,TiO2 and CoO/TiO2
2.5 VB-XPS和能带结构图
利用VB-XPS测量了负载在CoO上的TiO2纳米颗粒引起的价带电子结构的变化.从图7(A)可以看出,TiO2和制备的CoO的最大价带(VB)分别为3.1 eV和2.3 eV.如图7(B)所示,根据计算得出的CoO和TiO2的Eg和VB数据,结合公式Eg=EVB-ECB,可将CoO和TiO2的CB分别计算为-0.2 eV和-0.1 eV.
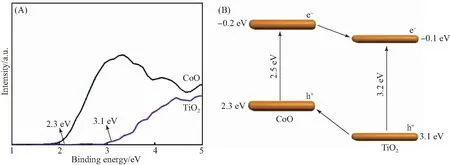
图7 CoO、TiO2的VB-XPS(A)及CoO/TiO2的能带结构图(B)Fig.7 VB-XPS of CoO and TiO2 (A) and band structure diagram of CoO/TiO2 (B)
2.6 光催化性能
在没有任何牺牲剂和助催化剂的情况下,在可见光下评估样品的光催化性能(λ≥ 420 nm).在没有可见光的情况下,在前2 h内无法在系统中检测到H2.在图8中,使用可见光照射系统后,研究了不同CoO含量的CoO/TiO2复合材料的光催化活性.研究发现,CoO和CoO/TiO2复合材料可以将所有水分解为H2和O2.此外,当CoO含量为3%时,光催化活性最好,是纯相的3倍.然而,当CoO含量为5%或10%时,无法检测到H2和O2的生成.
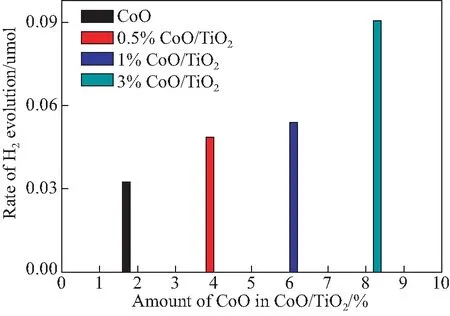
图8 CoO和CoO/TiO2的制氢Fig.8 Hydrogen production of CoO and CoO/TiO2
2.7 光电流和阻抗
图9(A)显示了CoO和3% CoO/TiO2复合材料在开路电位下的瞬态光学电路响应图,以反映光电流转换效率,其中开/关(λ≥ 420 nm)的时间保持在50 s.与单组分样品相比,在400 s试验后,3% CoO/TiO2复合材料显示出最高的光响应强度.此外,通过图9(B)中的电化学阻抗谱(EIS)测量研究了CoO和3% CoO/TiO2复合材料界面处的电荷转移.EIS-Nyquist图显示,3% CoO/TiO2复合材料的电弧半径小于纯CoO.电弧半径与电荷转移电阻有关,半径越小,电荷转移时电阻越低[3].这表明3% CoO/TiO2复合材料的界面电荷转移阻力最低,这进一步提高了电荷转移速率,从而提高了光催化活性.
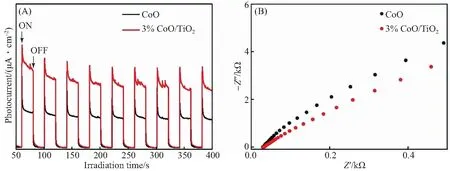
图9 CoO和3% CoO/TiO2的瞬态光电流响应(A)及EIS测量(B)Fig.9 Transient photocurrent response (A) and EIS measurements (B) of CoO and 3% CoO/TiO2
2.8 荧光和时间分辨荧光光谱
如图10(A)为CoO和3% CoO/TiO2复合材料的光致发光(PL)光谱.光致发光谱主要用于研究光生电荷的转移效率.如果电子-空穴对的复合率较高,光致发光强度将很强,这将导致催化剂的光催化活性降低.因此,光致发光强度与光催化活性有很大关系.从图10(A)可以看出,与纯CoO相比,3% CoO/TiO2复合材料的PL强度有所降低.这可归因于以下事实:3% CoO/TiO2复合材料中的CoO捕获TiO2导带中的光生电子,从而分离光生电子-空穴对并提高催化剂的光催化活性.根据公式τave=A1×τ1+A2×τ2计算,CoO、TiO2和3% CoO/TiO2的平均荧光寿命分别为23.94、42.76、23.25 ns[38].结果表明,复合材料的平均荧光寿命小于纯样品的平均荧光寿命,表明复合材料具有更有效的电子-空穴分离和转移效率(图10(B)),与瞬态光电流、EIS和PL的结果一致.
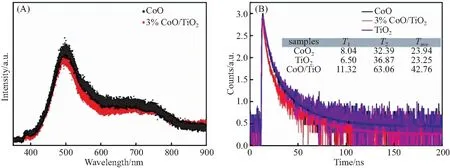
图10 CoO和3% CoO/TiO2的荧光光谱(A)及CoO、TiO2和3% CoO/TiO2的时间分辨荧光光谱(B)Fig.10 PL spectra of CoO and 3% CoO/TiO2 (A),and time-resolved PL spectra of CoO,TiO2 and 3% CoO/TiO2 (B)
2.9 光催化分解水机理
基于上述实验数据,提出了CoO/TiO2光催化分解水的潜在机理.如图11所示,在太阳光的激发下,CoO和TiO2可以分别产生电子和空穴.电子从CoO 和TiO2各自的价带(VB)跃迁到导带(CB),在VB中留下空穴.CB中的电子从CoO转移到TiO2,然后VB中的空穴从TiO2转移到CoO.最后,聚集在TiO2的CB上的电子参与了H+的还原,这大大提高了光催化制氢的效率.同时,CoO-VB中的空穴可以分解H2O生成O2.因此,与纯CoO相比,CoO/TiO2复合材料可以显著提高光生电子对的分离效率和光催化活性.
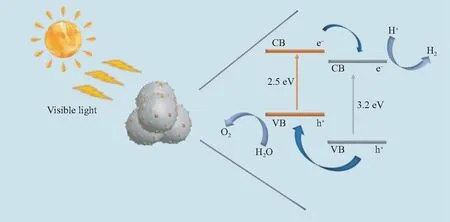
图11 可见光下CoO/TiO2异质结光催化分解水过程示意图Fig.11 Schematic illustration of photocatalytic water splitting process of CoO/TiO2 photocatalyst under visible light
3 结论
通过简单的水热法成功制备了CoO/TiO2复合光催化剂,其中TiO2纳米颗粒嵌入到正八面体CoO中.在没有任何牺牲剂和助催化剂的情况下,水的光催化分解生成的H2和O2分别为0.095 μmol/h和0.045 μmol/h.由于TiO2纳米颗粒嵌入到CoO表面,因此CoO/TiO2复合光催化剂的带隙变窄,这可以增强对光的响应,并显著提高光生电子和空穴的分离效率.

