桂枝中化学成分及抗肿瘤和抗炎活性研究
钱纯果,金 路,朱龙平,周 洋,黎润南,杨得坡,徐新军,赵志敏*
桂枝中化学成分及抗肿瘤和抗炎活性研究
钱纯果1, 2,金 路1, 2,朱龙平1, 2,周 洋1, 2,黎润南3,杨得坡1, 2,徐新军1, 2,赵志敏1, 2*
1. 中山大学药学院,广东 广州 510006 2. 广东省现代中药工程技术研究开发中心,广东 广州 510006 3. 德庆县德鑫农业发展有限公司,广东 肇庆 526600
对桂枝中非挥发性化学成分及其抗肿瘤、抗炎活性进行研究。运用D101大孔吸附树脂、正反相硅胶、Sephadex LH-20以及半制备HPLC等多种色谱方法进行分离纯化,并根据其波谱数据鉴定出化合物的结构;通过测定化合物对脂多糖(lipopolysaccharide,LPS)诱导小鼠RAW 264.7巨噬细胞释放一氧化氮(NO)的抑制能力,并采用MTT 法考察其对人乳腺癌MDA-MB-231细胞的体外抑制能力,进而评价化合物的抗炎和抗肿瘤活性。从桂枝甲醇提取物中共分离得到21个化合物,分别鉴定为表儿茶素(1)、2-(3,4-二羟苯基)乙基-β--吡喃葡萄糖苷(2)、3,5-二羟苯基-乙醇-3--β-吡喃葡萄糖苷(3)、staphylionoside D(4)、glochidionionoside C(5)、柑橘苷 A(6)、dendranthemoside A(7)、euodionoside G(8)、euodionoside F(9)、3,4,5-三甲氧苯基-1--β--呋喃芹糖-(1′′→6′)-β--吡喃葡萄糖苷(10)、淫羊藿次苷D1(11)、淫羊藿次苷F2(12)、(+)-lyonirenisol-3a--β--glucopyranoside(13)、l--guaiacylglycerol-8--β- glucopyranoside(14)、邻甲氧基肉桂醛(15)、肉桂醛(16)、肉桂酸(17)、4-羟基-3-甲氧基肉桂醛(18)、邻甲氧基苯甲酸(19)、(2,3) -5,7-二甲氧基-3′,4′-亚甲二氧基黄烷醇(20)、苯甲酸(21)。其中,化合物1、20为黄酮类化合物,2、3、10~12为芳香苷类化合物,4~9为降倍半萜苷类化合物,13、14为苯丙素苷类化合物,15~18为苯丙素类化合物,19、21为苯甲酸类化合物。抗炎、抗肿瘤活性筛选结果表明,化合物15可以有效降低MDA-MB-231细胞的存活能力,其半数抑制浓度(median inhibition concentration,IC50)为(34.11±3.42)μmol/L。化合物15、16、18、20对LPS诱导RAW264.7细胞释放NO具有一定的抑制作用,其IC50分别为(5.27±0.62)、(7.98±2.41)、(7.91±0.81)、(70.34±3.07)μmol/L。化合物2~10、12、14首次从桂枝中分离得到,其中化合物3、5~9、14首次从樟科植物中分离得到,化合物4首次从樟属植物中分离得到;化合物15能有效抑制人乳腺癌MDA-MB-231细胞的生长;化合物15、16、18、20可以显著抑制LPS诱导的RAW264.7细胞的NO释放,具有潜在的抗炎作用;桂枝的化学成分及活性研究为其物质基础研究、质量标准建立以及临床应用提供理论依据。
桂枝;肉桂醛;邻甲氧基肉桂醛;肉桂酸;抗炎;抗肿瘤
桂枝为樟科(Lauraceae)植物肉桂Presl的干燥嫩枝,主产于云南、广西、广东等地[1]。其性辛、甘、温,归心、肺、膀胱经,具有发汗解肌、温通经脉、助阳化气、平冲降气的作用,在临床上主要用于风寒湿痹的治疗,具有祛风散寒、清热豁痰和通经活血的功效[1-2]。迄今对桂枝的化学成分研究显示,从桂枝中分离鉴定出121种化合物,主要化学成分类别为苯丙素类、萜类、黄酮及其苷类、挥发油、有机酸、甾体、酚酸类和内酯类[3]。国内外对桂枝药理活性的研究表明,桂枝具有抗炎、抗菌、抗肿瘤、抗肥胖、抗病毒、抗抑郁、神经保护和舒张血管的作用[4-11]。前期有临床研究证明了含有桂枝的康妇消症片和桂枝茯苓丸对子宫肌瘤患者有治疗作用,近期研究表明桂枝茯苓胶囊可通过降低血清性激素(促黄体素、孕酮、雌二醇、卵泡刺激素)水平、增强自然杀伤细胞(NK)活性,辅助治疗子宫肌瘤[12-13]。为进一步明确桂枝中有效抗炎、抗肿瘤的活性成分,本课题组从桂枝甲醇提取物中分离得到21个化合物,分别鉴定为表儿茶素(epicatechin,1)、2-(3,4-二羟苯基)乙基-β--吡喃葡萄糖苷[2-(3,4-dihydroxyphenyl)ethyl-β-- glucopyranoside,2]、3,5-二羟苯基-乙醇-3--β-吡喃葡萄糖苷(3,5-dihydroxyphenethyl alcohol 3--β- glucopyranoside,3)、staphylionoside D(4)、glochidionionoside C(5)、柑橘苷A(citroside A,6)、dendranthemoside A(7)、euodionoside G(8)、euodionoside F(9)、3,4,5-三甲氧苯基-1--β--呋喃芹糖-(1′′→6′)-β--吡喃葡萄糖苷[3,4,5- trimethoxyphenyl-1--β--apiofuranosyl-(1′′→6′)- glucopyranoside,10]、淫羊藿次苷D1(icariside D1,11)、淫羊藿次苷F2(icariside F2,12)、(+)- lyonirenisol-3a--β--glucopyranoside(13)、l-- guaiacylglycerol-8--β-glucopyranoside(14)、邻甲氧基肉桂醛(-methoxy cinnamaldehyde,15)、肉桂醛(cinnamaldehyde,16)、肉桂酸(cinnamic acid, 17)、4-羟基-3-甲氧基肉桂醛(4-hydroxy-3-methoxy- cinnamaldehyde,18)、邻甲氧基苯甲酸(-anisic acid,19)、(2,3)-5,7-二甲氧基-3′,4′-亚甲二氧基黄烷醇[(2,3)-5,7-dimethoxy-3′,4′-methylene- dioxyflavan-3-ol,20]、苯甲酸(benzoic acid,21)。其中,化合物1、20为黄酮类化合物,2、3、10~12为芳香苷类化合物,4~9为降倍半萜苷类化合物,13、14为苯丙素苷类化合物,15~18为苯丙素类化合物,19、21为苯甲酸类化合物。化合物2~10、12、14首次从桂枝中分离得到,其中化合物3、5~9、14首次从樟科中分离得到,化合物4首次从樟属中分离得到。在化合物2~20体外活性评价中,化合物15对人乳腺癌MDA-MB-231细胞具有抑制活性,半数抑制浓度(median inhibition concentration,IC50)值为(34.11±3.42)μmol/L;化合物15、16、18、20可以显著抑制脂多糖(lipopolysaccharide,LPS)诱导的RAW264.7一氧化氮(NO)释放,具有潜在的抗炎作用,其IC50分别为(5.27±0.62)、(7.98±2.41)、(7.91±0.81)、(70.34±3.07)μmol/L。
1 仪器与材料
Bruker Avance III核磁共振仪(布鲁克拜厄斯宾有限公司);岛津LC-15C高效液相色谱仪(日本岛津公司);Ultimate AQ-C18色谱柱[月旭科技 (上海)股份有限公司];冷却水循环装置、水滤抽气机、水浴锅(上海爱郎仪器有限公司);Thermo MAT95XP EI高分辨质谱仪(美国Thermo Fisher公司);多功能酶标仪(德国BMG公司),细胞培养箱(美国Thermo Fisher公司);生物倒置显微镜(德国Leica公司);手提式压力蒸汽灭菌器(上海力辰邦西仪器科技有限公司);柱色谱硅胶、GF254薄层色谱硅胶板(青岛海洋化工公司);UniSil 30~120 C18(苏州纳微科技股份有限公司);甲醇HPLC(瑞典欧普森公司);分析纯化学试剂(天津致远精细化工有限公司),氘代试剂(美国CIL公司)。DMEM高糖培养基、胎牛血清、青霉素-链霉素(美国Gibco公司);总一氧化氮检测试剂盒(碧云天生物科技有限公司);MTT、二甲基亚砜(美国Sigma-Aldrich公司)。
实验用药材桂枝于2019年12月采自广东省德庆县凤村镇干相村,经中山大学杨得坡教授鉴定为肉桂Presl的干燥嫩枝。该植物标本(20191209)目前保存于中山大学药学院。
2 提取与分离
干燥桂枝8.26 kg粉碎后用甲醇室温浸泡提取3次,将滤液减压浓缩后得到的浸膏分散于水中,依次用石油醚、醋酸乙酯、正丁醇萃取,得到石油醚部位浸膏76.25 g、醋酸乙酯部位浸膏157.12 g、正丁醇部位浸膏278.63 g。正丁醇提取物经大孔吸附树脂D101分离,依次以甲醇-水(1∶4→1∶0)为洗脱剂进行梯度洗脱得到5个流分Fr. 1~5。Fr. 2 (7.75 g)经硅胶柱(100~200目)色谱,二氯甲烷-甲醇(98∶2→70∶30)梯度洗脱得到7个组分Fr. 2-1~2-7。Fr. 2-2(513.7 mg)经凝胶柱色谱分离,HPLC半制备色谱(20%乙腈)纯化,得到化合物1(3.0 mg,R=15 min)。Fr. 2-4(1.265 2 g)经C18反相柱色谱,甲醇-水(1∶9→1∶0)梯度洗脱得到16个组分Fr. 2-4-1~2-4-16。Fr. 2-4-4(41.1 mg)经HPLC半制备色谱(11%甲醇)纯化,得到化合物2(8.9 mg,R=22 min)。Fr. 2-4-5(44.3 mg)经 HPLC半制备色谱(20%甲醇)纯化,得到化合物3(11.0 mg,R=13 min)。Fr. 2-4-9(152.2 mg)经HPLC半制备色谱(15%甲醇)纯化,得到化合物10(63.4 mg,R=46 min)。Fr. 2-4-10(319.6 mg)经HPLC半制备色谱(28%甲醇)纯化,得到化合物4(11.9 mg,R=24 min)、5(4.6 mg,R=48 min)。Fr. 2-4-11(57.0 mg)经HPLC半制备色谱(25%甲醇)纯化,得到化合物6(3.8 mg,R=24 min)、7(3.4 mg,R=29 min)、13(22.1 mg,R=34 min)。Fr. 2-4-13(97.0 mg)经HPLC半制备色谱(26%甲醇)纯化,得到化合物8(9.1 mg,R=33 min)、9(6.0 mg,R=31 min)、11(8.8 mg,R=29 min)。Fr. 2-4-14(57.7 mg)经HPLC半制备色谱(28%甲醇)纯化,得到化合物12(12.4 mg,R=23 min)。Fr. 2-5(1.459 6 g)经C18反相柱色谱,HPLC半制备色谱(6%甲醇)纯化得到化合物14(18.7 mg,R=32 min)。
将石油醚,醋酸乙酯部位浸膏合并,经硅胶柱色谱(60~100目)以石油醚-醋酸乙酯(10∶1→0∶1)进行梯度洗脱,合并得到6个部分Fr. A~F,Fr. D(32.31 g)经反相C18柱色谱分离,用甲醇-水(30∶70~100∶0)进行梯度洗脱,得到4个组分Fr. D1~D4。Fr. D1(15.42 g)经C18反相柱色谱,硅胶柱(100~200目)色谱,HPLC半制备色谱(55%甲醇)纯化,得到化合物15(225.3 mg,R=24 min)、16(121.2 mg,R=18 min)、17(86.0 mg,R=20 min)、21(28.8 mg,R=15 min)。Fr. E(16.32 g)经C18反相柱色谱,甲醇-水(3∶7→1∶0)梯度洗脱得到9个组分Fr. E1~E9。Fr. E2(705.0 mg)经凝胶柱色谱分离,HPLC半制备色谱(52%甲醇)纯化,得到化合物18(5.6 mg,R=13 min)、19(5.5 mg,R=24 min)。Fr. E8(532.6 mg)经凝胶柱色谱分离,HPLC半制备色谱(54%甲醇)纯化,得到化合物20(13.1 mg,R=20 min)。
3 结构鉴定
化合物1:白色粉末(甲醇),ESI-MS/: 313.068 4 [M+Na]+,分子式为C15H14O6。1H-NMR (400 MHz, CD3OD): 6.97 (1H, d,= 1.5 Hz, H-2′), 6.80 (1H, dd,= 8.2, 1.5 Hz, H-6′), 6.76 (1H, d,= 8.2 Hz, H-5′), 5.94 (1H, d,= 2.2 Hz, H-8), 5.92 (1H , d,= 2.2 Hz, H-6), 4.82 (1H, brsH-2), 4.18 (1H, m, H-3), 2.86 (1H, dd,= 16.8, 4.4 Hz, H-4a), 2.73 (1H, dd,= 16.8, 2.8 Hz, H-4b);13C-NMR (100 MHz, CD3OD): 158.0 (C-5), 157.7 (C-7), 157.4 (C-9), 145.9 (C-3′), 145.8 (C-4′), 132.3 (C-1′), 119.4 (C-6′), 115.9 (C-2′), 115.3 (C-5′), 100.1 (C-10), 96.4 (C-6), 95.9 (C-8), 79.9 (C-2), 67.5 (C-3), 29.2 (C-4)。以上数据与文献报道一致[14],故鉴定化合物1为表儿茶素。
化合物2:无定形粉末(甲醇),ESI-MS/: 339.105 0 [M+Na]+,分子式为C14H20O8。1H-NMR (400 MHz, CD3OD): 6.68 (1H, d,= 2.0 Hz, H-2), 6.65 (1H, d,= 8.0 Hz, H-5), 6.54 (1H, dd,= 8.0, 2.0 Hz, H-6), 4.27 (1H, d,= 7.6 Hz, H-1′), 4.02 (1H, m, H-8a), 3.86 (1H, dd,= 11.3, 1.4 Hz, H-6′), 3.71~3.64 (3H, m, H-5′, 6′, 8), 3.30~3.25 (2H, m, H-2′, 3′), 3.17 (1H, m, H-4′), 2.77 (2H, m, H-7);13C-NMR (100 MHz, CD3OD): 146.1 (C-3), 144.6 (C-4), 131.5 (C-1), 121.2 (C-6), 117.1 (C-5), 116.3 (C-2), 104.4 (C-1′), 78.1 (C-5′), 77.9 (C-3′), 75.1 (C-2′), 72.1 (C-4′), 71.6 (C-8), 62.7 (C-6′), 36.5 (C-7)。以上数据与文献报道一致[15-16],故鉴定化合物2为2-(3,4-二羟苯基)乙基-β--吡喃葡萄糖苷。
化合物3:无定形粉末(甲醇),ESI-MS/: 339.104 9 [M+Na]+,分子式为C14H20O8。1H-NMR (400 MHz, CD3OD): 7.07 (1H, d,= 1.5 Hz, H-2), 6.75 (1H, d,= 1.5 Hz, H-6), 6.74 (1H, s, H-4), 4.75 (1H, d,= 7.2 Hz, H-1′), 3.90 (1H, dd,= 12.4, 2.0 Hz, H-6′a), 3.71 (3H, m, H-8, 6′b), 3.48 (2H, m, H-2′, 3′), 3.41 (2H, m, H-4′, 5′);13C-NMR (100 MHz, CD3OD): 146.9 (C-5), 146.6 (C-3), 132.0 (C-1), 125.2 (C-6), 119.5 (C-2), 117.0 (C-4), 104.4 (C-1′), 78.3 (C-3′), 77.6 (C-5′), 74.9 (C-2′), 71.4 (C-4′), 64.3 (C-8), 62.5 (C-6′), 39.5 (C-7)。以上数据与文献报道一致[17],故鉴定化合物3为3,5-二羟苯基-乙醇- 3--β-吡喃葡萄糖苷。
化合物4:无定形粉末(甲醇),ESI-MS/: 409.183 3 [M+Na]+,分子式为C19H30O8。1H-NMR (400 MHz, CD3OD): 5.84 (1H, s, H-8), 4.45 (1H, d,= 8.0 Hz, H-1′), 4.35 (1H, m, H-3), 3.88 (1H, dd,= 12.0, 1.6 Hz, H-6′a), 3.70 (1H, m, H-6′b), 3.16 (1H, dd,= 8.8, 8.0 Hz, H-2′), 2.38 (1H, ddd,= 13.0, 4.0, 2.0 Hz, H-4a), 2.18 (3H, s, H-10), 2.09 (1H, ddd,= 13.0, 4.0, 2.0 Hz, H-2a), 1.49 (1H, m, H-2b), 1.46 (1H, m, H-4b), 1.40 (3H, s, H-13), 1.39 (3H, s, H-11), 1.16 (3H, s, H-12);13C-NMR (100 MHz, CD3OD): 211.4 (C-9), 200.9 (C-7), 120.0 (C-6), 102.6 (C-1′), 101.2 (C-8), 78.1 (C-3′), 77.9 (C-5′), 75.1 (C-2′), 72.5 (C-3), 72.4 (C-5), 71.6 (C-4′), 62.7 (C-6′), 48.1 (C-4), 46.6 (C-2), 37.0 (C-1), 32.3 (C-12), 30.8 (C-13), 29.4 (C-11), 26.5 (C-10)。以上数据与文献报道一致[18],故鉴定化合物4为staphylionoside D。
化合物5:无定形粉末(甲醇),ESI-MS/: 409.182 7 [M+Na]+,分子式为C19H30O8。1H-NMR (400 MHz, CD3OD): 6.26 (1H, brs, H-4), 5.72 (1H, dd,= 15.5, 6.0 Hz, H-8), 5.61 (1H, dd,= 15.5, 9.0 Hz, H-7), 4.48 (1H, dd,= 16.6, 1.6 Hz, H-13a), 4.28 (1H, m, H-9), 4.27 (1H, d,= 7.7 Hz, H-1′), 4.26 (1H, m, H-13b), 3.87 (1H, dd,= 11.8, 1.8 Hz, H-6′a), 3.66 (1H, dd,= 11.8, 5.5 Hz, H-6′b), 3.35 (1H, m, H-3′), 3.29 (1H, m, H-4′), 3.27 (1H, m, H-5′), 3.24 (1H, m, H-2′), 2.75 (1H, d,= 9.0 Hz, H-6), 2.50 (1H, d,= 16.8 Hz, H-2a), 2.09 (1H, d,= 16.8 Hz, H-2b), 1.24 (3H, d,= 6.4 Hz, H-10), 1.04 (3H, s, H-11), 0.99 (3H, s, H-12);13C-NMR (100 MHz, CD3OD): 202.0 (C-3), 164.0 (C-5), 140.4 (C-8), 127.3 (C-7), 124.1 (C-4), 103.5 (C-1′), 78.1 (C-3′, 5′), 75.0 (C-2′), 71.6 (C-4′), 70.0 (C-13), 68.9 (C-9), 62.7 (C-6′), 52.0 (C-6), 48.9 (C-2), 37.1 (C-1), 27.9 (C-12), 27.5 (C-11), 23.8 (C-10)。以上数据与文献报道一致[19-20],故鉴定化合物5为glochidionionoside C。
化合物6:无定形粉末(甲醇),ESI-MS/: 409.183 0 [M+Na]+,分子式为C19H30O8。1H-NMR (400 MHz, CD3OD): 5.91 (1H, s, H-8), 4.33 (1H, m, H-3), 4.53 (1H, d,= 7.7 Hz, H-1′), 3.82 (1H, dd,= 11.7, 2.1 Hz, H-6′a), 3.62 (1H, dd,= 11.7, 5.2 Hz, H-6′b), 3.24~3.38 (3H, m, H-3′~5′), 3.15 (1H, dd,= 9.0, 7.7 Hz, H-2′), 2.49 (1H, ddd,= 13.4, 3.9, 2.0 Hz, H-4a), 2.20 (3H, s, H-10), 1.93 (1H, ddd,= 12.4, 3.9, 2.0 Hz, H-2a), 1.48 (3H, s, H-13), 1.38 (3H, s, H-12), 1.35 (1H, m, H-4b), 1.31 (1H, m, H-2b), 1.16 (3H, s, H-11);13C-NMR (100 MHz, CD3OD): 213.0 (C-9), 200.7 (C-7), 119.1 (C-6), 101.4 (C-8), 98.7 (C-1′), 78.7 (C-5), 78.6 (C-3′), 77.8 (C-5′), 75.3 (C-2′), 71.7 (C-4′), 63.8 (C-3), 62.9 (C-6′), 49.9 (C-2), 48.0 (C-4), 37.0 (C-1), 32.5 (C-13), 30.1 (C-12), 26.7 (C-11), 26.6 (C-10)。以上数据与文献报道一致[21],故鉴定化合物6为柑橘苷A。
化合物7:无定形粉末(甲醇),ESI-MS/: 413.214 2 [M+Na]+,分子式为C19H34O8。1H-NMR (400 MHz, CD3OD): 5.73 (1H, dd,= 15.7, 6.0 Hz, H-8), 5.56 (1H, dd,= 15.7, 0.8 Hz, H-7), 4.36 (1H, d,= 7.8 Hz, H-1′), 4.30 (1H, m, H-9), 3.96 (1H, m, H-3), 3.86 (1H, m, H-6′a), 3.66 (1H, m, H-6′b), 3.14 (1H, dd,= 9.0, 7.8 Hz, H-2′), 1.98 (1H, m, H-5), 1.83 (1H, m, H-4a), 1.69 (1H, t,= 12.0 Hz, H-2a), 1.58 (1H, ddd,= 12.0, 4.0, 2.0 Hz, H-2b), 1.50 (1H, q,= 12.4 Hz, H-4b), 1.25 (3H, d,= 6.4 Hz, H-10), 0.99 (3H, s, H-11), 0.91 (3H, s, H-12), 0.83 (3H, d,= 6.7 Hz, H-13);13C-NMR (100 MHz, CD3OD): 135.5 (C-8), 133.8 (C-7), 102.6 (C-1′), 78.3 (C-6), 78.1 (C-3′), 77.9 (C-5′), 75.6 (C-3), 75.1 (C-2′), 71.7 (C-4′), 69.2 (C-9), 62.8 (C-6′), 42.6 (C-2), 40.4 (C-1), 38.1 (C-4), 35.5 (C-5), 25.9 (C-12), 25.1 (C-11), 24.1 (C-10), 16.4 (C-13)。以上数据与文献报道一致[22],故鉴定化合物7为dendranthemoside A。
化合物8:无定形粉末(甲醇),ESI-MS/: 411.198 8 [M+Na]+,分子式为C19H32O8。1H-NMR (400 MHz, CD3OD): 6.18 (1H, brs, H-4), 4.63 (2H, dd,= 16.8, 1.6 Hz, H-13a), 4.34 (1H, d,= 7.7 Hz, H-1′), 4.26 (1H, dd,= 16.8, 1.6 Hz, H-13b), 3.87 (1H, dd,= 11.8, 1.5 Hz, H-6′a), 3.68 (1H, m, H-9), 3.66 (1H, m, H-6′b), 3.38~3.23 (4H, m, H-2′~5′), 2.54 (1H, d,= 17.5 Hz, H-2a), 2.02 (1H, d,= 17.5 Hz, H-2b), 2.01 (1H, t,= 5.2 Hz, H-6), 1.57~1.42 (4H, m, H-7, 8), 1.15 (3H, d,= 6.2 Hz, H-10), 1.10 (3H, s, H-11), 1.02 (3H, s, H-12);13C-NMR (100 MHz, CD3OD): 202.3 (C-3), 168.1 (C-5), 122.8 (C-4), 104.4 (C-1′), 78.1 (C-3′, 5′), 75.1 (C-2′), 71.5 (C-13), 71.6 (C-4′), 68.5 (C-9), 62.7 (C-6′), 48.6 (C-2), 47.8 (C-6), 39.5 (C-8), 37.4 (C-1), 28.8 (C-12), 27.6 (C-11), 27.5 (C-7), 23.5 (C-10)。以上数据与文献报道一致[23],故鉴定化合物8为euodionoside G。
化合物9:无定形粉末(甲醇),ESI-MS/: 411.199 1 [M+Na]+,分子式为C19H32O8。1H-NMR (400 MHz, CD3OD): 6.04 (1H, brs, H-4), 4.30 (1H, d,= 7.8 Hz, H-1′), 4.26 (1H, m, H-13a), 4.15 (1H, dd,= 17.8, 1.7 Hz, H-13b), 3.84 (1H, dd,= 11.8, 1.5 Hz, H-6′a), 3.78 (1H, dd,= 11.6, 6.2 Hz, H-9), 3.64 (1H, dd,= 11.8, 5.2 Hz, H-6′b), 3.36~3.24 (3H, m, H-3′~5′), 3.14 (1H, dd,= 8.8, 7.8 Hz, H-2′), 2.58 (1H, d,= 17.6 Hz, H-2a), 2.00 (1H, d,= 17.6 Hz, H-2b), 1.91 (1H, m, H-6), 1.66~1.41 (4H, m, H-7, 8), 1.23 (3H, d,= 6.2 Hz, H-10), 1.11 (3H, s, H-12), 1.01 (3H, s, H-11);13C-NMR (100 MHz, CD3OD): 202.5 (C-3), 172.6 (C-5), 121.4 (C-4), 104.2 (C-1′), 78.3 (C-3′), 77.8 (C-9, 5′), 75.3 (C-2′), 71.6 (C-4′), 65.1 (C-13), 62.8 (C-6′), 48.6 (C-2), 48.0 (C-6), 37.4 (C-1, 8), 28.8 (C-12), 27.7 (C-11), 27.2 (C-7), 22.0 (C-10)。以上数据与文献报道一致[23],故鉴定化合物9为euodionoside F。
化合物10:无定形粉末(甲醇),ESI-MS/: 501.157 2 [M+Na]+,分子式为C20H30O13。1H-NMR (400 MHz, CD3OD): 6.42 (2H, s, H-2, 6), 4.96 (1H, d,= 2.6 Hz, H-1′′), 4.80 (1H, d,= 7.2 Hz, H-1′), 4.04 (1H, dd,= 14.0, 5.2 Hz, H-6′), 3.93 (1H, d,= 9.6 Hz, H-4′′a), 3.87 (1H, d,= 2.6 Hz, H-2′′), 3.76 (6H, s, 3, 5-OCH3), 3.73 (1H, d,= 9.6 Hz, H-4′′b), 3.66 (3H, s, 4-OCH3), 3.53 (2H, s, H-5′′);13C-NMR (100 MHz, CD3OD): 155.9 (C-4), 154.7 (C-3, 5), 134.5 (C-1), 110.8 (C-1′′), 103.1 (C-1′), 96.2 (C-2, 6), 80.5 (C-3′′), 77.9 (C-2′′), 77.8 (C-3′), 77.0 (C-5′), 74.9 (C-4′′), 74.8 (C-2′), 71.6 (C-4′), 68.8 (C-6′), 65.3 (C-5′′), 61.2 (4-OCH3), 56.6 (3, 5-OCH3)。以上数据与文献报道一致[24-25],故鉴定化合物10为3,4,5-三甲氧苯基- 1--β--呋喃芹糖-(1′′→6′)-β--吡喃葡萄糖苷。
化合物11:无定形粉末(甲醇),ESI-MS/: 439.156 9 [M+Na]+,分子式为C19H28O10。1H-NMR (400 MHz, CD3OD): 7.25 (4H, d,= 4.4 Hz, H-2, 3, 5, 6), 7.17 (1H, m, H-4), 5.00 (1H, d,= 2.5 Hz, H-1′′), 4.28 (1H, d,= 7.8 Hz, H-1′), 4.04 (1H, m, H-8), 3.97 (1H, dd,= 11.2, 1.6 Hz, H-6′), 3.95 (1H, d,= 9.6 Hz, H-4′′), 3.89 (1H, d,= 2.5 Hz, H-2′′), 3.76~3.72 (2H, m, H-8, 4′′), 3.59 (1H, dd,= 10.7, 5.7 Hz, H-6′), 3.55 (2H, s, H-5′′), 3.39 (1H, m, H-5′), 3.34 (1H, m, H-3′), 3.27 (1H, d,= 9.4 Hz, H-4′), 3.17 (1H, dd,= 9.0, 7.8 Hz, H-2′), 2.93 (2H, m, H-7);13C-NMR (100 MHz, CD3OD): 140.0 (C-1), 130.0 (C-3, 5), 129.4 (C-2, 6), 127.2 (C-4), 111.0 (C-1′′), 104.4 (C-1′), 80.5 (C-3′′), 78.0 (C-3′, 2′′), 76.9 (C-5′), 75.0 (C-2′, 4′′), 71.8 (C-8), 71.7 (C-4′), 68.7 (C-6′), 65.5 (C-5′′), 37.3 (C-7)。以上数据与文献报道一致[26],故鉴定化合物11为淫羊藿次苷D1。
化合物12:无定形粉末(甲醇),ESI-MS/: 425.142 1 [M+Na]+,分子式为C18H26O10。1H-NMR (400 MHz, CD3OD): 7.43 (2H, d,= 7.2 Hz, H-2, 6), 7.33 (2H, m, H-3, 5), 7.27 (H, m, H-4), 5.05 (1H, d,= 2.5 Hz, H-1′′), 4.90 (1H, d,= 11.8 Hz, H-7a), 4.66 (1H, d,= 11.8 Hz, H-7b), 4.33 (1H, d,= 7.7 Hz, H-1′), 3.98~4.03 (2H, m, H-4′′, 6′a), 3.94 (1H, d,= 2.5 Hz, H-2′′), 3.78 (1H, d,= 9.6 Hz, H-4′′), 3.63 (1H, dd,= 11.2, 6.3 Hz, H-6′b), 3.60 (2H, s, H-5′′), 3.22~3.42 (4H, m, H-2′~5′);13C-NMR (100 MHz, CD3OD): 139.0 (C-1), 129.3 (C-2, 6), 129.3 (C-3, 5), 128.7 (C-4), 111.0 (C-1′′), 103.2 (C-1′), 80.6 (C-3′′), 78.0 (C-3′, 2′′), 77.0 (C-5′), 75.1 (C-4′′), 75.0 (C-2′), 71.8 (C-7, 4′), 68.7 (C-6′), 65.6 (C-5′′)。以上数据与文献报道一致[26],故鉴定化合物12为淫羊藿次苷F2。
化合物13:淡黄色粉末(甲醇),ESI-MS/: 605.220 4 [M+Na]+,分子式为C28H38O13。1H-NMR (400 MHz, CD3OD): 6.58 (1H, s, H-8), 6.43 (2H, s, H-2′, 6′), 4.42 (1H, d,= 6.2 Hz, H-4), 4.29 (1H, d,= 7.7 Hz, H-1′′), 3.89 (1H, dd,= 9.7, 5.5 Hz, H-3α), 3.85 (3H, s, 7-OMe), 3.83 (1H, m, H-6a′′), 3.74 (6H, s, 3′, 5′-OMe), 3.67 (1H, m, H-6b′′), 3.64 (1H, m, H-2α), 3.55 (1H, dd,= 10.9, 6.7 Hz, H-2β), 3.46 (1H, dd,= 9.7, 3.8 Hz, H-3β), 3.38 (1H, m, H-3′′), 3.35 (3H, s, 5-OMe), 3.30 (1H, m, H-4′′), 3.27 (1H, m, H-5′′), 3.25 (1H, m, H-2′′), 2.72 (1H, dd,= 15.0, 4.7 Hz, H-1a), 2.62 (1H, dd,= 15.0, 11.6 Hz, H-1b), 2.08 (1H, m, H-3), 1.71 (1H, m, H-2);13C-NMR (100 MHz, CD3OD): 148.9 (C-3′, 5′), 148.6 (C-7), 147.5 (C-5), 139.3 (C-1′), 138.9 (C-6), 134.4 (C-4′), 130.2 (C-9), 126.4 (C-10), 107.8 (C-8), 106.8 (C-2′, 6′), 104.8 (C-1′′), 77.9 (C-5′′), 78.2 (C-3′′), 75.1 (C-2′′), 71.6 (C-4′′), 71.4 (C-3a), 66.2 (C-2a), 62.8 (C-6′′), 60.2 (5-OMe), 56.8 (3′, 5′-OMe), 56.6 (7-OMe), 46.7 (C-3), 42.8 (C-4), 40.5 (C-2), 33.8 (C-1)。以上数据与文献报道一致[27],故鉴定化合物13为(+)-lyonirenisol-3a--β--glucopyranoside。
化合物14:无定形粉末(甲醇),ESI-MS/: 399.126 2 [M+Na]+,分子式为C16H24O10。1H-NMR (400 MHz, CD3OD): 6.99 (1H, d,= 1.6 Hz, H-2), 6.80 (1H, dd,= 8.0, 1.8 Hz, H-6), 6.75 (1H, d,= 8.0 Hz, H-5), 4.66 (1H, d,= 7.1 Hz, H-7), 4.39 (1H, d,= 7.3 Hz, H-1′), 3.85 (3H, s, 3-OCH3), 3.82 (1H, dd,= 12.0, 2.0 Hz, H-6′a), 3.78 (1H, m, H-8), 3.63 (1H, dd,= 12.0, 5.3 Hz, H-6′b), 3.52 (1H, dd,= 12.0, 3.4 Hz, H-9a), 3.36 (1H, dd,= 12.0, 6.0 Hz, H-9b), 3.33~3.22 (4H, m, H-2′~5′);13C-NMR (100 MHz, CD3OD): 149.0 (C-3), 147.4 (C-4), 133.4 (C-1), 120.8 (C-6), 116.0 (C-5), 111.5 (C-2), 105.3 (C-1′), 87.7 (C-8), 78.0 (C-5′), 77.8 (C-3′), 75.5 (C-2′), 75.0 (C-7), 71.4 (C-4′), 63.2 (C-9), 62.5 (C-6′), 56.3 (3-OCH3)。以上数据与文献报道一致[28],故鉴定化合物14为l--guaiacylglycerol-8--β-glucopyranoside。
化合物15:黄色粉末(三氯甲烷),ESI-MS/: 185.057 3 [M+Na]+,分子式为C10H10O2。1H-NMR (500 MHz, CDCl3): 9.66 (1H, d,= 7.9 Hz, H-9), 7.82 (1H, d,= 16.1 Hz, H-7), 7.52 (1H, d,= 7.6 Hz, H-6), 7.39 (1H, t,= 7.9 Hz, H-4), 6.98 (1H, t,= 7.6 Hz, H-5), 6.93 (1H, d,= 8.4 Hz, H-3), 6.77 (1H, dd,= 16.1, 7.9 Hz, H-8), 3.89 (3H, s, 2-OCH3);13C-NMR (125 MHz, CDCl3): 194.6 (C-9), 158.3 (C-2), 148.3 (C-7), 132.8 (C-4), 129.1 (C-8), 128.9 (C-6), 123.0 (C-1), 120.9 (C-5), 111.4 (C-3), 55.6 (2-OCH3)。以上数据与文献报道一致[29],故鉴定化合物15为邻甲氧基肉桂醛。
化合物16:黄色油状液体(三氯甲烷)。1H-NMR (500 MHz, CDCl3): 9.66 (1H, d,= 7.7 Hz, H-1), 7.53~7.40 (6H, m, H-3, 5~9), 6.68 (1H, dd,= 16.0, 7.7 Hz, H-2);13C-NMR (125 MHz, CDCl3): 193.6 (C-1), 152.7 (C-3), 133.9 (C-4), 131.2 (C-7), 129.0 (C-6, 8), 128.3 (C-2, 5, 9)。以上数据与文献报道一致[30-31],且3种不同系统展开,Rf与对照品肉桂醛一致,故鉴定化合物16为肉桂醛。
化合物17:白色粉末(甲醇)。1H-NMR (400 MHz, CD3OD): 7.76 (1H, d,= 16.0 Hz, H-3), 7.58 (2H, m, H-5, 9), 7.40 (3H, m, H-6~8), 6.48 (1H, dd,= 16.0, 1.3 Hz, H-2);13C-NMR (100 MHz, CD3OD): 170.4 (C-1), 146.3 (C-3), 135.8 (C-4), 131.4 (C-7), 130.0 (C-5, 9), 129.2 (C-6, 8), 119.3 (C-2)。以上数据与文献报道一致[32],且3种不同系统展开,Rf与对照品肉桂酸一致,故鉴定化合物17为肉桂酸。
化合物18:黄色粉末(三氯甲烷),ESI-MS/: 201.051 4 [M+Na]+,分子式为C10H10O3。1H-NMR (400 MHz, CDCl3): 9.64 (1H, d,= 7.8 Hz, H-1), 7.40 (1H, d,= 15.8 Hz, H-3), 7.12 (1H, dd,= 8.2, 1.9 Hz, H-6′), 7.07 (1H, d,= 1.9 Hz, H-2′), 6.96 (1H, d,= 8.2 Hz, H-5′), 6.59 (1H, dd,= 15.8, 7.8 Hz, H-2), 3.94 (3H, s, 3′-OCH3);13C-NMR (100 MHz, CDCl3): 193.8 (C-1), 153.3 (C-3), 149.1 (C-3′), 147.1 (C-4′), 126.8 (C-1′), 126.5 (C-2), 124.2 (C-6′), 115.1 (C-2′), 109.6 (C-5′), 56.1 (3′-OCH3)。以上数据与文献报道一致[33],故鉴定化合物18为4-羟基-3-甲氧基肉桂醛。
化合物19:白色针状结晶(三氯甲烷),ESI-MS/: 153.054 8 [M+H]+,分子式为C8H8O3。1H-NMR (400 MHz, CDCl3): 8.17 (1H, dd,= 7.8, 1.7 Hz, H-6), 7.57 (1H, td,= 8.7, 1.7 Hz, H-4), 7.13 (1H, t,= 7.6 Hz, H-5), 7.06 (1H, d,= 8.4 Hz, H-3), 4.07 (3H, s, 2-OCH3);13C-NMR (100 MHz, CDCl3): 165.7 (C=O), 158.2 (C-2), 135.2 (C-4), 133.9 (C-6), 122.3 (C-5), 111.8 (C-3), 117.7 (C-1), 56.8 (2-OCH3)。以上数据与文献报道一致[34],故鉴定化合物19为邻甲氧基苯甲酸。
化合物21:无色针晶(甲醇)。1H-NMR (400 MHz, CDCl3): 8.13 (2H, d,= 7.6 Hz, H-2, 6), 7.62 (1H, dd,= 7.6, 7.2 Hz, H-4), 7.48 (2H, dd,= 7.6, 7.2 Hz, H-3, 5);13C-NMR (100 MHz, CDCl3): 172.4 (C-1′), 133.9 (C-4), 130.4 (C-2, 6), 129.6 (C-1), 128.6 (C-3, 5)。以上数据与文献报道一致[36],且3种不同系统展开,Rf与对照品苯甲酸一致,故鉴定化合物21为苯甲酸。
4 活性筛选
4.1 抗肿瘤活性筛选
采用MTT比色法[37-38]评价化合物2~20对乳腺癌细胞株MDA-MB-231的体外抑制活性。取对数生长期的细胞接种于96孔板上,每孔5×103个,在37 ℃和5% CO2条件下培养。24 h后弃去上清液,加入含有溶剂DMSO或一定浓度药物的新鲜培养基继续培养96 h。随后,在避光条件下,每孔加入10 μL MTT溶液(5 mg/mL)。培养4 h后,弃去上层清液,每孔加入100 μL DMSO,震荡10 min后测570 nm处吸光度()。将溶剂对照组细胞存活能力定为100%,所有药物处理组的转化为细胞存活能力。细胞活力数据使用单因素方差分析(One-way ANOVA)检验总体均数是否存在显著差异后,使用Turkey posthoc检验对各组均数进行配对比较。对于差异具有统计学意义的化合物,使用Sigmoid曲线拟合化合物对MDA-MB-231细胞的IC50。
结果表明,化合物15可以有效降低MDA-MB-231细胞的存活能力,其IC50为(34.11±3.42)μmol/L,结果见图1。其他化合物的IC50均大于50 μmol/L,对MDA-MB-231细胞的存活能力无影响。
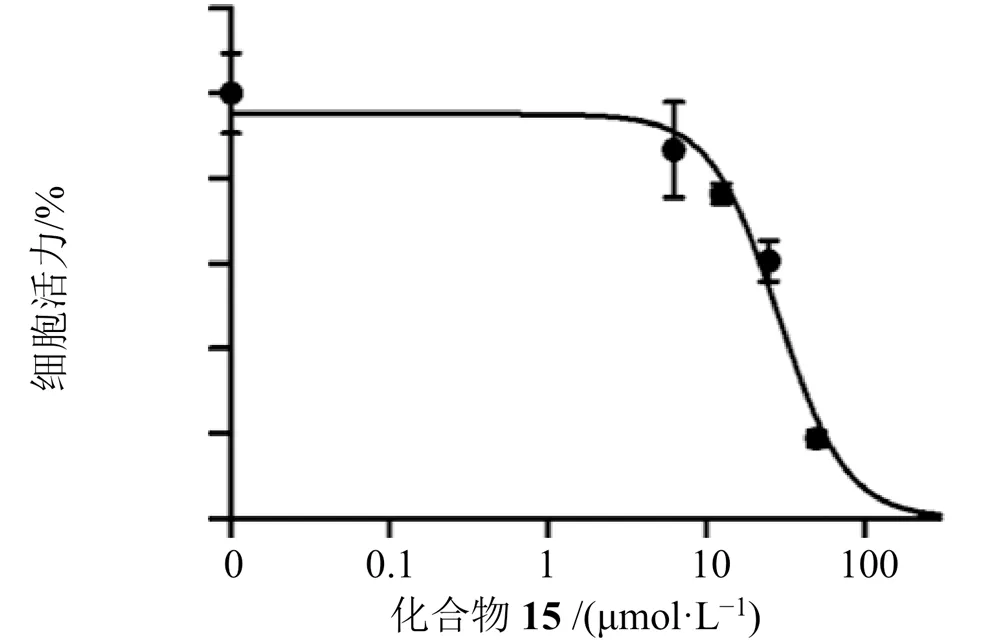
图1 化合物15对MDA-MB-231细胞活力的影响
4.2 抗炎活性筛选
比较不同化合物抑制LPS诱导RAW264.7细胞释放NO能力,对其抗炎活性进行评价[39-41]。取对数生长期的细胞接种于96孔板上,每孔3×104个。细胞在37 ℃和5% CO2条件下培养24 h,弃去上清液,加入含一定浓度药物(浓度分别为6.25、12.5、25、50和100 μmol/L)的新鲜培养基,0.1% DMSO作为溶剂对照。随后每孔加入100 ng/mL的LPS溶液。细胞在含有LPS的培养基中培养24 h后,取上清液按照NO比色分析试剂盒(S0021S)说明书中规定的方法测定540 nm处的吸光度。细胞活力使用MTT法测定(与上述抗肿瘤活性筛选方法一致)。数据使用单因素方差分析(One-way ANOVA)检验总体均数是否存在显著差异后,使用Turkey posthoc检验对各组均数进行配对比较。对于NO释放率差异具有统计学意义的化合物,使用Sigmoid曲线拟合化合物对LPS诱导RAW264.7细胞NO释放的IC50。
细胞活力测试结果显示不同化合物对RAW264.7巨噬细胞的活力无显著影响,同时化合物15、16、18、20可以显著抑制NO释放率,具有潜在的抗炎作用;其IC50分别为(5.27±0.62)、(7.98±2.41)、(7.91±0.81)、(70.34±3.07)μmol/L,结果见图2。其他化合物的浓度为100 μmol/L时,无法抑制LPS诱导巨噬细胞释放NO,即其他化合物IC50均大于100 μmol/L,抗炎作用较弱。
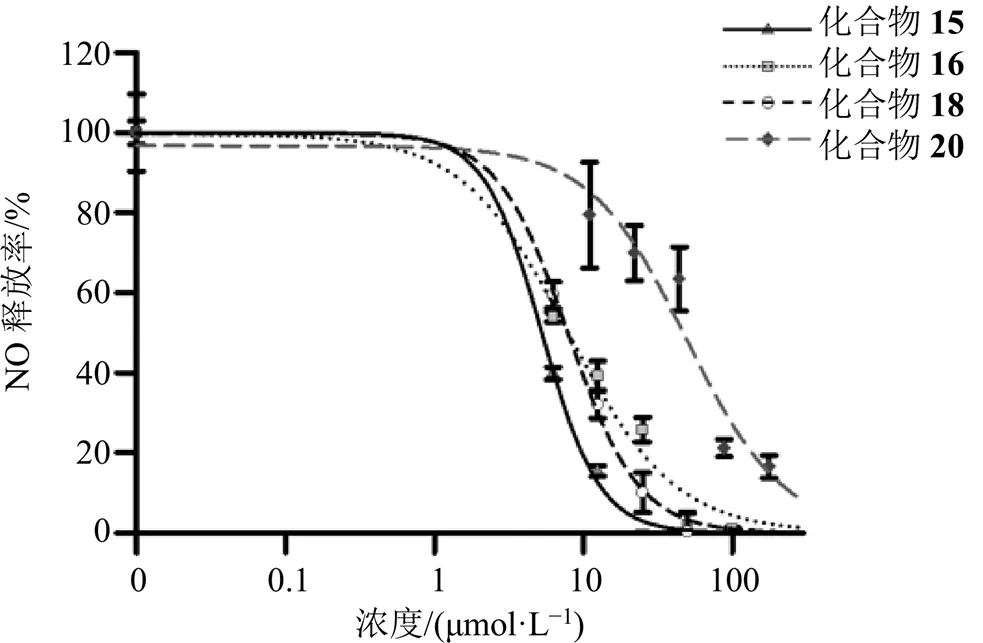
图2 化合物15、16、18和20对NO释放率的影响
5 讨论
现有研究表明,桂枝具有良好的抗肿瘤[42]、抗炎[43]活性。源自《金匮要略》的桂枝茯苓方,临床常用于治疗子宫肌瘤[44]、卵巢囊肿[45]、痛经[46]等妇科疾病。桂枝味辛性温,辛而发散,行气血,温则温经散寒,宣通痹闭,作为解表药的桂枝是类风湿关节炎寒湿痹阻证复方中的高频药物[47]。本研究通过对桂枝非挥发性成分,特别是正丁醇部位化合物的分离,丰富了桂枝的物质种类的认识。研究中,本课题组发现邻甲氧基肉桂醛为桂枝的主要成分之一[48],这一结果与文献报道一致。然而,目前国内外对桂枝的活性成分研究主要集中在肉桂醛、肉桂酸,缺乏对邻甲氧基肉桂醛的深入研究。本研究在对分离得到的化合物进行体外抗炎抗肿瘤活性筛查后,发现邻甲氧基肉桂醛在抗炎和抑制乳腺癌细胞增殖能力的活性均优于肉桂醛,初步推测邻甲氧基肉桂醛是桂枝发挥抗肿瘤作用的主要活性成分之一。在下一步的研究中,本课题组将进一步研究桂枝中肉桂醛、邻甲氧基肉桂醛对多种肿瘤细胞(如人宫颈癌HeLa细胞、结肠癌Ht-29细胞、人乳腺癌MCF-7细胞等)的抑制活性,以期为桂枝质量标准建立以及临床应用提供理论依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 288.
[2] 夏天卫, 周国威, 姚晨, 等. 桂枝及肉桂治痹的中医认识与现代药学研究进展 [J]. 中国实验方剂学杂志, 2019, 25(6): 218-226.
[3] Liu J, Zhang Q, Li R L,. The traditional uses, phytochemistry, pharmacology and toxicology of: A review [J]., 2020, 72(3): 319-342.
[4] 徐锋, 王德健, 王凤, 等. 桂枝挥发油的药理作用研究进展 [J]. 中华中医药杂志, 2016, 31(11): 4653-4657.
[5] Shin S H, Lee S R, Lee E,. Caffeic acid phenethyl ester from the twigs ofinhibits malignant cell transformation by inducing c-fos degradation [J]., 2017, 80(7): 2124-2130.
[6] Wang Y, Sun Y, Wang J,. Antifungal activity and action mechanism of the natural product cinnamic acid against[J]., 2019, 103(5): 944-950.
[7] Han Y, Jung H W, Bae H S,. The extract oftwigs inhibits adipocyte differentiation via activation of the insulin signaling pathway in 3T3-L1 preadipocytes [J]., 2013, 51(8): 961-967.
[8] Kang Y H, Shin H M.ethanol extract exerts vasorelaxation through inhibition of Ca influx and Ca release in rat aorta [J]., 2012, 2012: 513068.
[9] Niu B, Zheng F H, Xu J P. Protective effect of Gui Zhi () on abnormal levels of four amino acid neurotransmitters by chronically Ma Huang () intoxicated prefrontal cortex in rats treated with a Ma Huang-Gui Zhi herb pair [J]., 2020, 249: 112408.
[10] Yao Y, Huang H Y, Yang Y X,. Cinnamic aldehyde treatment alleviates chronic unexpected stress-induced depressive-like behaviors via targeting cyclooxygenase-2 in mid-aged rats [J]., 2015, 162: 97-103.
[11] Zhou J, Yuan X, Li L,. Comparison of different methods for extraction of: Yield, chemical composition andantiviral activities [J]., 2017, 31(24): 2909-2913.
[12] Sang H L. Clinical and experimental research into treatment of hysteromyoma with promotingflow and blood circulation, softening and resolving hard lump [J]., 2004, 24(4): 274-279.
[13] 杨娟, 徐伏兰, 王军. 桂枝茯苓胶囊对子宫肌瘤的作用研究 [J]. 中国继续医学教育, 2020, 12(1): 144-146.
[14] 胡江苗, 陈纪军, 赵友兴, 等. 山竺果壳的化学成分 [J]. 云南植物研究, 2006, 28(3): 319-322.
[15] Greca M D, Ferrara M, Fiorentino A,. Antialgal compounds from[J]., 1998, 49(5): 1299-1304.
[16] 刘召阳, 罗都强. 金莲花的化学成分研究 [J]. 中草药, 2010, 41(3): 370-373.
[17] Saracoglu I, Varel M, Harput U S,. Acylated flavonoids and phenol glycosides fromsubsp.[J]., 2004, 65(16): 2379-2385.
[18] Yu Q, Matsunami K, Otsuka H,. Staphylionosides A-K: Megastigmane glucosides from the leaves ofDC [J].:, 2005, 53(7): 800-807.
[19] Otsuka H, Kijima H, Hirata E,. Glochidionionosides A-D: Megastigmane glucosides from leaves of(Gaertn.) A. Juss [J]., 2003, 51(3): 286-290.
[20] 陈亚军, 王知斌, 于莹, 等. 八仙花叶中紫罗兰酮类化合物的分离和结构鉴定 [J]. 中医药信息, 2017, 34(4): 14-17.
[21] 温晶, 史海明, 昝珂, 等. 刘寄奴的化学成分研究 [J]. 中草药, 2010, 41(6): 870-873.
[22] Otsuka H, Takeda Y, Yamasaki K,. Structural elucidation of dendranthemosides A and B: Two new beta-ionone glucosides from[J]., 1992, 58(4): 373-375.
[23] Yamamoto M, Akita T, Koyama Y,. Euodionosides A-G: Megastigmane glucosides from leaves ofmeliaefolia [J]., 2008, 69(7): 1586-1596.
[24] 杜冰曌, 张和新歌, 杨鑫瑶, 等. 岗梅茎的化学成分研究 [J]. 中国中药杂志, 2017, 42(21): 4154-4158.
[25] Kanchanapoom T, Kasai R, Yamasaki K. Iridoid and phenolic glycosides from[J]., 2002, 59(5): 551-556.
[26] Anh N H, Ripperger H, Porzel A,. Neolignans from[J]., 1997, 46(3): 569-571.
[27] Balázs B, Tóth G, Duddeck H,. Iridoid and lignan glycosides fromL [J]., 2006, 20(2): 201-205.
[28] 瞿璐, 李晓霞, 陈玥, 等. 鸡血藤中的酚酸类化合物 [J]. 热带亚热带植物学报, 2014, 22(3): 301-306.
[29] Huong D, Jo Y S, Lee M K,. Monoamine oxidase inhibitors from[J]., 2000, 6(1): 16-19.
[30] Bharathi P, Periasamy M. Metalation of iminium ions formed in the reaction of tertiary amines with TiCl4[J]., 1999, 1(6): 857-859.
[31] Liu Y Y, Wang B L. 2-iodoxybenzenesulfonic acid-catalysed oxidation of primary and secondary alcohols with oxone in cetyl trimethylammonium bromide micelles at room temperature [J]., 2014, 38(7): 427-431.
[32] 梁文娟, 郗建宇, 尹迪, 等. 美丽芍药中酚酸类成分的研究 [J]. 中成药, 2020, 42(6): 1512-1515.
[33] Kwon H C, Lee K R. Phytochemical constituents ofssp.[J]., 2001, 24(3): 194-197.
[34] 薛晓霞, 仲浩, 姚庆强. 一枝黄花化学成分的研究 [J]. 中草药, 2008, 39(2): 182-184.
[35] Ku Y L, Chen C H, Lee S S. Chemical constituents fromII [J]., 2006, 20(13): 1199-1206.
[36] 王兴娜, 杜建厂, 谭仁祥, 等. 担子菌黄卷缘齿菌的化学成分 [J]. 中草药, 2005, 36(8): 1126-1130.
[37] Chen J L, Tang C L, Zhou Y,. Anti-inflammatory property of the essential oil from(Linn.) Presl leaves and the evaluation of its underlying mechanism by using metabolomics analysis [J]., 2020, 25(20): 4796.
[38] Kumar P, Nagarajan A, Uchil P D. Analysis of cell viability by the MTT assay [J]., 2018, doi: 10.1101/pdb.prot095505.
[39] Bai B, Ye S X, Yang D P,. Chloraserrtone A, a sesquiterpenoid dimer from[J]., 2019, 82(2): 407-411.
[40] Dirsch V M, Stuppner H, Vollmar A M. The Griess assay: Suitable for a bio-guided fractionation of anti-inflammatory plant extracts? [J]., 1998, 64(5): 423-426.
[41] Schmidt H H, Warner T D, Nakane M,. Regulation and subcellular location of nitrogen oxide synthases in RAW264.7 macrophages [J]., 1992, 41(4): 615-624.
[42] Park G H, Song H M, Park S B,. Cytotoxic activity of the twigs ofthrough the suppression of cell proliferation and the induction of apoptosis in human colorectal cancer cells [J]., 2018, 18(1): 28.
[43] Mateen S, Shahzad S, Ahmad S,. Cinnamaldehyde and eugenol attenuates collagen induced arthritis via reduction of free radicals and pro-inflammatory cytokines [J]., 2019, 53: 70-78.
[44] 姚祺, 郭辉, 陈玲玲, 等. 桂枝茯苓丸抗大鼠子宫肌瘤作用机制研究[J]. 世界中医药, 2020, 15(24): 3761-3766.
[45] 张萌. 自拟加味桂枝茯苓汤治疗血瘀型卵巢囊肿的临床观察 [D]. 哈尔滨: 黑龙江中医药大学, 2018.
[46] 姜珊珊. 桂枝茯苓丸加减治疗气滞血瘀型子宫内膜异位症所致痛经的临床观察 [D]. 哈尔滨: 黑龙江中医药大学, 2019.
[47] 柳春, 梁永林, 姚柳伊. 类风湿关节炎寒湿痹阻证用药规律研究 [J]. 中国中西医结合杂志, 2013, 33(9): 1269-1272.
[48] Wu X, He J, Xu H,. Quality assessment ofby the simultaneous analysis of multiple active components using high-performance thin-layer chromatography and high-performance liquid chromatography [J]., 2014, 37(18): 2490-2498.
Study on chemical constituents, antitumor and anti-inflammatory activities of
QIAN Chun-guo1, 2, JIN Lu1, 2, ZHU Long-ping1, 2, ZHOU Yang1, 2, LI Run-nan3, YANG De-po1, 2, XU Xin-jun1, 2, ZHAO Zhi-min1, 2
1. School of Pharmaceutical Science, Sun Yat-Sen University, Guangzhou 510006, China 2. Guangdong Technology Research Center for Advanced Chinese Medicine, Guangzhou 510006, China 3. Deqing County Dexin Agricultural Development Co., Ltd., Zhaoqing 526600, China
To investigate the chemical constituents, antitumor and anti-inflammatory activities of extracts from the non-volatile component of Guizhi ().The compounds were isolated and purified by various chromatographic techniques, including D101, silica gel, Sephadex LH-20 and semi-preparative HPLC, and their structures were identified based on combining spectral analysis with chemical evidence. Their potential anti-tumor and anti-inflammatory effects were evaluated on human breast cell line (MDA-MB-231) and murine macrophage cell line (Raw264.7), respectively.A total of 21 compounds were isolated from the methanol extract ofand identified as epicatechin (1), 2-(3,4-dihydroxyphenyl)ethyl-β--glucopyranoside (2), 3,5-dihydroxyphenethyl alcohol 3--β-glucopyranoside (3), staphylionoside D (4), glochidionionoside C (5), citroside A (6), dendranthemoside A (7), euodionoside G (8), euodionoside F (9), 3,4,5-trimethoxyphenyl-1--β--apiofuranosyl-(1′′→6′)glucopyranoside (10), icariside D1 (11), icariside F2 (12), (+)-lyonirenisol-3a--β--glucopyranoside (13), l--guaiacylglycerol-8--β-glucopyranoside (14),-methoxy cinnamaldehyde (15), cinnamaldehyde (16), cinnamic acid (17), 4-hydroxy-3-methoxycinnamaldehyde (18),-anisic acid (19), (2,3)-5,7- dimethoxy-3′,4′-methylenedioxyflavan-3-ol (20), and benzoic acid (21). Compounds 1 and 20 were flavonoids, 2—3 and 10—12 were aromatic glycosides, 4—9 were norsesquiterpenoid glycosides, 13—14 were phenylpropanoid glycosides, 15—18 were phenylpropanoids, and 19 and 21 were phenolic acids. Anti-inflammatory and anti-tumor assaysshowed that compound 15 effectively reduced the viability of MDA-MB-231 cells with IC50of (34.11 ± 3.42) μmol/L. Compounds 15—16, 18 and 20 inhibited releases of NO induced by LPS from RAW 264.7 cells with IC50of (5.27 ± 0.62), (7.98 ± 2.41), (7.91 ± 0.81), and (70.34 ± 3.07) μmol/L respectively.Compounds 2—10, 12, and 14 are isolated from this plant for the first time. In addition, compounds 3, 5—9, and 14 are found in the Lauraceae for the first time, while compound 4 is isolated fromfor the first time. Compound 15 can inhibit the proliferation of human breast cancer cells MDA-MB-231. Compounds 15—16, 18, and 20 can significantly inhibit LPS-induced NO release from RAW264.7, indicating their potential anti-inflammatory effects. The study on the chemical composition, as well as the activity ofmay shed new light on its material basis, quality standard establishment and clinical application.
; cinnamaldehyde;-methoxy cinnamaldehyde; cinnamic acid; antitumor; anti-inflammatory activities
R284.1
A
0253 - 2670(2022)01 - 0031 - 10
10.7501/j.issn.0253-2670.2022.01.006
2021-10-09
广东省农业科技创新及推广体系建设项目(2021KJ268,2021KJ142,2020KJ142);广东省重点领域研发计划(2020B020221002,2020B1111110003)
钱纯果(1997—),女,在读硕士研究生,研究方向为生药与天然药物化学。Tel: 15603057062 E-mail: qianchg@mail2.sysu.edu.cn
赵志敏,副教授,研究研究生导师,主要从事中草药活性物质基础及其作用机制研究。Tel: (020)39943043 E-mail: zhaozhm2@mail.sysu.edu.cn
[责任编辑 王文倩]