巧设装置利用二氧化碳排空气法制备氢氧化亚铁
山东省聊城市第一实验学校(252000) 杨志义
1 问题的提出
Fe(OH)2的制备是人教版高中化学必修第一册第3章第1节的重要内容,也是高中阶段重要的实验。此实验有利于学生理解Fe(OH)2和Fe(OH)3的相关化学性质,有利于学生从元素化合价的角度认识物质之间的转化。
Fe(OH)2制备的一般原理是:Fe粉和稀H2SO4反应生成FeSO4,FeSO4溶液再与NaOH溶液反应制备Fe(OH)2,即H2SO4+Fe=FeSO4+H2↑,FeSO4+2NaOH=Na2SO4+Fe(OH)2↓。传统的演示实验中,学生观察到的往往是灰绿色沉淀,误认为Fe(OH)2是灰绿色。产生这种现象的主要原因:制备FeSO4溶液时放置时间过长,部分Fe2+被氧化成Fe3+,与NaOH溶液反应后生成Fe(OH)3;制备Fe(OH)2时,没有注意排除装置内的空气和溶液中的氧气,导致实验过程中Fe(OH)2被氧化成Fe(OH)3。一般的实验改进侧重于利用H2排出装置内的空气,但是从原理分析,H2并不适合利用向上排空气法排出装置内的空气。有些实验在试剂中加入Na2SO3溶液,利用其容易被氧气氧化的特点,除去溶液中的氧气,但是此知识已经超出了学生的认知范围。基于此,笔者结合相关文献和实践,设计了以下实验方案。
2 实验用品与实验设计
2.1 实验用品
实验器材主要有:小试管1个、带支管口的大试管2个、中间挖有小孔的塑料小试管1个、25 mL注射器4支、烧杯1个、导管1个、止水夹1个、橡胶塞和橡皮管若干。
实验药品主要有:铁粉、煮沸过的稀H2SO4溶液、煮沸过的NaOH溶液(浓度为5 mol/L)、Na2CO3溶液、紫色石蕊试液。
2.2 实验设计
本改进方案中实验装置分两部分,分别是FeSO4溶液制备装置(图1)和Fe(OH)2制备装置(图2)。如图1所示,过量的Fe粉和稀H2SO4反应后,溶液是浑浊的,因此需要过滤后得到清澈的FeSO4溶液,为了避免因FeSO4溶液放置时间过长而被氧化,笔者采用抽滤的方法,过滤后用注射器抽取,并将针尖插入到橡胶塞中隔绝空气进行保存。如图2所示,组装好实验仪器后,稀H2SO4先与Na2CO3溶液反应,产生的CO2将装置内的空气排出,为FeSO4溶液和NaOH溶液的反应提供了无氧环境,查阅文献得知Fe2+在碱性条件下更容易被氧化,因此笔者采用NaOH溶液滴加FeSO4溶液的方法,反应后便可以得到白色絮状沉淀Fe(OH)2。如图3所示,之所以选择CO2排空气法是因为CO2的密度比空气大,稀H2SO4与Na2CO3溶液反应,产生的CO2从小试管的小孔中溢出,CO2会先沉到大试管底部将空气排出试管。如果使用H2排空气法存在两点不足:
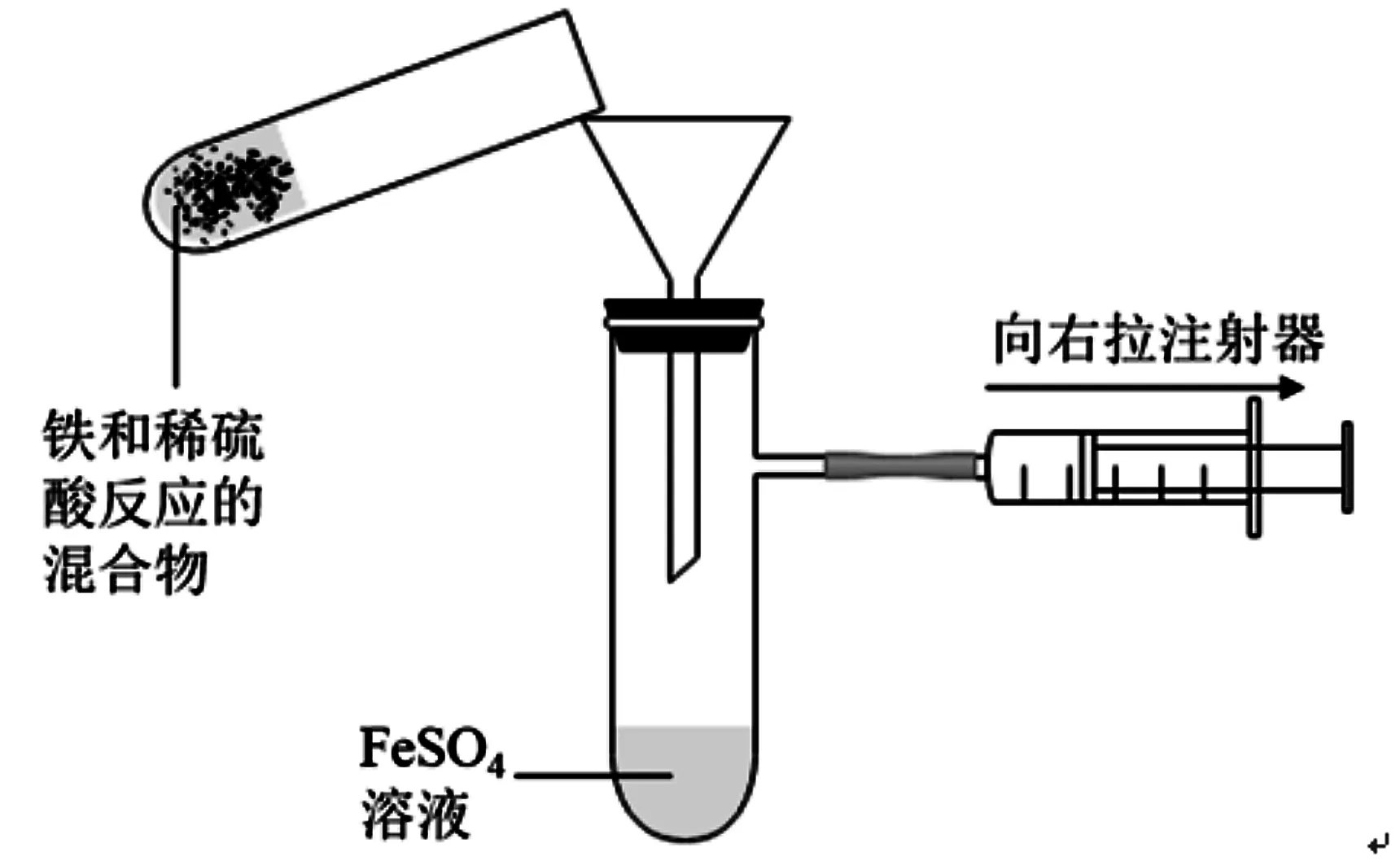
图1 抽滤法获取FeSO4溶液
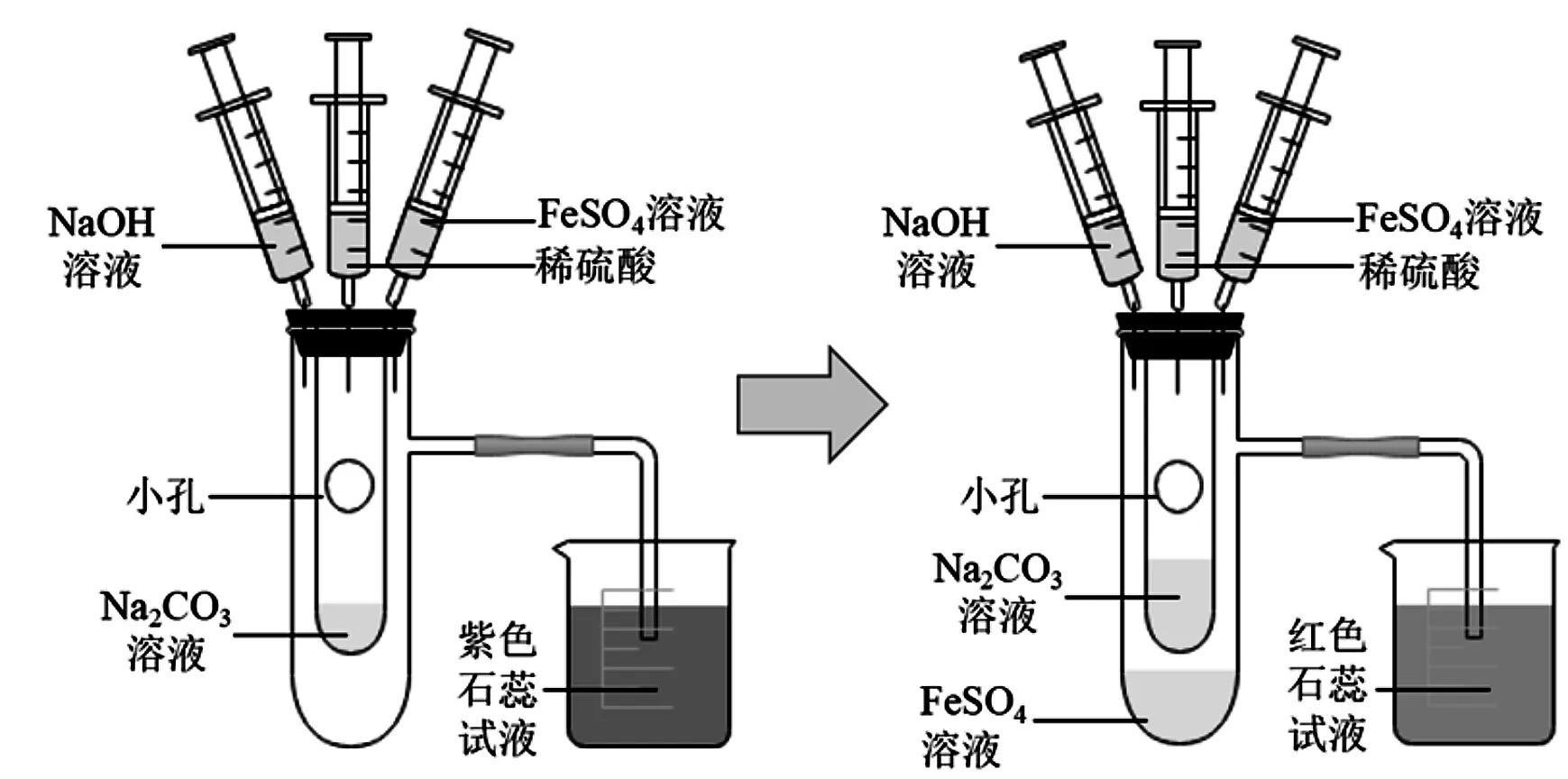
图2 制备氢氧化亚铁的装置图

图3 CO2和H2排空气法原理示意图
①稀H2SO4和Fe粉反应速度适中,产生H2速率不足以短时间内将空气排净;②H2的密度相对于空气更小,产生的H2会直接通过支管口排出装置内,无法将装置内的空气排净。综上所述,笔者选用CO2排空气法创设无氧环境。
3 操作步骤
(1)准备适量药品和实验器材,按照图1和图2连接实验装置并进行装置气密性的检测。
(2)如图1所示,足量的铁粉和稀H2SO4反应后,当气泡不再产生时,按照图示装置进行抽滤,得到清澈的FeSO4溶液,并用注射器抽取后备用。
(3)如图2所示,先将稀硫酸溶液注射到Na2CO3溶液中,产生气体CO2,当紫色石蕊试液变红时,证明装置内的空气已经排净,再向大试管中注射FeSO4溶液,最后注射NaOH溶液,产生白色絮状沉淀。
4 注意事项
(1)小试管中小孔尽量设置在靠上的位置,但是要低于大试管支管口的位置,注射稀硫酸时,速率尽可能缓慢,防止稀硫酸和Na2CO3溶液反应过于猛烈,反应物沿着小孔冲出小试管。
(2)注射器的针头要小心放置,防止扎伤学生,造成安全事故。
5 总结
许多实验为了防止氧气的氧化设置了排空气的实验装置或步骤,从原理分析利用CO2排空气的方法要优于利用H2排空气的方法,此实验装置分为两个系统,排气系统和反应系统,可以制备较为纯净的物质。

