右美托咪定对行三叉神经微血管减压患者血清炎症因子及凝血功能的影响
王荣国 丁文平 刘 倩 满园园
1.江苏省徐州市中心医院麻醉科,江苏徐州 221009;2.江苏省徐州市中心医院呼吸科,江苏徐州 221009
显微血管减压术(microvascular decompression,MVD) 是治疗原发性三叉神经痛 (primary trigeminal neuralgia,PTN)的有效方法,即刻及长期疼痛缓解率较好[1]。PTN 作为神经病理性疼痛的一种,长期继续疼痛状态会导致患者外周血清炎症因子的过度表达[2-3]。而围手术期的应激反应也会引起患者机体炎症反应,并且在体内凝血与炎症也存在广泛关联[4]。 大量炎症因子的过度表达会对机体凝血功能产生一定影响,血液呈高凝状态,进而增加了术后深静脉血栓等并发症的发生风险,影响患者预后。 右美托咪定(Dexmedetomidine,DEX)是一种选择性肾上腺素能激动剂,对呼吸功能影响较小,具有抗焦虑、抗交感神经和镇痛镇静特性[5]。目前有研究表明DEX 对于神经病理性疼痛或手术应激所引起的机体炎症反应存有抑制作用,从而达到器官保护的作用[6-7]。 本研究选取60 例行三叉神经微血管减压术的患者为研究对象, 探究DEX 对患者围手术期血清炎症因子及凝血功能的影响。
1 资料与方法
1.1 一般资料
选取2017 年1 月至2020 年10 月于徐州市中心医院收治的60 例行三叉神经微血管减压患者为研究对象,采用随机数字表法分为DEX 组(30 例)和对照组(30 例)。 纳入标准:①择期行三叉神经微血管减压的患者;②ASA 分级Ⅰ~Ⅱ级;③年龄 40~65 岁。 排除标准:①术前血常规、凝血功能异常者;②近期服用抗凝、激素类或阿片类药物者;③放、化疗后的患者;④合并高血压或精神异常者; ⑤术中需要输血者;⑥目前应用肾上腺素能受体激动剂者; ⑦以往有药物过敏史者;⑧术前有心动过缓、房室传导阻滞、不稳定性心绞痛、急性心肌梗死、严重心瓣膜病及心衰者。 两组患者的性别、年龄及体重指数(body mass in dex,BMI)等一般资料比较,差异无统计学意义(P>0.05)(表1)。本研究得到徐州市中心医院医学伦理委员为批准,所有患者均同意参与本研究并签署知情同意书。
表1 两组患者的一般资料()
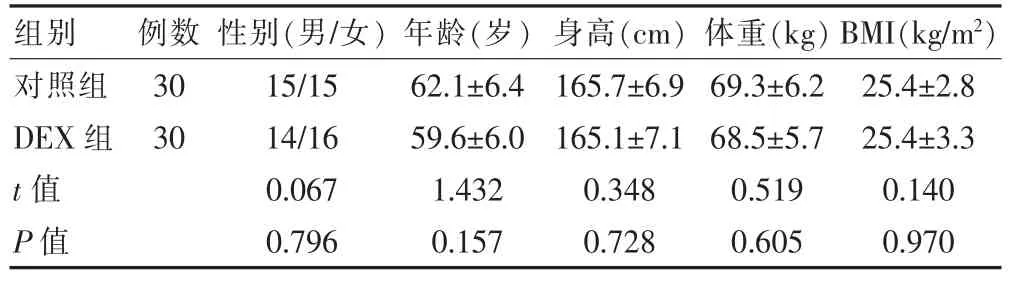
表1 两组患者的一般资料()
组别 例数 性别(男/女) 年龄(岁) 身高(cm) 体重(kg) BMI(kg/m2)对照组DEX 组t 值P 值30 30 15/15 14/16 0.067 0.796 62.1±6.4 59.6±6.0 1.432 0.157 165.7±6.9 165.1±7.1 0.348 0.728 69.3±6.2 68.5±5.7 0.519 0.605 25.4±2.8 25.4±3.3 0.140 0.970
1.2 方法
1.2.1 麻醉方法 两组患者均采用相同方案行静脉麻醉,麻醉诱导采用静脉注射咪唑安定(江苏恩华药业,产品批号:MZ201703)0.05~0.1 μg/kg,芬太尼(宜昌人福药业,产品批号:01D03011)5 μg/kg,苯磺顺阿曲库铵(江苏新晨药业,产品批号200629AK)0.2 mg/kg,丙泊酚(江苏恩华,产品批号:16FD7326)1 mg/kg;持续泵入丙泊酚 6~8 μg/(kg·h),瑞芬太尼(宜昌人福药业,产品批号:20170120)0.1~0.2 μg/(kg·min), 每 45 分钟给予苯磺顺阿曲库铵5 mg。术中维持脉搏血氧饱和度(pulse oxygen saturation,SPO2)在 98%以上,呼气末二氧化碳分压(partial pressure of carbon dioxide in end expirationgas,PetCO2)在 35~45mmHg(1mmHg=0.133kPa),吸气氧浓度(fraction of inspiration O2,FiO2)0.8~1.0,根据血流动力学指标调整药物输注速度。术毕入麻醉复苏室(postanesthesia care unit,PACU)复苏。术后以舒芬太尼(宜昌人福药业,产品批号:01A07021)2 μg/kg+托烷司琼(西南药业,产品批号201706)10 mg 静脉自控镇痛。
1.2.2 试验干预 患者麻醉诱导开始前10 min 开始给予DEX 或生理盐水干预,其中DEX 组以DEX(江苏恒瑞医药股份有限公司,产品批号190903BP)1 μg/kg的负荷剂量 10 min 内静脉输注,后以 0.5 μg/(kg·h)的剂量维持至患者苏醒拔管。对照组静脉泵入等容量的生理盐水。 盲法控制:所有药物配制由另一名工作人员根据试验方案完成,患者、麻醉医师以及数据记录者对于所用药物及剂量不知情。
1.3 观察指标
入室后常规监测血压(arterial blood pressure,ABP)、心率(heart rate,HR)、心电图(electrocardiogram,ECG)、SPO2、平均动脉压(mean arterial pressure,MAP)、PetCO2。并行血气分析以及中心静脉压监测。 分别记录三组患者在围手术期各个时间点:DEX 预先给药前(T0)、插管后 10 min(T1)、手术结束前 10 min(T2)以及术后 1 h(T3)的 HR 和 MAP,并记录麻醉时间、手术时间。
标本采集及测定: 两组患者分别于麻醉诱导T0、T1、T2以及T3时,各抽取外周静脉血3 ml 两份并编号,其中一份 4°C, 离心 (离心半径 8 cm,4000 r/min)15 min 后取上清,置于-80°C 超低温冰箱中保存待测,另一份做常规凝血功能检测。 采用ELISA 法测定人血清中肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)、白介素-6(interleukin-6,IL-6)的浓度水平。试剂盒购自上海恒远生物科技有限公司,上述操作均按照试剂盒说明书进行。 凝血指标检测方法:检查仪器为CA6000 凝血分析仪,采用凝固法测定凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT),分别记录各时间点PT、APTT 结果。
1.4 统计学方法
采用SPSS 24.0 统计学软件进行数据分析, 计量资料用均数±标准差()表示,两组间比较采用t检验,重复测量资料采用重复测量方差分析;计数资料用率表示,组间比较采用χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组麻醉时间及手术时间的比较
两组患者的麻醉时间、手术时间比较,差异无统计学意义(P>0.05)(表 2)。
表2 两组麻醉时间及手术时间的比较(min,)

表2 两组麻醉时间及手术时间的比较(min,)
组别 例数 麻醉时间 手术时间对照组DEX 组t 值P 值30 30 300.2±16.5 299.6±18.9 0.138 0.891 256.8±16.8 261.4±17.7 1.033 0.309
2.2 两组患者不同时间点MAP 及HR 的比较
整体分析发现:两组时间、组间、交互作用比较,差异有统计学意义(P<0.05)。 进一步两两比较,组内比较:两组 T1、T2、T3时间点的 MAP 高于 T0,差异有统计学意义(P<0.05);对照组 T1、T2、T3时间点的 HR 高于于 T0,差异有统计学意义(P<0.05);DEX 组 T1、T2、T3时间点的 HR 低于 T0,差异有统计学意义(P<0.05)。组间比较:DEX 组 T1、T2、T3时间点 MAP、HR 水平低于对照组,差异有统计学意义(P<0.05)(表 3)。
表3 两组患者不同时间点MAP 及HR 的比较()
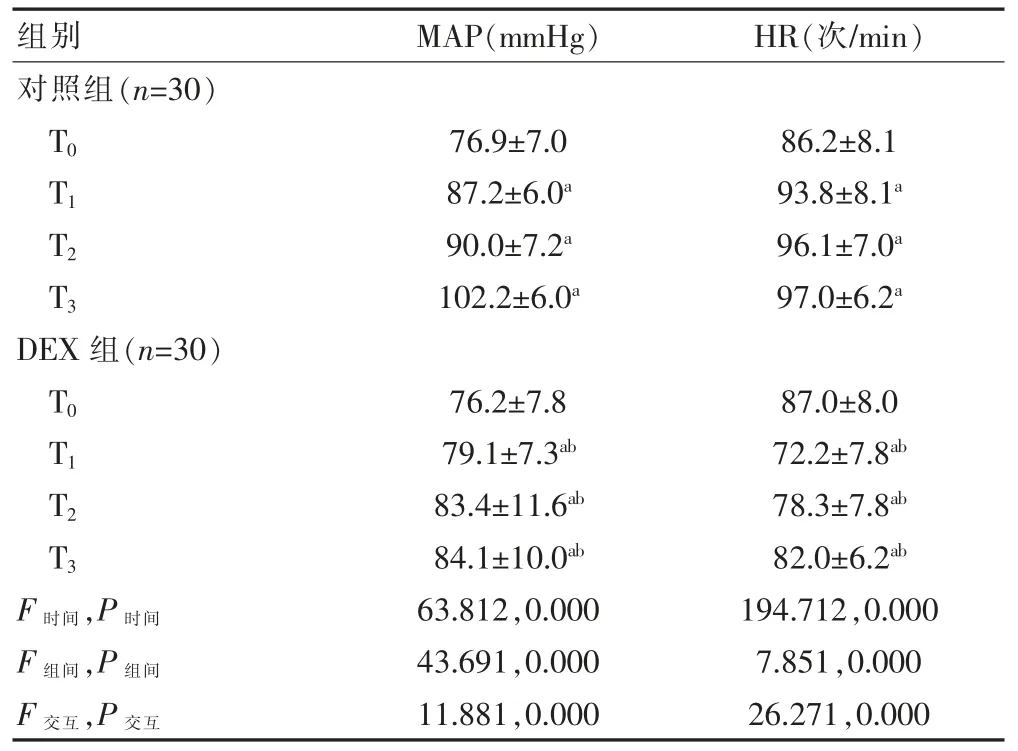
表3 两组患者不同时间点MAP 及HR 的比较()
与本组 T0 比较,aP<0.05;与对照组同期比较,bP<0.05;1 mmHg=0.133 kPa
组别 MAP(mmHg) HR(次/min)对照组(n=30)T0T1T2T3 76.9±7.0 87.2±6.0a 90.0±7.2a 102.2±6.0a 86.2±8.1 93.8±8.1a 96.1±7.0a 97.0±6.2a DEX 组(n=30)T0T1T2T3 F 时间,P 时间F 组间,P 组间F 交互,P 交互76.2±7.8 79.1±7.3ab 83.4±11.6ab 84.1±10.0ab 63.812,0.000 43.691,0.000 11.881,0.000 87.0±8.0 72.2±7.8ab 78.3±7.8ab 82.0±6.2ab 194.712,0.000 7.851,0.000 26.271,0.000
2.3 两组患者不同时间点炎症因子水平与凝血功能的比较
炎症因子表达水平整体分析发现: 两组时间、组间、交互作用比较,差异有统计学意义(P<0.05)。 进一步两两比较,组内比较:两组 T1、T2、T3时间点 TNF-α、IL-6 水平高于 T0时,差异有统计学意义(P<0.05)。 两组 T0时 TNF-α、IL-6 水平比较, 差异无统计学意义(P>0.05);DEX 组 T1、T2、T3时 TNF-α、IL-6 水平低于对照组,差异有统计学意义(P<0.05)。
凝血功能整体分析发现:两组时间、组间、交互作用比较,差异无统计学意义(P>0.05)。 两组 T0、T1、T2、T3时 PT、APTT 水平比较,差异无统计学意义(P>0.05)(表 4)。
表4 两组患者不同时间点炎症因子水平与凝血功能的比较()
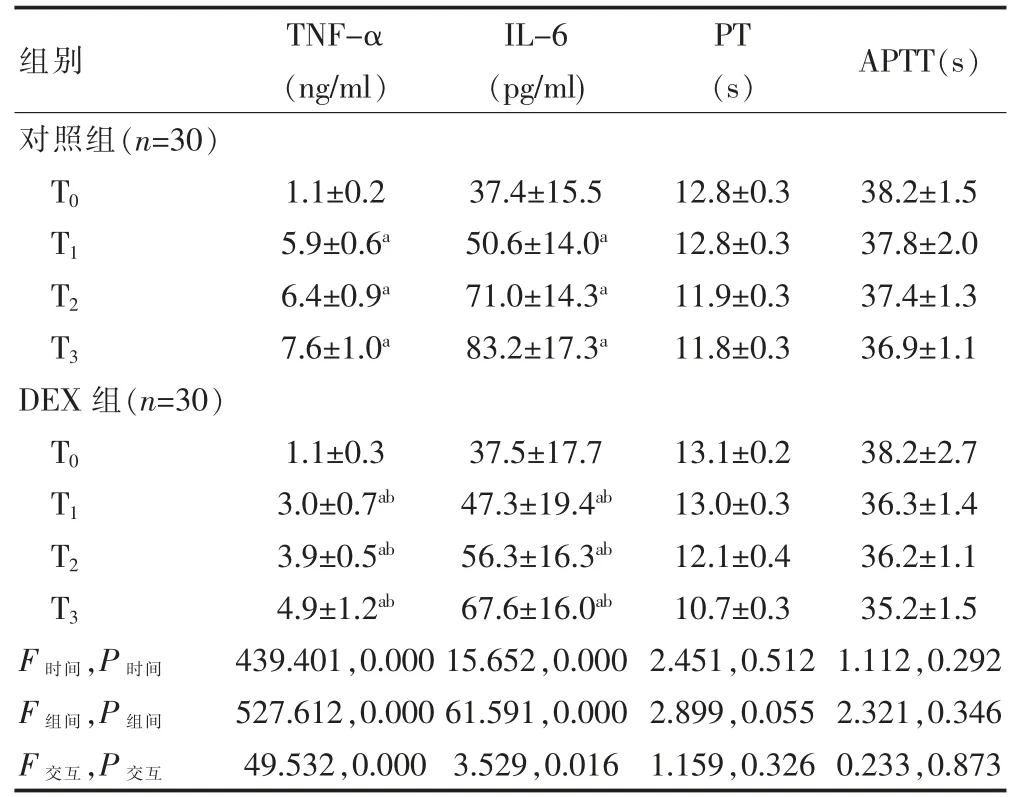
表4 两组患者不同时间点炎症因子水平与凝血功能的比较()
与本组T0 比较,aP<0.05;与对照组同期比较,bP<0.05
组别 TNF-α(ng/ml)IL-6(pg/ml)PT(s) APTT(s)对照组(n=30)T0T1T2T3 1.1±0.2 5.9±0.6a 6.4±0.9a 7.6±1.0a 37.4±15.5 50.6±14.0a 71.0±14.3a 83.2±17.3a 12.8±0.3 12.8±0.3 11.9±0.3 11.8±0.3 38.2±1.5 37.8±2.0 37.4±1.3 36.9±1.1 DEX 组(n=30)T0T1T2T3 F 时间,P 时间F 组间,P 组间F 交互,P 交互1.1±0.3 3.0±0.7ab 3.9±0.5ab 4.9±1.2ab 439.401,0.000 527.612,0.000 49.532,0.000 37.5±17.7 47.3±19.4ab 56.3±16.3ab 67.6±16.0ab 15.652,0.000 61.591,0.000 3.529,0.016 13.1±0.2 13.0±0.3 12.1±0.4 10.7±0.3 2.451,0.512 2.899,0.055 1.159,0.326 38.2±2.7 36.3±1.4 36.2±1.1 35.2±1.5 1.112,0.292 2.321,0.346 0.233,0.873
3 讨论
PTN 是中老年人常见的脑神经异常兴奋的疾病,可归因于第五脑神经根血管环的压迫,其病理学表现为脑神经根轴突确实或脱髓鞘,并由MVD 手术证实[8]。MVD 手术已经成为近几年治疗PTN 的重要手段,手术过程中应激反应的抑制对手术治疗效果有着重要的影响而选择合适的麻醉方法对提高MVD 手术成功率减少术后并发症尤为重要。
DEX 作为一种新型的高选择性α2-肾上腺素能受体拮抗剂,具有良好的镇静、镇痛以及交感神经抑制作用。 DEX 可减少心脏和周围脉管系统的交感神经或增强副交感神经的张力以改变血流动力学,对于手术患者在改善血流动力学稳定性, 降低应激反应,降低炎症水平,具有重要的临床意义[9-10]。 本研究结果显示, 以 1 μg/kg 的 DEX 负荷剂量,0.5 μg/(kg·h)的维持剂量给药, 患者整个手术过程中的HR 和MAP水平都低于术前以及对照组(P<0.05),提示其有利于血流动力学稳定, 考虑归因于DEX 可以抑制交感神经,减少PTN 患者术中的高血压反应,并通过激活运动神经元中的α2受体来调节升高的血压。
有研究表明三叉神经痛可诱导机体多种炎症因子(TNF-α、IL-6、IL-8、IL-1β)的升高,而 IL-6 的浓度与PTN 严重程度呈正相关并可能在这些脑神经产生异位冲动的信号通路中起重要作用[11]。 手术麻醉及疼痛等应激反应同样能够影响机体内环境稳定,继发程度不一的炎症反应, 严重的炎症可以促发凝血反应,导致血栓栓塞时间的发生[12],反之,凝血反应也能够加重机体的炎症反应[13]。 有研究显示,手术患者应用DEX 可以有效的降低机体的应激反应, 减少由此导致的炎症反应[14-15];而且DEX 对于改善围手术期机体凝血功能中也有一定的作用, 其认为DEX 对术后凝血激活的抑制作用归因于DEX 的抗交感活性的特性[16-17]。 DEX 也可以直接刺激血小板表面的α2-肾上腺素受体并激活血小板[18];并且DEX 也抑制交感神经平并减少儿茶酚胺的释放,从而间接抑制血小板功能[19]。 因此此前本研究认为DEX 也有可能通过抑制炎症反应从而改善术中凝血功能。 本项研究显示,DEX 组的TNF-α、IL-6 的表达水平相比较对照组有明显的降低,与前期其他研究结果相一致[20];而在对凝血功能的检测中DEX 组的PT、APTT 与对照组比较,差异无统计学意义(P>0.05),提示在三叉神经显微血管减压手术中应用DEX 虽然其对手术患者的炎症反应有抑制作用,但其通过抑制炎症反应改善术中及术后凝血功能的假想缺乏证据支持。
综上所述, 在显微血管减压手术中应用DEX 可有效的保持三叉神经痛患者的血流动力学的稳定,而且降低机体的应激反应有利于机体内环境的稳定。 尽管DEX 对于围手术期患者的炎症反应具有明显的抑制作用, 但是其对患者术中及术后的凝血功能的影响与其抗炎作用并无表现出有明显的关联,考虑本研究中DEX 应用时间短等诸多因素,DEX 对三叉神经痛手术患者围手术期的凝血功能的影响有待进一步研究。

