消瘀泄浊饮对单侧输尿管梗阻大鼠肾小管上皮-间质转分化及PAR-3表达的影响
夏璁 叶晴晴 杨利利 何灵芝
1.浙江中医药大学附属第一医院 杭州 310006 2.杭州师范大学附属医院
慢性肾脏病(chronic kidney disease,CKD)是指因各种肾脏内或者肾脏外因素导致的肾脏损伤,并且持续3个月以上。随着我国社会和经济的发展,人群中高血压病、糖尿病、动脉硬化等疾病的发病率不断升高,CKD的发生率也在逐年增长[1]。横断面研究显示,我国成年人CKD的患病率高达10.8%[2]。目前CKD已经成为影响人类健康、加重社会经济负担的重大疾病,防治任务十分艰巨[3]。
肾小管间质纤维化是各种CKD病程进展的必然结果[4]。目前认为,肾小管上皮细胞发生上皮-间质转分化(epithelial-mesenchymal transition,EMT)是肾小管间质纤维化发展过程中的一个重要步骤和关键机制[5]。前期研究发现,在单侧输尿管梗阻(unilateral ureteral obstruction,UUO)动物模型中,EMT的重要标志上皮细胞标志物E-钙黏蛋白(E-cadherin)表达减弱,而间充质细胞标志物α-平滑肌肌动蛋白(αsmooth muscle actin,α-SMA)表达增强[6]。 同时,细胞连接的破坏和细胞极性的丧失也是EMT的重要特征[7]。 极性蛋白-3(partitioning defective-3,PAR-3)是一种细胞极性蛋白,对维持上皮细胞极性起到关键作用[8]。因此,通过调节上皮细胞极性蛋白表达,阻止或逆转EMT可能减轻肾脏纤维化,延缓CKD病程进展,但现阶段临床上尚缺乏相应的有效药物。
消瘀泄浊饮是国家级名中医李学铭教授通过长期临床实践而创立的经验方,在临床上广泛用于慢性肾衰竭的治疗,具有抗炎、调节免疫、改善肾功能的作用[9-10],但其对肾功能的保护作用及机制仍需进一步探讨。本研究拟通过观察消瘀泄浊饮对UUO大鼠PAR-3以及E-cadherin、α-SMA表达的影响,探讨消瘀泄浊饮对肾间质纤维化防治的作用及机制。
1 材料和方法
1.1 材料
1.1.1 实验动物 无特定病原体(specific pathogen free,SPF)级雄性SD大鼠40只,10周龄,平均体质量(300±20)g,均购于上海西普尔-必凯实验动物有限公司[实验动物生产许可证号:SCXK(沪)2018-0006],饲养于浙江中医药大学实验动物中心[实验动物使用许可证号:SYXK(浙)2018-0012],大鼠自由饮水和进食,12h交替照明。本研究方案获浙江中医药大学实验动物管理与伦理委员会批准(伦理审批号:IACUC-20190715-03)。
1.1.2 主要药品和试剂 消瘀泄浊饮由生黄芪30 g、制大黄10 g、川牛膝10 g、地龙10 g、桃仁10 g、车前草20 g、猫爪草10 g组成,所有中药饮片由浙江中医药大学附属第一医院中药房提供,各味中药煎煮浓缩成浓度为1.04 g·mL-1的消瘀泄浊饮药液,灭菌处理后,4℃保存备用;盐酸贝那普利片由北京诺华制药有限公司生产(商品名:洛丁新,规格:10 mg/片,批号:国药准字H20030514);E-cadherin抗体、抗α-SMA抗体、PAR-3抗体均购于英国Abcam公司(批号:ab1416、ab7817、ab64646); 异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的山羊抗兔IgG、辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG、HRP标记的山羊抗小鼠IgG、抗β-actin抗体均购于兰杰柯科技有限公司 (批号:BL033A、BL003A、BL001A、BL005B)。
1.1.3 主要仪器 7020型全自动生化分析仪为日本日立公司产品;Nikon Eclipse Ti-SR倒置荧光显微镜为日本尼康公司产品;JB-P5包埋机为武汉俊杰电子有限公司产品;RM2016病理切片机为上海徕卡仪器有限公司产品;KD-P组织摊片机购于浙江省金华市科迪仪器设备有限公司;GT1001免疫组化笔购于基因科技(上海)股份有限公司;G:BOX F3凝胶成像系统购于美国Syngene公司。
1.2 方法
1.2.1 造模与分组 大鼠适应性喂养1周后,随机分为假手术组、模型(UUO)组、中药(消瘀泄浊饮)组、西药(贝那普利)组,每组均10只。以3%戊巴比妥钠45 mg·kg-1腹腔注射麻醉大鼠,模型组和中药组、西药组行左输尿管结扎术,方法按照参考文献[11];假手术组仅行左侧输尿管分离,未行结扎。
1.2.2 给药方法 从术后1 d起,中药组和西药组每天分别给予消瘀泄浊饮药液和盐酸贝那普利溶液灌胃,给药剂量根据人与大鼠体表面积的转换系数6.25换算而得,消瘀泄浊饮用药量为10.4 g/(kg·d),盐酸贝那普利用药量为1 mg/(kg·d),灌胃剂量均为10 mL/kg;假手术组和模型组以等量0.9%氯化钠注射液灌胃。
1.2.3 标本收集 连续灌胃4周后,麻醉大鼠,腹主动脉取血,离心后-20℃保存待检。处死所有大鼠,剖取左侧肾脏,剥离包膜,部分肾组织以10%中性甲醛溶液固定,其余部分肾组织快速液氮冷冻,-80℃保存待检。
1.2.4 生化指标检测 采用全自动生化分析仪检测血清白蛋白(albumin, ALB)、血尿素氮(blood urea nitrogen,BUN)、血肌酐(serum creatinine,Scr)、尿酸(uric acid,UA)水平。
1.2.5 组织病理学检查 中性甲醛固定的肾组织经脱水、透明、包埋、切片后,行苏木精-伊红(hematoxylin-eosin,HE)染色及Masson染色,光镜下观察肾小管间质的组织病理改变。HE染色后,在200倍光镜下每张切片随机选取5个不重复视野,计算肾小管间质损伤指数。肾小管间质损伤评分标准:0分:正常肾小管,间质无炎性细胞及纤维组织增生;1分:肾小管上皮细胞萎缩,间质少量炎性细胞浸润,纤维组织增生,病变面积<25%;2分:间质炎性细胞浸润与纤维化面积25%~50%;3分:病变面积>50%。计算每张切片的评分并得出平均值,作为肾小管间质损伤指数评分。Masson染色后,在200倍光镜下每张切片随机选取5个不重复的肾小管间质视野,注意避开肾小球和大血管,以肾间质内蓝染区为目标,采用Image J软件评估胶原纤维沉积程度,肾间质纤维化相对面积(%)=胶原染色面积/总面积×100%。
1.2.6 免疫荧光及免疫组化检测
1.2.6.1 免疫荧光检测 经过烤片、脱蜡、热修复后,以磷酸盐缓冲液(phosphate buffered saline, PBS)洗涤,5%牛血清白蛋白溶液(bovine serum albumin,BSA)封闭后滴加PAR-3一抗(稀释比例:1∶100),4 ℃孵育过夜,PBS洗涤后滴加FITC标记的山羊抗兔二抗,室温下避光孵育2 h,4,6-二脒基-2-苯基吲哚(4,6-diamidino-2-phenylindole,DAPI)染色后避光室温孵育10 min,PBS洗涤,抗荧光淬灭剂封片,倒置荧光显微镜下观察,并采集图像。
1.2.6.2 免疫组化检测 烤片、脱蜡,滴加内源性过氧化物酶阻断剂20 min后热修复,5% BSA封闭20 min,分别滴加抗E-cadherin抗体(稀释比例:1∶10) 和抗α-SMA抗体(稀释比例:1∶10),孵育过夜后滴加HRP标记的山羊抗小鼠二抗,37℃孵育40 min,3,3-二氨基苯联胺(diaminobenzidine,DAB)显色,苏木素染核,脱水,透明,以Image J软件定量分析阳性面积所占比例。
1.2.7 免疫印迹法检测 使用裂解液裂解肾组织,提取总蛋白,以二喹啉甲酸(bicinchoninicacid,BCA)法测定蛋白质浓度,十二烷基硫酸钠-聚丙烯酰胺凝胶电 泳 (sodium dodecylsulfate-polyacrylamide gel electrophoresis,SDS-PAGE)后,转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上。 5%脱脂牛奶室温封闭2 h后加入PAR-3一抗(稀释比例:1∶1 000),4℃孵育过夜。洗膜后加入HRP标记的二抗,孵育1h后洗涤3次,用化学发光剂显影曝光条带。以β-actin作为内参,以Image J软件分析蛋白条带的灰度值。
1.3 统计学分析 使用SPSS 23.0统计软件进行统计学分析,符合正态分布的计量资料以±s表示,样本均数间的比较采用单因素方差分析,两两比较采用Bonferroni法。采用GraphPad Prism 7.0软件进行绘图。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠一般情况比较 假手术组大鼠实验期间一般情况无明显异常;与假手术组比较,模型组大鼠活动量明显减少,饮食减少,精神萎靡,毛发干枯、脱落,缺少光泽;中药组及西药组大鼠一般情况较模型组有所改善。
2.2 各组大鼠生化指标比较 各组间总体比较,BUN、Scr、UA水平差异有统计学意义(均P<0.001);与假手术组比较,模型组、西药组、中药组BUN、Scr、UA水平均增高,差异有统计学意义(均P<0.05);与模型组比较,中药组BUN、Scr、UA水平均降低,差异有统计学意义(均P<0.05);与西药组比较,中药组Scr、UA水平均降低,差异有统计学意义(均P<0.05)。各组间ALB水平比较差异无统计学意义(均P>0.05)。见表1。
表1 各组大鼠生化指标比较(±s)Tab.1 Comparison of biochemical indexes in each group(±s)

表1 各组大鼠生化指标比较(±s)Tab.1 Comparison of biochemical indexes in each group(±s)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与西药组比较,△P<0.05。Note:Compared with sham operation group, *P<0.05;compared with model group, #P<0.05;compared with western medicine group, △P<0.05.
组别 ALB(g·L-1) BUN(mmol·L-1) Scr(μmol·L-1) UA(μmol·L-1)假手术组 23.70±1.37 4.33±0.47 32.68±1.06 76.19±9.14模型组 23.06±2.21 6.38±0.39* 45.38±4.40* 199.22±33.84*西药组 23.64±1.39 6.14±0.42* 43.18±4.99* 173.07±22.05*中药组 23.43±2.90 5.72±0.81*# 38.26±2.69*#△ 111.46±23.56*#△F值 0.191 27.773 24.171 55.732 P 值 >0.05 <0.001 <0.001 <0.001
2.3 各组大鼠肾组织病理学变化比较 HE染色显示,假手术组肾小管间质形态正常;模型组可见肾小管上皮细胞空泡变性、萎缩、脱落,肾间质扩张,肾小管管腔增大,炎性细胞浸润及纤维化;西药组和中药组肾间质病变、肾小管损伤均有不同程度的改善,炎性细胞浸润相对减少。模型组肾小管间质损伤指数高于假手术组,而西药组、中药组肾小管间质损伤指数低于模型组,差异均有统计学意义(P<0.05)。见图1、2。Masson染色可见模型组大鼠肾小管间质内胶原纤维化形成;模型组肾间质纤维化相对面积高于假手术组,而西药组、中药组大鼠肾间质纤维化相对面积均低于模型组(P<0.05)。 见图3、4。

图1 大鼠肾组织病理改变(HE染色,200×)Fig.1 Morphological changes of renal tissues in each group (HE staining, 200×)

图2 大鼠肾组织肾小管间质损伤指数Fig.2 Renal tubular interstitial injury index of renal tissues in each group
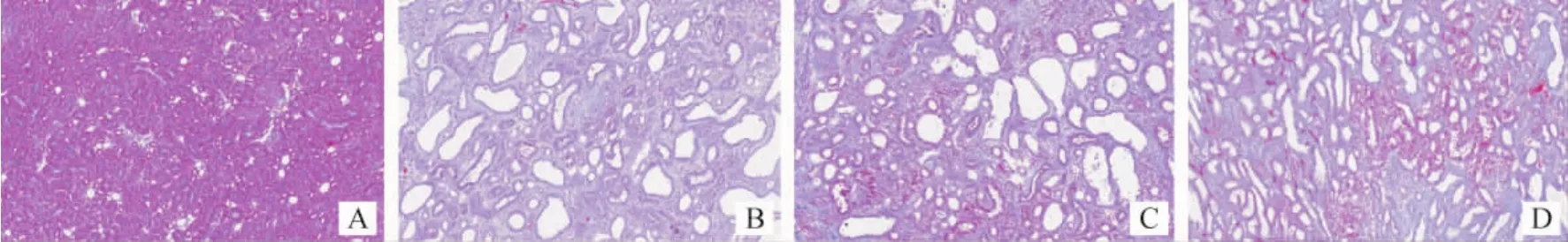
图3 大鼠肾组织病理改变(Masson染色,200×)Fig.3 Morphological changes of renal tissues in each group(Masson staining, 200×)
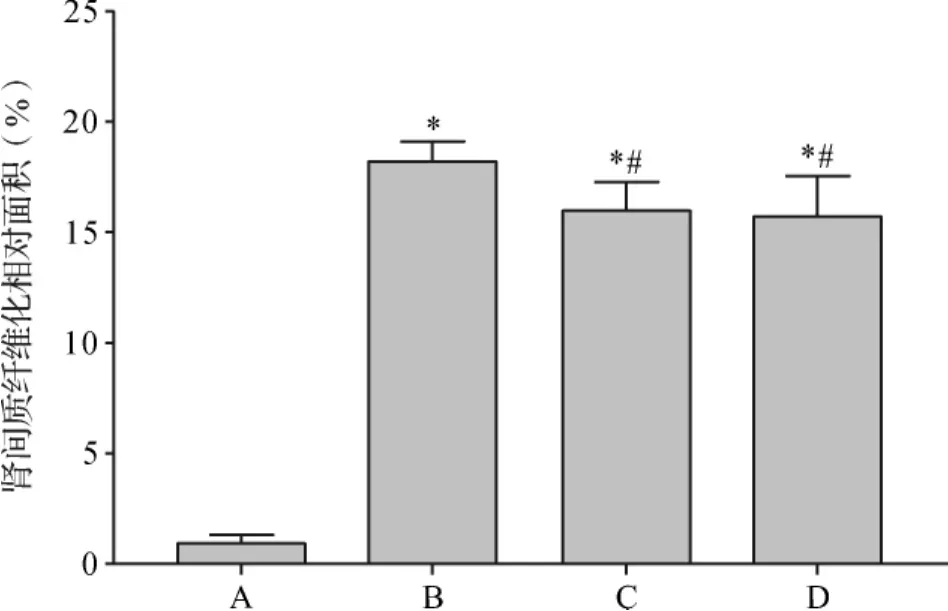
图4 大鼠肾组织肾间质纤维化相对面积Fig.4 Collagen positive area of renal tissues in each group
2.4 各组大鼠肾组织PAR-3表达比较 免疫荧光结果显示,肾组织PAR-3主要表达于肾小管上皮细胞及肾间质,与假手术组比较,模型组及西药组、中药组大鼠肾组织PAR-3表达下降,而中药组大鼠肾组织PAR-3表达较模型组有所升高。见图5。免疫印迹法结果显示,与假手术组比较,其余各组肾组织PAR-3表达降低(P<0.05);与模型组比较,中药组肾组织PAR-3表达升高(P<0.05)。 见图6。
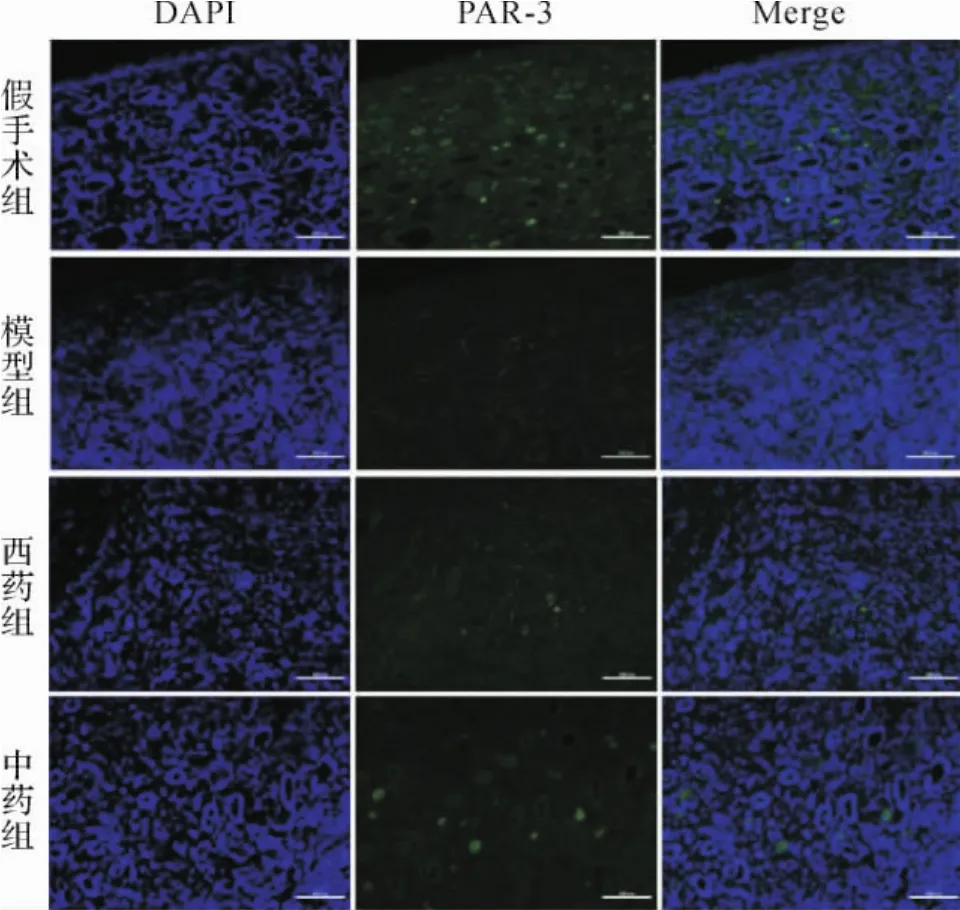
图5 各组大鼠肾脏组织PAR-3表达(200×)Fig.5 Comparison of immunof luorescent PAR-3 expression in renal tissues in each group(200×)
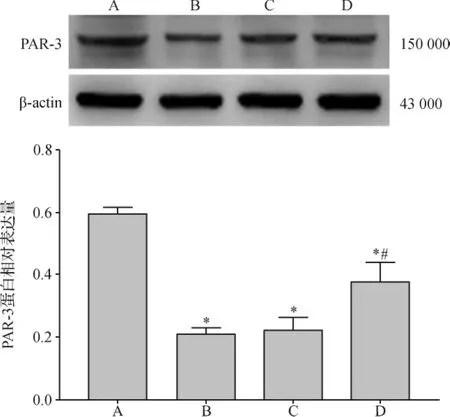
图6 各组大鼠肾组织PAR-3蛋白表达的比较Fig.6 Comparison of PAR-3 protein expression in renal tissues in each group
2.5 各组大鼠肾组织α-SMA、E-cadherin蛋白表达比较 免疫组化结果显示,与假手术组比较,模型组大鼠肾组织α-SMA表达增加,E-cadherin表达减少(均P<0.05);与模型组比较,西药组、中药组大鼠肾组织α-SMA表达减少,E-cadherin表达增加 (均P<0.05);与西药组比较,中药组E-cadherin表达增高(P<0.05);α-SMA蛋白表达差异无统计学意义(P>0.05)。见图7。

图7 各组大鼠肾组织α-SMA、E-cadherin表达的比较(200×)Fig.7 Comparison of immunohistochemical α-SMA, E-cadherin expression in renal tissues in each group(200×)
3 讨论
肾小管间质纤维化是导致各种CKD进展至终末期的共同机制[12]。肾小管间质纤维化的最主要特点是细胞外基质(extracellular matrix,ECM)的过度沉积[4,13]。 ECM主要由活化的肌成纤维细胞产生[14]。目前认为,上皮-间质的动态平衡是维持肾小管间质微环境稳定的重要影响因素,肌成纤维细胞可来源于上皮细胞的转分化[15-16]。既往研究证实,肾小管上皮细胞可通过EMT或者部分上皮-间质转分化(partial EMT,pEMT)发生表型转化,表达肌成纤维细胞标志物,如α-SMA和Vimentin等,从而介导炎症和肾小管间质纤维化的发生[17-18]。通过抑制肾脏EMT进程,可以改善或者逆转肾小管间质纤维化[17,19]。
细胞连接的破坏和细胞极性的丧失是EMT的始动环节,对EMT起到关键性的作用[7]。上皮细胞极性的建立和维持是通过三种极性复合物(PAR复合物、Crumbs复合物和Scribble复合物)之间的相互作用,以及对细胞骨架和细胞间连接的调节来实现的[20]。紧密连接是上皮细胞之间的一种重要的连接复合体,对维持细胞极性起到重要作用[21]。PAR复合物是紧密连接的重要组成部分,是调节细胞极性的中心环节。作为一种进化高度保守的极性调控复合物,PAR复合物由PAR-3、PAR-6和非典型蛋白激酶C(atypical protein kinase C,aPKC)三种成分组成[22],通过与跨膜蛋白相互作用,固定于细胞膜的紧密连接处[23]。在上皮细胞极性建立过程中,PAR-3基因突变会导致细胞极性异常[24]。研究发现,哺乳动物上皮细胞内PAR-3表达降低可导致紧密连接的破坏[25]。PAR-3基因敲除可导致犬肾(Madin-Darby Canine Kidney,MDCK)细胞间的连接缺失,而野生型PAR-3可有效修复PAR-3敲除细胞中的缺陷[26]。大鼠肾小管上皮细胞实验证实,转化生长因子-β1(transforming growth factor-β1,TGF-β1)能够通过下调PAR-3蛋白表达,促进EMT;而转染PAR-3则可显著抑制TGF-β1诱导的EMT[27]。基于上述研究结果,笔者推测PAR-3在EMT过程中可起到保护性作用。
现代中医理论认为,在CKD的发展过程中,瘀血起了极为重要的作用[28]。消瘀泄浊饮由活血化瘀名方“补阳还五汤”加减化裁而来,在临床上广泛应用于慢性肾衰竭气虚夹瘀证的治疗,具有改善临床症状、延缓肾功能进展的作用[29]。在前期研究中发现,消瘀泄浊饮可抑制肾小管间质纤维化大鼠肾组织TGF-β1、α-SMA的表达,起到抗肾小管间质纤维化的作用[30-31]。
本研究通过建立UUO模型,证实肾小管间质纤维化大鼠存在EMT,肾小管上皮细胞黏附分子E-cadherin表达下降,并表达间充质细胞标志物α-SMA。经过盐酸贝那普利及消瘀泄浊饮治疗后,肾功能指标、肾小管间质纤维化程度均有不同程度改善,与前期研究[30-31]一致。与阳性对照药物盐酸贝那普利比较,消瘀泄浊饮通过上调肾组织E-cadherin表达,下调α-SMA表达,从而逆转EMT的作用相似。为进一步明确消瘀泄浊饮逆转肾小管间质纤维化的具体作用机制,本研究进一步检测了PAR-3在UUO大鼠肾组织内的表达。结果显示,肾间质纤维化大鼠肾组织PAR-3表达降低,消瘀泄浊饮可一定程度上调PAR-3表达。
综上所述,本研究表明消瘀泄浊饮可通过上调肾组织极性蛋白PAR-3表达,逆转EMT进程,从而发挥抗肾纤维化、改善肾功能的作用。

