酸冷胁迫下保加利亚乳杆菌定量PCR内参基因的筛选
孙永胜,许 沙,王宇航,魏新燕,李 晨,4,康红彦,田洪涛,,4*
(1 河北农业大学食品科技学院 河北保定 071001 2 国家北方山区农业工程技术研究中心 河北保定 071001 3 河北新希望天香乳业有限公司 河北保定 071001 4 河北省益生功能性乳制品技术创新中心 河北保定 071001)
实时荧光定量PCR(qRT-PCR)技术具有灵敏度高、特异性强、重复性好、定量准确等优点而被广泛应用于目的基因表达水平的定量分析[1-3]。当向qRT-PCR 体系中加入荧光标记的特定目的基因时,可通过对内参基因的监测,实现对目的基因表达状况实时监控的目的[4]。qRT-PCR 结果的准确性易受cDNA 数量与质量、RNA 质量、反转录效率、引物特异性、qRT-PCR 条件与效率等因素的影响[5]。需引入内参基因进行标准校正,以提高qRT-PCR 结果的准确性[6-7]。目前常用管家基因16S 核糖体RNA 基因(16S rRNA)、鸟苷酸激酶基因(gmk)、甘油醛-3-磷酸脱氢酶基因(GAPDH)作为内参基因[8-9]。管家基因一般在生物体的各组织及各生长阶段表达水平比较稳定[10]。然而,近年来研究发现:这些管家基因不能在所有生理条件下都稳定表达,内参基因的表达会随表达条件的改变而改变[11-12]。目前尚未有任何一种内参基因在各种试验条件下均能稳定表达的现象[13-14]。在qRTPCR 研究中,根据不同试验条件,选择合适的内参基因尤为重要。
随着科学技术水平的提高,与发酵乳制品促进人体健康功能性的揭示以及人们健康意识的增强,发酵乳制品工业迅猛发展,在国民经济中占有越来越重要的地位,成为“朝阳产业”。酸奶是最常见的传统发酵乳制品,为了保持酸奶中乳酸菌的保健功能,酸奶经发酵后含有一定数量的乳酸菌活菌,在冷藏条件下的货架期一般为21 d[15-16]。酸奶发酵剂菌种长期使用可能发生变异或长期使用国外商业直投式发酵剂等不明原因,使冷藏酸奶中的乳酸菌继续利用酸奶中残存的乳糖缓慢发酵、产酸,这种现象称为酸奶的后酸化。现有研究表明:酸奶发酵剂的重要菌种保加利亚乳杆菌是导致酸奶后酸化的主要菌种[17]。目前大多采用诱变或细胞融合育种、高温处理工艺、添加防腐剂等技术措施来控制酸奶的后酸化[18],然而,后酸化基因的调控机制不清,不能从根本上解决后酸化问题。随着分子生物学技术的发展,在通过转录组测序技术研究保加利亚乳杆菌后酸化形成机制与功能基因筛选的基础上,研究保加利亚乳杆菌后酸化功能基因表达量,对于定向选育保加利亚乳杆菌弱后酸化菌株势在必行。而筛选适宜的内参基因是qRT-PCR 研究的关键环节。目前,有关乳酸菌在不同条件下内参基因的筛选与表达稳定性分析已有报道[19],而保加利亚乳杆菌在qRT-PCR 研究中仍选用管家基因作为内参基因[20],对不同内参基因在后酸化中经历的酸冷胁迫的稳定性与适用性研究却尚未见报道。
本文以保加利亚乳杆菌模式菌株ATCC11842为试验菌株,根据前期转录组测序结果,选择5 个候选内参基因(16SrRNA、rpoB、ldh、rodA、recA),利用qRT-PCR 技术,以ATCC11842 菌株正常培养为对照,研究ATCC11842 菌株的候选内参基因在酸胁迫培养和酸冷胁迫培养下的表达水平。采用三款软件geNorm、NormFinder 和Bestkeeper[21],分析候选内参基因在酸胁迫和酸冷胁迫下的表达稳定性,筛选获得最适内参基因。通过筛选获得的最适内参基因,分析ATCC11842 菌株的目的基因在酸胁迫和酸冷胁迫下qRT-PCR 的相对表达量,验证内参基因的可靠性。为利用qRT-PCR 技术研究保加利亚乳杆菌后酸化功能基因表达以及揭示后酸化机制及定向选育弱后酸化菌株提供依据;也为采用qRT-PCR 技术研究其它益生乳酸菌引起酸奶后酸化或不同条件下功能基因表达提供借鉴。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株 保加利亚乳杆菌(Lactobacillus delbrueckii subsp.buLgaricus)ATCC 11842:保加利亚乳杆菌模式菌株,本研究试验菌株,购自中国普通微生物菌种保藏管理中心 (China General Microbiological Culture Collection Center CGMCC),-80 ℃超低温冰箱保存于河北农业大学食品科技学院发酵工程研究室。
1.1.2 主要试剂 MRS 培养基;DEPC、DNaseI,购于北京康为世纪科技公司;TransZol Up 试剂盒,购于北京全式金生物技术有限公司;RevertAidTM第一链cDNA synthesis 试剂盒,购于美国Thermo Fisher Scientific 公司;SYBRRSelect Master Mix试剂盒,购于美国ABI 公司。
1.1.3 仪器与设备 DL-CJ-1N 型超净工作台,哈尔滨东联电子技术开发有限公司;立式压力蒸汽灭菌器,上海博迅实业有限公司;SHP-250 型生化培养箱,上海精宏实验设备有限公司;TU-1810紫外分光光度计,北京普析通用仪器有限公司;5417R 高速冷冻离心机,德国Eppendorf;ABI 7500 Real-Time PCR 扩增仪,美国ABI 公司。
1.2 试验方法
1.2.1 候选内参基因在酸胁迫和酸冷胁迫下的qRT-PCR 分析
1) 候选内参基因在酸胁迫和酸冷胁迫下总RNA 的提取与cDNA 的合成
①候选内参基因在不同表达条件下的样品制备 保加利亚乳杆菌ATCC11842 经初始pH 值6.5 的MRS 液体培养基42 ℃培养活化2~3 次,以1%(体积分数) 接种于起始pH 6.5、200 mL 液体MRS 的三角瓶中,42 ℃培养9 h 至对数中期后分装3 份(50 mL/管),常温下6 000 r/min、10 min 离心收集菌体,分别在3 种不同的条件下进行培养:一是空白对照(CK)培养:离心管中第1 份离心收集的菌体加入pH 6.5 的50 mL 液体MRS,42 ℃培养40 min;二是T1 酸胁迫培养[22]:离心管中第2份离心收集的菌体加入pH 4.8 的50 mL 液体MRS,42 ℃培养40 min;三是T2 酸冷胁迫培养:离心管中第3 份离心收集的菌体加入起始pH 4.8的50 mL 液体MRS,4 ℃培养40 min。以上3 个样品分别离心收集菌体(其中:CK 和T1 酸胁迫样品在室温下6 000 r/min 离心10 min,T2 酸冷胁迫样品在4 ℃下6 000 r/min 离心10 min),经液氮冷冻后入-80 ℃冰箱保存备用。
②候选内参基因在酸胁迫和酸冷胁迫下总RNA 的提取与cDNA 的合成 将3 个-80 ℃冻存的样品分别在预冷研钵中用液氮研磨至质地细腻的粉末;按照TransZol Up 试剂盒说明书方法提取各样品总RNA;利用DNaseI 去除各样品总RNA中的基因组DNA。采用2%琼脂糖凝胶电泳检测各样品总RNA 的完整性;借助紫外分光光度计检测各样品OD260/OD280与OD260/OD230的比值 (注:OD260/OD280>1.8(DNA)~2.0(RNA),若比值小,说明核酸中存在蛋白质或酚类物质的污染;OD260/OD230>1.8(DNA)~2.0(RNA),若比值小,说明存在碳水化合物与盐(胍盐)的污染),判断各样品总RNA 的纯度和浓度。
采用RevertAidTM 第一链cDNA synthesis(Fermentas)将各样品总RNA 反转录为cDNA:在利用DNaseI 去除各样品总RNA 中的基因组DNA基础上,按照给出的体系合成各样品cDNA 第一条链。反应体系:5×Reaction Buffer 4 μL,RiboLockTMRNA 酶抑制剂 (20 U/μL) 1 μL,10 mmol/L dNTP Mix 2 μL,RevertAidTM M-MuLV逆转录酶(200 U/μL)1 μL,总体系为20 μL。反转录条件为:25 ℃5 min,42 ℃60 min,75 ℃5 min 终止反应。将反转录产物稀释10 倍,分装(20 μL/支)-20 ℃保存备用。
2) qRT-PCR 内参基因与需要验证的功能基因的选择及其引物设计 根据前期转录组学测序结果中估算的基因表达量FPKM 值,选择5 个功能不同的候选内参基因,分别为16SrRNA、rpoB、ldh、rodA 和recA。根据前期转录组学测序结果中KEGG 数据,选择3 个用于做为验证筛选的内参基因的目的基因,分别为:与细胞膜上H+-ATPase相关的基因(Ldb1301)、参与碳水化合物和丙酮酸代谢途径的相关基因(poxI)、参与负责内质网上蛋白质折叠的相关基因(dnaJ)。依据NCBI 已公布的保加利亚乳杆菌(Lactobacillus delbrueckii subsp.bulgaricus)ATCC 11842 的基因组中相应的序列,采用DNAMAN 6.0 软件设计5 个候选内参基因与3 对目的基因的引物,引物序列由华大基因合成,见表1。

表1 候选内参基因与目的基因的引物序列Table 1 Primer sequences of candidate internal reference gene and target gene
3) 候选内参基因在酸胁迫和酸冷胁迫下qRT-PCR 分析
①qRT-PCR 反应条件 候选内参基因的qRT-PCR 反应程序,按照ABI 公司的SYBRRSelect Master Mix 试剂盒说明书的反应体系进行,在ABI 7500 Real-Time PCR 扩增仪上完成。qRT-PCR20 μL 反应体系:cDNA template 1 μL、2×SYBRRSelect Master Mix 10 μL、上下游引物各0.5 μL,加入ddH2O 补齐至20 μL。qRT-PCR扩增程序:50 ℃ 2 min,95 ℃ 2 min,激活Taq DNA polymerase 的活性;95 ℃变性15 s,55 ℃退火15 s,72 ℃延伸30 s,共40 个循环。每个样品反应重复3 次。
②引物特异性鉴定、扩增标准曲线及扩增效率计算 引物特异性鉴定:qRT-PCR 产物通过2%琼脂糖凝胶电泳检测,并作qRT-PCR 扩增后熔解曲线图分析,检测温度为60~95 ℃,每升温1℃,采集5 次荧光信号。判断引物特异性。
扩增标准曲线及扩增效率计算:以候选内参基因的cDNA 第一条链为模板,进行10 倍浓度梯度稀释,配置5 个浓度梯度系列(10-1~10-5),以浓度稀释梯度的对数为横坐标,以候选内参基因的3 次重复的平均Ct 值为纵坐标,绘制候选内参基因的扩增标准曲线;采用qRT-PCR 自带软件计算候选内参基因扩增标准曲线的扩增效率E(%)=(10-1/斜率-1)×100、斜率、回归系数R2。
③候选内参基因Ct 值的分析 qRT-PCR 结束后,仪器自动给出各个样品的Ct 值;再用Excel对原始Ct 值进行统计计算得出平均Ct 值;绘出候选内参基因在酸胁迫和酸冷胁迫不同表达条件下Ct 值分布图,根据Ct 值越低,基因表达量即丰度越高,进行分析比较。
1.2.2 采用3 款软件(geNorm、NormFinder、Bestkeeper)分析比较候选内参基因在酸胁迫和酸冷胁迫下表达稳定性
1) 3 款软件分析比较之前的数据处理方法qRT-PCR 结束后,仪器自动给出各个样品的Ct值;用Excel 对原始Ct 值进行统计计算得出每个候选内参基因的平均Ct 值,根据每个候选内参基因Ct 值的平均值,用Bestkeeper 软件分析比较候选内参基因表达稳定性。根据每个候选内参基因Ct 值的平均值,利用2-△△Ct法计算在酸胁迫和酸冷胁迫不同表达条件下候选基因的相对表达量,根据不同候选内参基因在不同表达条件下的相对表达量,用geNorm、NormFinder 软件分析比较候选内参基因表达稳定性。
2) geNorm 分析比较候选内参基因表达稳定性 geNorm 软件可以根据候选内参基因的相对表达量,换算成候选内参基因平均表达稳定值M,绘制geNorm 分析候选内参基因平均表达稳定值M 值图。一般M 值越小,内参基因的表达稳定性越高;通常M 值<1.5,候选内参基因的表达稳定性非常高,可作为内参基因。
与此同时,geNorm 软件可以对候选内参基因的相对表达量做标准化因子配对差异分析(Vn/n+1),以确定内参基因最佳数目,绘制geNorm 分析候选内参基因表达稳定性最适数目图,一般Vn/n+1<0.15,表示以n 个基因做为内参基因已经稳定,无需选择更多的内参基因;如果Vn/n+1>0.15,则表示以n 个基因做为内参基因不稳定,需要引入n+1 个基因做为内参基因才能稳定。
3) NormFinder 分析比较候选内参基因表达稳定性 NormFinder 软件可以根据候选内参基因的相对表达量,通过求取组内和组间方差,计算平衡表达稳定值SV 及排名,绘制NormFinder 分析候选内参基因表达稳定性的SV 值及排名表。一般SV 值越小,内参基因的表达稳定性越高,排名越前。
4) Bestkeeper 分析比较候选内参基因表达稳定性 Bestkeeper 软件可以根据每个候选内参基因Ct 值的平均值,用Excel 计算候选内参基因之间的标准偏差SD 与变异系数CV%,绘制Bestkeeper 分析候选内参基因表达稳定性的SD 值与CV%值及排名表。一般SD 值与CV%值越小,内参基因的表达稳定性越高,排名越靠前;如果SD值>1,则认为内参基因不稳定。
5) 利用几何平均值法对候选内参基因进行综合排名 采用Excel 的几何平均值计算法对geNorm、NormFinder、Bestkeeper 软件分析的候选内参基因稳定性排名进行几何平均数综合排名,绘制利用几何平均值法对候选内参基因进行综合排名表。一般几何平均值越小,内参基因稳定性越高,排名越前。然后根据3 种软件排名稳定性的r值,分析3 种软件之间的相关性。
1.2.3 筛选获得的内参基因在酸胁迫和酸冷胁迫下表达稳定性的验证 根据筛选获得的内参基因在qRT-PCR 中不同条件下的表达量,计算目的基因在qRT-PCR 中不同条件下的相对表达量,绘制以筛选获得的内参基因的表达量分析目的基因的相对表达量图,通过生物统计学分析目的基因在不同条件下相对表达量的差异显著性,分析目的基因相对表达量的qRT-PCR 结果是否与前期转录组测序结果相一致,进而验证筛选获得的内参基因表达稳定性。
2 结果与分析
2.1 候选内参基因在酸胁迫和酸冷胁迫条件下的qRT-PCR 分析
2.1.1 候选内参基因在酸胁迫和酸冷胁迫下总RNA 质量检测 根据1.2.1 节(1)①、②试验方法,进行保加利亚乳杆菌ATCC11842 菌株在酸胁迫和酸冷胁迫下总RNA 的提取,总RNA 的检测结果,见图1、表2。
由图1可见,提取样品的总RNA 的23S rRNA、16S rRNA 和5S rRNA条带清晰,表明ATCC11842 菌株在酸胁迫和酸冷胁迫不同条件下提取的总RNA 完整性良好。表2显示,提取样品的 总RNA 的OD260nm/OD280nm、OD260nm/OD230nm均 在1.8~2.0 之间,表明ATCC11842 菌株在酸胁迫和酸冷胁迫不同条件下提取的总RNA 的纯度和质量较高。可用于后续试验。

图1 11842 菌株在酸与酸冷胁迫下总RNA琼脂糖凝胶电泳图Fig.1 The electrophoresis of total RNA agarose gel of 11842 strain under acid and acid cold stress
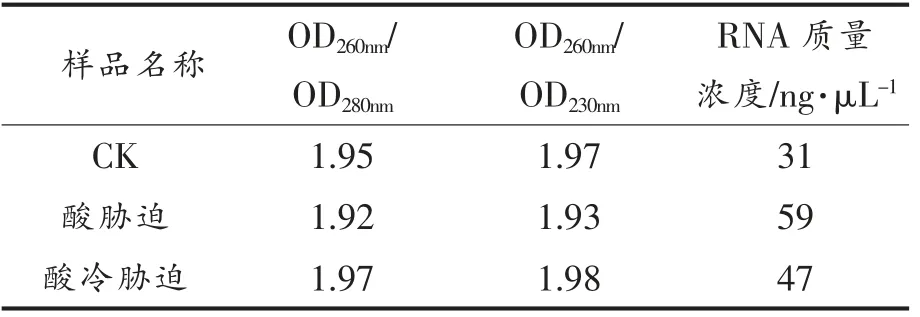
表2 11842 菌株在酸与酸冷胁迫下总RNA 的定量检测结果Table 2 Quantitative detection results of total RNAof 11842 strain under acid and acid cold stress
2.1.2 候选内参基因引物特异性鉴定、扩增标准曲线及扩增效率分析 根据1.2.1 节(2)、(3)①、②试验方法,进行保加利亚乳杆菌ATCC11842 菌株在酸胁迫和酸冷胁迫下5 个候选内参基因的引物特异性鉴定、扩增标准曲线及扩增效率分析,结果见图2、图3、图4、表3。
由图2看出,以ATCC11842 菌株在酸胁迫和酸冷胁迫下提取的总RNA 反转录合成的cDNA为模板进行qRT-PCR 扩增,扩增产物经琼脂糖凝胶电泳检测,5 个候选内参基因条带大小在85~200 bp 之间,与预期的条带大小一致,而且各条带均比较清晰、均呈单一条带,表明5 个候选内参基因qRT-PCR 扩增产物均比较单一,没有出现引物二聚体与其它非正常扩增产物。
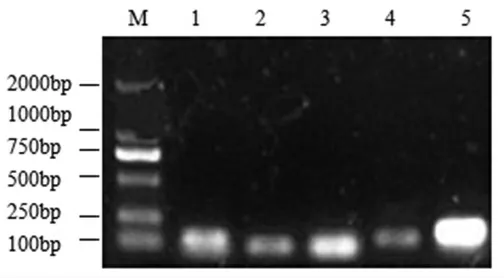
图2 5 个候选内参基因qRT-PCR 产物琼脂糖凝胶电泳图Fig.2 Agarose gel electrophoresis of qRT-PCR products of 5 candidate internal reference genes
由图3可知,5 个候选内参基因经qRT-PCR在65~95 ℃下扩增的熔解曲线,均呈单一信号峰,无其它非特异性杂峰产生,表明5 个候选内参基因的引物设计合理,均能实现候选内参基因的特异性扩增。
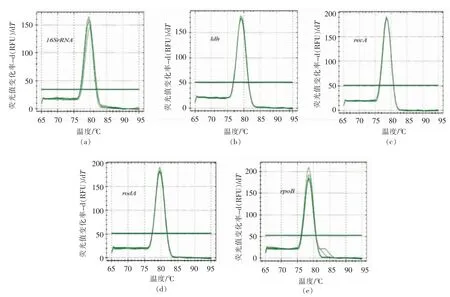
图3 5 个候选内参基因qRT-PCR 熔解曲线Fig.3 qRT-PCR melting curves of 5 candidate internal reference genes
由图4可见,5 个候选内参基因的qRT-PCR扩增标准曲线中,每个内参基因的cDNA 模板浓度分别与Ct 值成反比,各点基本分布在一条直线上。表3显示,5 个候选内参基因的qRT-PCR 扩增效率在91%~97%范围内、相关斜率的回归系数R2均≥0.990。上述结果表明,5 个内参基因所设计引物的qRT-PCR 扩增,线性关系良好,扩增效率较高,符合qRT-PCR 扩增要求,试验结果准确可靠。
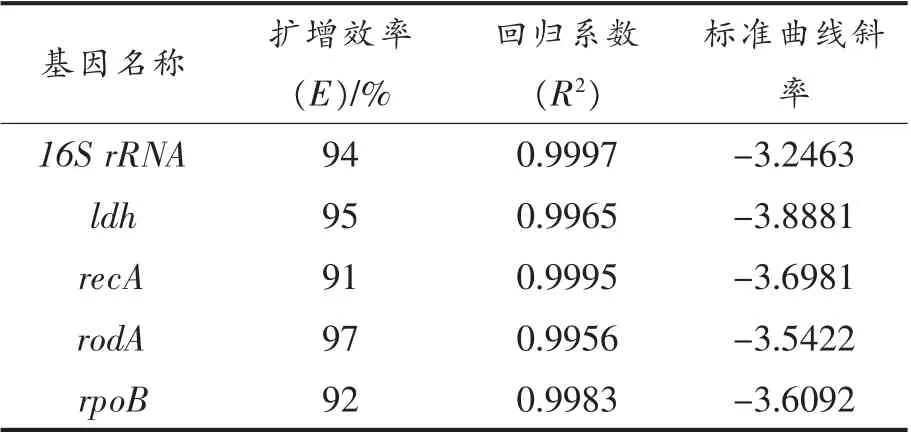
表3 5 个候选内参基因qRT-PCR 扩增效率E%、斜率与回归系数R2Table 3 Five candidate internal reference genes qRT-PCR amplification efficiency E%,slope and regression coefficient R2
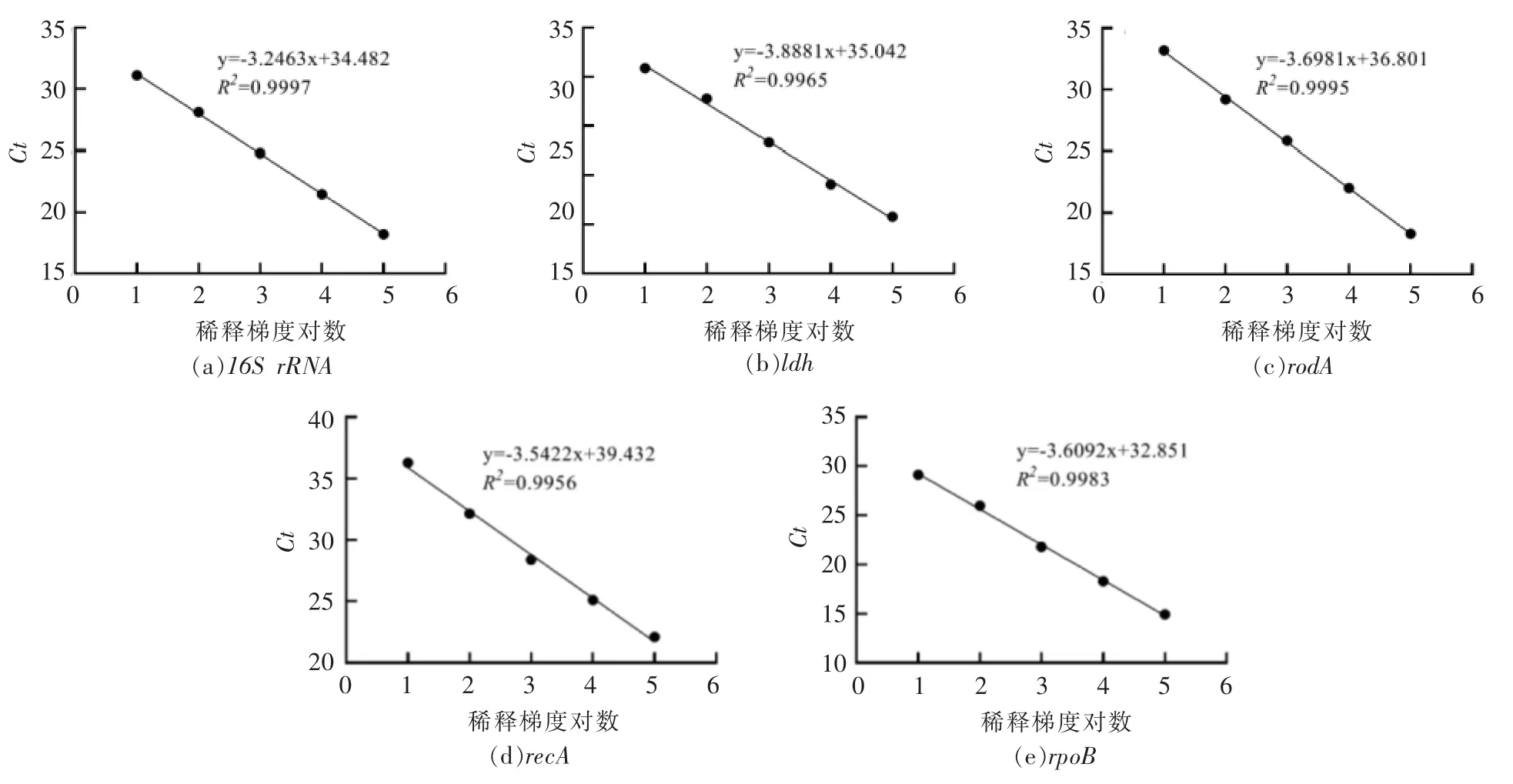
图4 5 个候选内参基因qRT-PCR 扩增标准曲线Fig.4 Five candidate internal reference genes qRT-PCR expansion standard curve
2.1.3 候选内参基因Ct 值的分析 基因表达丰度是指基因转录成mRNA 的数量,基因表达丰度越高,转录成mRNA 的数量越多,合成的蛋白质也越多。Ct 值越小,表示基因的拷贝数越高,基因表达丰度越高。通过不同条件下qRT-PCR 的Ct 值变化,可以评价候选内参基因表达丰度变化。根据1.2.1 节 (3) ③试验方法,进行保加利亚乳杆菌ATCC11842 菌株5 个候选内参基因在酸胁迫和酸冷胁迫下Ct 值的分析,结果见图5。
由图5可看出,5 个候选基因的平均Ct 值介于29.38~36.42 之间,其中rpoB 的Ct 值最小,表达丰度最高;recA 的Ct值最大,表达丰度最低;其它3 个候选内参基因的Ct 值变化范围分别是,16SrRNA (30.01~32.11),ldh (29.23~31.01),rodA(31.29~32.48)。统计分析表明,同一内参基因在不同试验处理条件下(正常培养CK、酸胁迫培养、酸冷胁迫培养)的表达量存在显著(或极显著)差异,其中,处理组(酸胁迫培养、酸冷胁迫培养)与对照组(正常培养CK)相比,存在显著(或极显著)差异,说明酸胁迫和酸冷胁迫能够产生显著(或极显著)影响。从同一内参基因Ct 值在不同试验条件下的变化来看,rpoB 和recA 变化最小,但仍需利用3 款软件对候选内参基因进行表达稳定性分析。
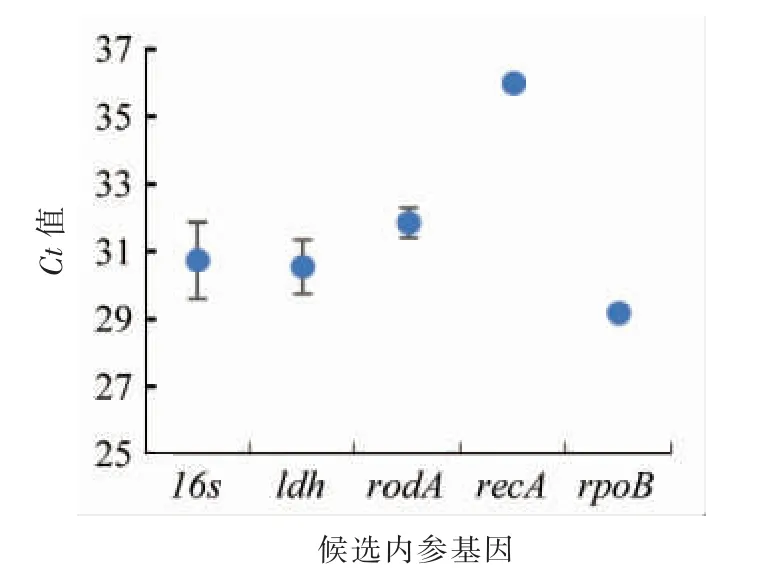
图5 5 个候选内参基因在酸胁迫和酸冷胁迫下Ct 值分布图Fig.5 Ct value distribution of five candidate internal reference genes under acid stress and acid cold stress
2.2 采用3 款软件(geNorm、NormFinder、Bestkeeper) 分析比较候选内参基因在酸胁迫和酸冷胁迫下表达稳定性
2.2.1 Genorm 分析比较候选内参基因表达稳定性 geNorm 软件可以根据内参基因的相对表达量,换算成候选内参基因平均表达稳定值M 值,一般M 值越小,内参基因的表达稳定性越高;通常M 值<1.5,候选内参基因的表达稳定性非常高,可作为内参基因。与此同时,geNorm 软件可以对候选内参基因的相对表达量做标准化因子配对差异分析(Vn/n+1),以确定内参基因的最佳数量,一般Vn/n+1<0.15,表示以n 个基因做为内参基因已经稳定,无需选择更多的内参基因;如果Vn/n+1>0.15,则表示以n 个基因做为内参基因不稳定,需要引入n+1 个基因做为内参基因才能稳定。根据1.2.2 节(1)、(2) 试验方法,进行保加利亚乳杆菌ATCC11842 菌株5 个候选内参基因在酸胁迫和酸冷胁迫下表达稳定性的geNorm 分析,结果见图6。
由图6a 可知,6 个候选内参基因在不同试验处理条件下(正常培养CK、酸胁迫培养、酸冷胁迫培养) 的M 值均<1.5,理论上均可以作为内参基因;以M 值为标准的内参基因表达稳定性排序为recA(0.005)=rpoB(0.005)<rodA(0.02)<ldh(0.03)<16SrRNA(0.04)。表明recA 和rpoB 的M 值最小,表达稳定性最高,适宜作为保加利亚乳杆菌ATCC11842 菌株在酸胁迫和酸冷胁迫下基因表达的内参基因。
由图6b 可见,所有3 个条件组的标准化因子配对差异值Vn/n+1值均<0.15,而且V2/3 配对变异值最小(0.009)。表明没有必要引入第3 个内参基因,适宜的内参基因数目为2 个。
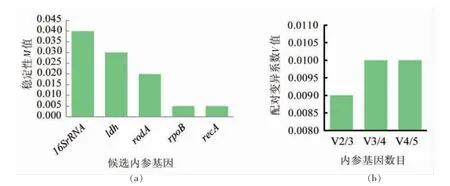
图6 geNorm 软件分析5 个候选内参基因的表达稳定值与最适数目Fig.6 geNorm software analyzes the expression stability value and optimal number of 5 candidate internal reference genes
2.2.2 NormFinder 分析比较候选内参基因表达稳定性 NormFinder 软件可以根据候选内参基因的相对表达量,通过求取组内和组间方差,计算平衡表达稳定值SV 及排名。一般SV 值越小,内参基因的表达稳定性越高,排名越前。根据1.2.2 节(1)、(3) 试验方法,进行保加利亚乳杆菌ATCC11842 菌株5 个候选内参基因在酸胁迫和酸冷胁迫下表达稳定性的NormFinder 分析,结果见表4。
表4显示,以SV 值为标准的内参基因表达稳定性的排序为recA(0.002)=rpoB(0.002)<ldh(0.024)<rodA (0.026)<16SrRNA (0.035)。表明recA 和rpoB 的SV 值最小,表达稳定性最高,适宜做为保加利亚乳杆菌ATCC11842 菌株在酸胁迫和酸冷胁迫下基因表达的内参基因,与geNorm 软件分析结果相符。
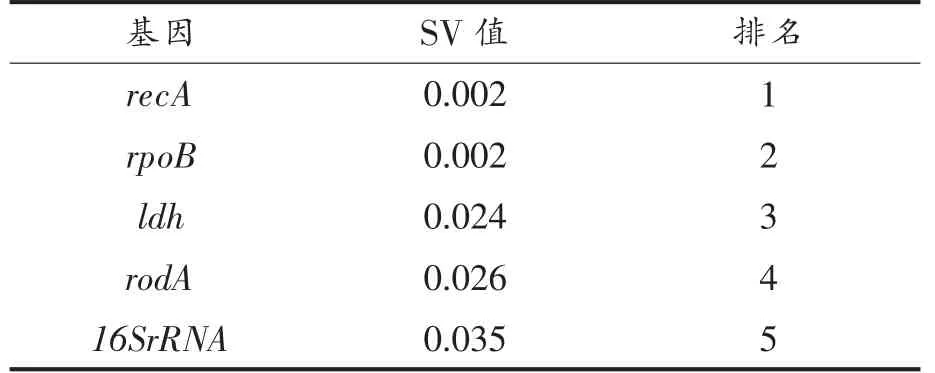
表4 NormFinder 软件分析5 个候选内参基因的表达稳定性与排名Table 4 NormFinder software analyzes the expression stability and ranking of 5 candidate internal reference genes
2.2.3 Bestkeeper 分析比较候选内参基因表达稳定性 Bestkeeper 软件可以根据每个候选内参基因Ct 值的平均值,用Excel 计算候选内参基因之间的标准偏差(SD)和变异系数(CV%),一般SD值与CV%值越小,内参基因的表达稳定性越高,排名越前;如果SD 值>1,则认为内参基因不稳定。根据1.2.2 节(1)、(4)试验方法,进行保加利亚乳杆菌ATCC11842 菌株5 个候选内参基因在酸胁迫和酸冷胁迫下表达稳定性的Bestkeeper 分析,结果见表5。
由表5看出,5 个候选内参基因在不同试验处理条件下(正常培养CK、酸胁迫培养、酸冷胁迫培养) 的SD 值均<1,理论上均可以作为内参基因;以CV%±SD 值为标准的内参基因表达稳定性排序为rpoB (0.26±0.08)<recA (0.49±0.18)<rodA(1.06±0.18)<ldh(2.02±0.62)<16SrRNA(2.81±0.86)。表明rpoB 和recA SD 值与CV%值最小,是表达稳定性最高的2 个内参基因,适宜做为保加利亚乳杆菌ATCC11842 菌株在酸胁迫和酸冷胁迫下基因表达的内参基因,与geNorm 和NormFinder 软件分析结果基本吻合。

表5 Bestkeeper 软件分析5 个候选内参基因的表达稳定性与排名Table 5 Bestkeeper software analyzes the expression stability and ranking of 5 candidate internal reference genes
2.2.4 利用几何平均值法对候选内参基因进行综合排名 采用Excel 的几何平均值计算法对geNorm、NormFinder、Bestkeeper 软件分析的候选内参基因稳定性排名进行几何平均数综合排名。一般几何平均值Ct 值越小,内参基因稳定性越高,排名越前。再根据3 款软件排名稳定性的r值,分析3 种软件之间的相关性。根据1.2.2 节(5)试验方法,对geNorm、NormFinder、Bestkeeper 软件分析的候选内参基因稳定性排名进行几何平均数综合排名,结果见表6。
由表6看出,根据几何平均值Ct 分析,5 个候选内参基因在不同试验处理条件下 (正常培养CK、酸胁迫培养、酸冷胁迫培养)的表达稳定性由高到低综合排名依次是rpoB(1.00)≥recA(1.26)>rodA(3.30)>ldh(3.63)>16SrRNA(5.00),表明rpoB和recA 几何平均值最小,表达稳定性最高,适宜做为保加利亚乳杆菌ATCC11842 菌株在酸胁迫和酸冷胁迫下基因表达的内参基因,与geNorm、NormFinder 和Bestkeeper 软件分析结果相符。根据3 款软件排名稳定性的r 值分析它们之间的相关性得出geNorm 与Bestkeeper 之间相关性最高(r=0.93),达到极显著水平(P<0.01)。

表6 利用几何平均值法对候选内参基因综合排名Table 6 Comprehensive ranking of candidate internal reference genes using geometric mean method
2.3 筛选获得的内参基因在酸胁迫和酸冷胁迫下表达稳定性的验证
为了进一步验证筛选获得的保加利亚乳杆菌ATCC11842 菌株在酸胁迫(T1)和酸冷胁迫(T2)下2 个内参基因rpoB 和recA 的表达稳定性,通过分析保加利亚乳杆菌ATCC11842 菌株的3 个目的基因Ldb1301 (与细胞膜上H+-ATPase 相关的基因)、poxI (参与碳水化合物和丙酮酸代谢途径的基因)和dnaJ(负责内质网上蛋白质折叠的基因)在酸胁迫(T1)和酸冷胁迫(T2)下的相对表达量而实现。根据筛选获得的内参基因在qRT-PCR中不同条件下的表达量,计算目的基因在qRTPCR 中不同条件下的相对表达量,通过生物统计学分析目的基因在不同条件下相对表达量的差异显著性,分析目的基因相对表达量的qRT-PCR 结果是否与前期转录组测序结果相一致。根据1.2.3节试验方法,验证筛选获得的保加利亚乳杆菌ATCC11842 菌株在酸胁迫(T1)和酸冷胁迫(T2)下2 个内参基因rpoB 和recA 的表达稳定性,结果见图7。

图7 以rpoB 和recA 为内参基因分析在T1(酸胁迫)和T2(酸冷胁迫)下poxI(a)、Ldb1301(b)、dnaJ(c)的相对表达量Fig.7 Analysis of relative expression levels of poxI(a),Ldb1301 (b),dnaJ (c) under T1 (acid stress)and T2 (acid cold stress) using rpoB and recA as internal reference genes
由图7可知,以筛选获得的rpoB 和recA 作为内参基因时,3 个目的基因(poxI、Ldb1301、dnaJ)在qRT-PCR 中酸胁迫和酸冷胁迫下的相对表达量存在显著差异(P<0.05),即poxI 和dnaJ 在酸胁迫下表达量均上调,在酸冷胁迫下表达量均下调;而Ldb1301 在酸胁迫和酸冷胁迫下表达量均上调。3 个目的基因在qRT-PCR 中酸胁迫和酸冷胁迫下的相对表达量分析结果与前期转录组学测序分析结果一致。本试验进一步证明,recA 和rpoB 适宜做为qRT-PCR 研究保加利亚乳杆菌ATCC11842 在酸胁迫和酸冷胁迫下基因表达的内参基因。
3 讨论与结论
发酵乳制品工业在国民经济中占有越来越重要的地位,保加利亚乳杆菌既是酸奶发酵剂的常用菌种,又是引起酸奶后酸化的主要菌种。随着分子生物学技术研究的深入,在进行保加利亚乳杆菌后酸化形成机制研究与功能基因筛选时,常利用转录组测序技术;而对转录组测序结果中后酸化相关功能基因表达量的分析验证,则多采用qRT-PCR 技术。选择表达水平稳定的内参基因是提高qRT-PCR 结果准确性的重要前提,一般采用管家基因做为qRT-PCR 的内参基因[23],但近年来研究发现,这些管家基因并非在所有生理条件下都能稳定表达,表现为它们的转录水平并非稳定[11],目前对保加利亚乳杆菌在不同条件下筛选内参基因的研究,尚未见报道。
本文首先根据前期保加利亚乳杆菌ATCC11842 菌株在后酸化不同条件下转录组学测序结果,选择5 个候选内参基因,通过qRT-PCR的基因表达水平即Ct 值分析,结果表明,同一候选内参基因Ct 值在不同试验条件下,rpoB 和recA表达量变化最小,初步判断,rpoB 和recA 可做为内参基因。此外,在进行qRT-PCR 的Ct 值分析试验时,做为本底信号3~15 个循环的荧光信号,通常存在检测误差,因此一般取Ct 值在15~35 个循环的数据进行分析。其次,采用3 款软件geNorm、NormFinder 和Bestkeeper,分析比较了5 个候选内参基因在后酸化不同条件下qRT-PCR 的表达稳定性,3 款软件分析比较结果一致得出:rpoB 和recA 是表达最稳定的2 个基因,可作为筛选出的内参基因。值得注意的是:由于3 款软件所用的统计分析方法不同,有时会出现3 款软件分析比较内参基因排名结果不完全一致的现象[24],这就需要利用几何平均值法对候选内参基因进行综合排名。本研究为了提高试验结果的可靠性,仍采用几何平均值法对5 个候选内参基因进行综合排名,结果表明:综合排名结果与3 款软件分析比较结果相符。最后,运用筛选出的内参基因rpoB 和recA,分析了ATCC11842 菌株3 个目的基因pox-I、Ldb1301 和dnaJ 在后酸化不同条件下qRTPCR 的相对表达量,结果表明,3 个目的基因在后酸化不同条件下qRT-PCR 的相对表达量的分析结果与前期转录组学测序分析结果一致,进一步证实了本研究筛选获得的2 个内参基因rpoB 和recA 的可靠性。
本试验筛选获得的2 个内参基因之一rpoB基因,是细菌RNA 聚合酶β 亚基的编码基因,为单拷贝基因,序列高度保守,在基因转录中发挥重要作用。本研究筛选获得的2 个内参基因之二的recA 基因,是细菌中编码RecA 蛋白的基因,序列高度保守,在DNA 同源重组与DNA 损伤应急修复(SOS)中发挥重要作用。Lin 等[19]在研究植物乳杆菌R23 经SO2胁迫处理前后的基因表达量时,通过筛选8 个候选内参基因得到最稳定的内参基因为rpoB、rpoC、recA 和ldh。而赵文静等[25]研究了ldh、recA、rpoB、gapdh 和16S rRNA 5 个内参基因在植物乳杆菌发酵过程中的表达稳定性,结果表明在不同发酵时间节点中表达最稳定的是ldh 基因。Wen 等[26]研究了干酪乳杆菌发酵过程中关键酶基因表达变化分析时 对recA、gapd、gyrB、16S rRNA 和ldh 5 个候选内参基因的表达稳定性进行分析,发现最稳定的为gapd 和gyrB 基因。
综上所述,本研究通过层层筛选与验证,获得了保加利亚乳杆菌ATCC11842 在后酸化不同条件下qRT-PCR 表达稳定的2 个内参基因rpoB 和recA,为利用qRT-PCR 技术深入研究保加利亚乳杆菌后酸化功能基因表达以及进一步揭示后酸化机制及定向选育弱后酸化菌株提供了可靠依据;也为采用qRT-PCR 技术研究其它益生乳酸菌引起酸奶后酸化或不同条件下功能基因表达提供了借鉴指导。

