真空低温喷雾干燥制备乳双歧杆菌Probio-M8微胶囊
郭 帅,王昊乾,徐鹏飞,许家齐,郑新飞,张和平
(内蒙古农业大学 乳品生物技术与工程教育部重点实验室 呼和浩特 010018)
益生菌是一种活的微生物,当摄入足够的浓度时,可以为宿主提供健康益处[1]。益生菌不仅可以调节肠道菌群平衡,而且具有多种生物活性,双歧杆菌就是益生菌群的典型代表之一[2-3]。目前,双歧杆菌已在医药和食品等行业广泛应用。研究表明,双歧杆菌与人和动物饮食、健康以及疾病密切相关[4-5],它可以通过产生抗菌物质[6],抑制致病菌生长[7],减轻炎症反应[8],增强免疫应答[9]等方式,维持和调节体内平衡,促进宿主健康。乳双歧杆菌Probio-M8 在食品和医药行业具有较高的应用价值。
双歧杆菌对氧气、高温等环境因素非常敏感,在益生菌制剂的开发和贮藏过程中极易死亡,其作用及应用都受到一定的限制,因此,双歧杆菌活菌制剂的制备并提高其贮藏稳定性十分必要。微胶囊化的双歧杆菌可减少与氧气等外界不利环境的接触,提高菌体存活率及增强对不利环境的抵抗能力,有利于益生菌在肠道内定殖[7]。在食品生产工业中,喷雾干燥是常用的微胶囊化方法,与冷冻干燥相比,喷雾干燥具有设备、仪器简单、成本低、速率高及连续性强[10]等优点,适合益生菌大规模生产、运输和储存。然而,在喷雾干燥过程中,由于益生菌菌体与高温空气的充分接触对菌体造成伤害,严重影响菌粉活菌数的存活率[11],因此菌体存活率降低是喷雾干燥制备菌粉的主要问题。采用真空低温喷雾干燥技术,乳双歧杆菌Probio-M8微胶囊在较低的温度下快速干燥,降低了干燥过程中菌体的高温胁迫及氧化应力,极大地提高了菌体的生物活性。
本试验中采用真空低温喷雾干燥技术制备乳双歧杆菌Probio-M8 微胶囊,筛选出最佳工艺条件,对微胶囊粉进行细胞膜完整性的检测,粉末形态特征、玻璃化转变温度、干燥前、后脂肪酸变化的研究,以期为乳双歧杆菌Probio-M8 微胶囊生产提供一种低能耗、高活性产品的技术方案,为乳双歧杆菌Probio-M8 的商业化应用提供理论支持。
1 材料与方法
1.1 菌种与培养基
供试菌株乳双歧杆菌Probio-M8(Bifidobacterium animalis subsp.lactis Probio-M8) 分离自内蒙古自治区呼和浩特市健康妇女母乳,由内蒙古农业大学乳酸菌菌种资源库(Lactic Acid Bac teria Collection Center,LABCC)提供。
MRS 培养基(英国Oxoid 公司);改良MRS 培养基:MRS 培养基添加0.50 g/L 的L-半胱氨酸盐酸盐。
1.2 试剂与仪器
脱脂乳、海藻糖、谷氨酸钠、甲醇(分析纯)、甲醇钠(分析纯)、正己烷(分析纯)、荧光染料LIVE/DEAD 试剂盒,美国Invitrogen 公司。
YC-2000 真空低温喷雾干燥机,上海雅程仪器设备有限公司;CytoFLEX S 流式细胞仪,美国贝克曼库尔特公司;TM4000PLUS 扫描电镜,日本株式会社日立高新技术那珂事业所;DSC25 型差示扫描量热仪,美国TA 公司;Technologies 6850气相色谱仪,安捷伦科技有限公司;Synergy H1 酶标仪,美国BioTek 公司;HD-3A 型智能水分活度测量仪,无锡市华科仪器仪表有限责任公司。
1.3 方法
1.3.1 菌种活化培养、收集 将冷冻保存(-80℃) 的Probio-M8 菌种接种至改良MRS 液体培养基中,在37 ℃厌氧条件下连续活化3 代,以提高菌株活力,4 500 g 离心15 min,用PBS 冲洗2 次,收集菌泥。
1.3.2 喷雾干燥工艺研究
1.3.2.1 保护壁材优化 本试验选取脱脂乳、海藻糖、麦芽糊精、谷氨酸钠以及阿拉伯胶为研究壁材,以Probio-M8 菌体存活率为评价指标,进行单因素试验。然后将筛选出的3 种具有良好保护效果的壁材继续进行3 因素3 水平的正交试验。其中喷雾条件:进风温度75 ℃,进料速度9 mL/min,真空度0.025,喷雾压力0.25 MPa,喷头直径1 mm,菌含量109CFU/mL。
1.3.2.2 进风温度对菌体存活率及水分含量的影响 设置不同进风温度,分别为:60,65,70,75,80,85,90 ℃。测定对应温度下菌体的存活率及水分含量,喷雾条件为:最佳复配保护剂,进料速度9 mL/min,真空度0.025,喷雾压力0.25 MPa,喷头直径1 mm,菌含量109CFU/mL。
1.3.2.3 进料速度对菌体存活率及水分含量的影响 设置不同进料速度,分别为:1.8,5.4,9,12.6,16.2 mL/min。测定对应进料速度下菌体的存活率及水分含量,喷雾条件为:最佳复配保护剂,进风温度75 ℃,真空度0.025,喷雾压力0.25 MPa,喷头直径1 mm,菌含量109CFU/mL。
1.3.2.4 喷头直径对菌体存活率及水分含量的影响 选取不同直径的喷头,分别为:1,1.5,2 mm。测定对应喷头直径下菌体的存活率及水分含量,喷雾条件为:最佳复配保护剂,进风温度75 ℃,进料速度9 mL/min,真空度0.025,喷雾压力0.25 MPa,菌含量109CFU/mL。
1.3.2.5 Box-Behnken 响应面试验优化喷雾条件以单因素试验结果为前提,利用Box-Behnken 响应面试验对进风温度、进料速度、喷头直径进行3因素3 水平优化。喷雾条件为:最佳复配保护剂,真空度0.025,喷雾压力0.25 MPa,菌含量109CFU/mL。
1.3.3 活菌计数及存活率计算 以改良MRS 琼脂培养基为计数培养基,采用稀释平板菌落计数法。菌体存活率计算公式:
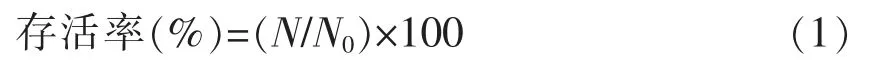
试中:N——干燥后样品单位体积活菌数,CFU/g;N0——干燥前样品单位体积活菌数,CFU/g。
1.3.4 水分含量测定 取3~5 g 微胶囊粉剂,使用全自动水分测定仪测定微胶囊粉剂水分含量。
1.3.5 脂肪酸测定
1.3.5.1 脂肪酸的提取 采用Beal 等[12]的方法提取膜脂肪酸并略做修改。离心收集菌体并用PBS清洗2 次,取0.5 g 湿菌泥,加入2 mL 的1 mol/L甲醇钠-甲醇溶液,振荡1.5 min 后,4 ℃放置10 min,加入1 mL 正己烷,漩涡振荡1 min,静置5 min,随后离心5 min(6 000 g),离心结束后吸取上层液相转入气相瓶中进行上机分析。
1.3.5.2 细胞膜脂肪酸含量的测定 本试验采用气相色谱法测定细胞膜脂肪酸的含量。
气相色谱分析条件:PEG 毛细管填充柱(30 m×0.22 mm i.d.,0.25 μm film,Restek);色谱柱温度:100 ℃保持1 min,随后以4 ℃/min 升温至250℃,保持5 min。进样口温度为260 ℃;检测器温度为280 ℃;柱压为63.4 kPa;载气为He;载气流速为29.6 mL/min;总流量为0.5 mL/min。通过与脂肪酸标样进行比对,采用归一化法分析脂肪酸含量。
1.3.6 细胞膜完整性 本试验用荧光染料LIVE/DEAD 试剂盒对菌细胞染色,用来表征喷雾干燥前后Probio-M8 菌体细胞膜完整度的变化。
操作如下:菌悬液100 μL,浓度控制 (106~108)cells/100 μL 加入5 μL 的PI 工作液和5 μL的SYTO 9 工作液,避光15 min 后用流式细胞仪检测,收取10 000 个菌体分别计算各荧光强度。
1.3.7 形态特征观察 通过扫描电子显微镜(SEM)观察真空低温喷雾干燥后Probio-M8 微胶囊粉的微观形态。取少许微胶囊粉置于贴胶的进样台上,设置电压为10 kV,调节最佳视野以及选取合适的放大倍数进行观察。
1.3.8 DSC 测量 利用差示扫描量热仪(DSC)测量Probio-M8 微胶囊粉的玻璃化转变温度。取5 mg 微胶囊粉置于铝盘中并进行压样,取一相同的空铝盘作为参照。样品以10 ℃/min 的升温速率从-40 ℃至100 ℃进行程序升温。
2 结果与分析
2.1 保护剂优化结果
图1为5 种壁材在不同浓度下对Probio-M8的保护效果。由图1可知,当脱脂乳、麦芽糊精、谷氨酸钠添加量为10%,海藻糖添加量为15%,阿拉伯胶添加量为20%时,各保护剂的保护效果最好,Probio-M8 的存活率分别为:68.85%,68.62%,67.46%,65.13%,60.21%。故选取脱脂乳、麦芽糊精、谷氨酸钠3 种保护效果较好的保护壁材进行正交试验。结果如表1所示。
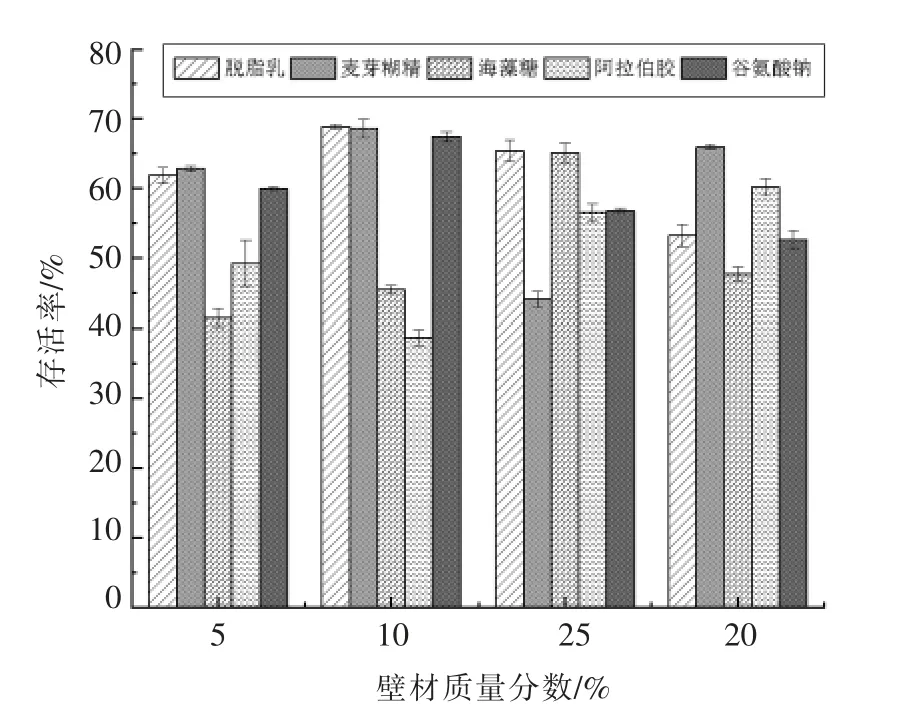
图1 不同壁材对双歧杆菌M8 微胶囊品质的影响Fig.1 Effect of different wall materials on the quality of Probio-M8 microcapsules
脱脂乳是制备益生菌微生态制剂时广泛使用的保护壁材,由于细胞与蛋白之间存在疏水相互作用,在这个过程中,菌体细胞表面会形成一层具有保护细胞的蛋白层,对细胞保护有极其显著的效果[13],麦芽糊精是用于食品微胶囊的良好壁材之一,具有良好的乳化特性及成膜特性。谷氨酸钠具有一定的抗氧化作用,在干燥过程中能够保护细胞减少氧化伤害。通常认为不同保护原理的保护剂复合后会优于单一保护剂对菌体的保护效果,因此我们采用复配保护剂来作为Probio-M8的微胶囊壁材,由表1可见,根据极值R 可知各保护壁材对存活率的影响大小依次为:脱脂乳>麦芽糊精>谷氨酸钠,最佳的复配组合为A3B2C1,即脱脂乳添加量为13%、麦芽糊精为10%、谷氨酸钠为7%时,具有最佳的保护效果,喷雾干燥后Probio-M8 的存活率达到73.80%,显著提高了喷雾干燥菌剂的存活率。

表1 正交试验及结果Table 1 Orthogonal experiment and results
2.2 喷雾干燥条件优化结果
2.2.1 进风温度对存活率及水分含量的影响 进风温度对产品的颗粒结构、产品形貌和热敏性成分的稳定性等有重要的影响。图2所示是进风温度对菌体存活率和含水量的影响。
从图2看出:菌体的存活率随进风温度的升高呈线性下降,当进风温度从60 ℃升高到90 ℃时,菌体存活率从(69.98±0.67)%降低到(54.27±1.59)%。微胶囊粉的水分含量也随进风温度的升高从(5.35±0.07)%降至(2.7±0.10)%。根据实际情况,应该选择高存活率和低水分含量的参数,因此综上因素,确定适合Probio-M8 喷雾干燥的进风温度为75 ℃,此时的菌体存活率为(75.85±1.13)%,残留水分含量为(4.05±0.05)%。
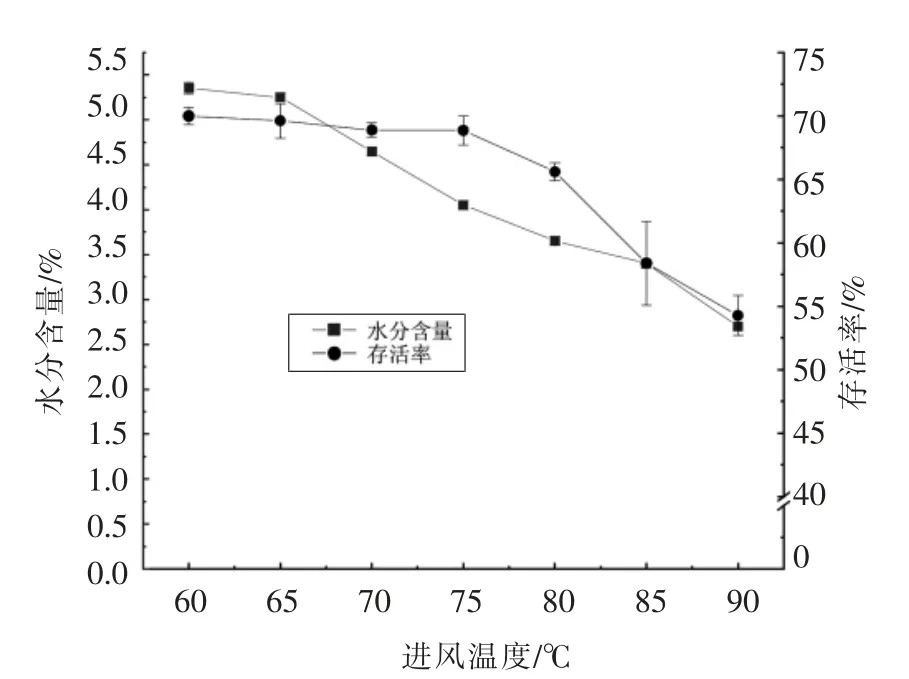
图2 进风温度对Probio-M8 微胶囊品质的影响Fig.2 Effect of different inlet temperature on the quality of Probio-M8 microcapsules
2.2.2 进料速度对存活率及水分含量的影响 进料速度过快常造成干燥不完全或菌体结块,产品含水量高,若进料速度过低时,菌体热接触时间较长,影响菌体存活率[14]。进料速度对菌体存活率和含水量的影响如图3所示。

图3 进料速度对Probio-M8 微胶囊品质的影响Fig.3 Effect of different feed rates on the quality of Probio-M8 microcapsules
由图3可看出,在1.8~9 mL/min 的进料速度范围内,随着进料速度的增加菌体存活率呈上升趋势,进料速度为9 mL/min 时菌体存活率最高,为68.85%,进料速度提升至12.6 mL/min 和16.2 mL/min 时,菌体存活率分别下降至59.98%和55.34%。研究发现,随着进料速度提升,喷雾干燥产品的含水量呈线性上升趋势,表明进料速度较大时,产品干燥不完全。因此,进料速度宜选择9 mL/min 为好。
2.2.3 响应面法优化真空低温喷雾干燥制备微胶囊工艺 根据单因素试验结果,以进风温度、进料速度、喷头直径为自变量,菌剂存活率为因变量,在单因素试验的基础上设计3 因素3 水平共17个点的响应面分析,表2为具体设计及结果。

表2 响应面试验设计及结果Table 2 Response surface experiment design and results
利用Design Expert 8.0.6 软件对表2试验数据进行多元回归拟合,并对进风温度(A)、进料速度(B)和喷头直径(C)与存活率进行回归分析,得到回归方程如下:
存活率 (%)=78.34-5.521A+4.24B-0.38C+3.86AB+0.46AC+2.22BC-7.78A2-4.25B2-5.98C2
试验模型的方差分析结果如表3,模型极显著(P<0.0001),失拟性不显著(P>0.05),说明模型具有良好拟合性,试验误差小,与实际情况符合,模型能代表真空低温喷雾干燥制备M8 微胶囊实际存活率。模型中回归系数的显著性检验显示,一次项A、B 对存活率的影响极显著(P<0.01),一次项C 对存活率影响不显著(P>0.05),二次项A2、B2、C2对喷雾干燥制备M8 微胶囊存活率影响极显著(P<0.01)。此方程模型的系数为R2=0.9737,Radj2=0.9399,说明该模型能解释97.37%和93.99%的响应值变化,具有较高的可信度,可用于真空低温喷雾干燥制备Probio-M8 微胶囊存活率的预测。

表3 二次多项式模型的系数及其方差分析Table 3 Coefficients and ANOVA for the developed quadratic polynomial model
图4a 所示为进风温度与进料速度对Probio-M8 微胶囊存活率的影响以及二者之间的交互作用,当进料速度一定时,存活率随着进风温度增加呈先升后降的趋势;当进风温度一定时,存活率随着进风温度增加呈现先升后降的趋势,进风温度的上升幅度明显比进料速度陡峭,说明进风温度比进料速度对Probio-M8 微胶囊存活率影响大。图4b 所示为进风温度和喷头直径对Probio-M8微胶囊存活率的影响以及二者之间的交互作用,存活率随进风温度与喷头直径的增加呈先上升后下降的趋势,且进风温度的上升幅度大于喷头直径的上升幅度,说明进风温度对Probio-M8 微胶囊存活率的影响比喷头直径大。图4c 所示为进料速度和喷头直径对Probio-M8 微胶囊存活率的影响以及二者之间的交互作用,存活率随进料速度与喷头直径的增加呈先上升后下降的趋势,且进料速度的上升幅度大于喷头直径的上升幅度,说明进料速度对Probio-M8 微胶囊存活率的影响比喷头直径大。因此,比较进风温度、进料速度、喷头直径3 个因素可知,影响菌剂喷雾干燥存活率的因素的顺序为:进风温度>进料速度>喷头直径。经过以上分析可知,当进风温度为80 ℃、进料速度9 mL/min、喷头直径1.5 mm 时,为最佳喷雾条件,在此条件下喷雾干燥制备所得Probio-M8 微胶囊存活率为78.34%,水分含量为3.20%%,储存期长。
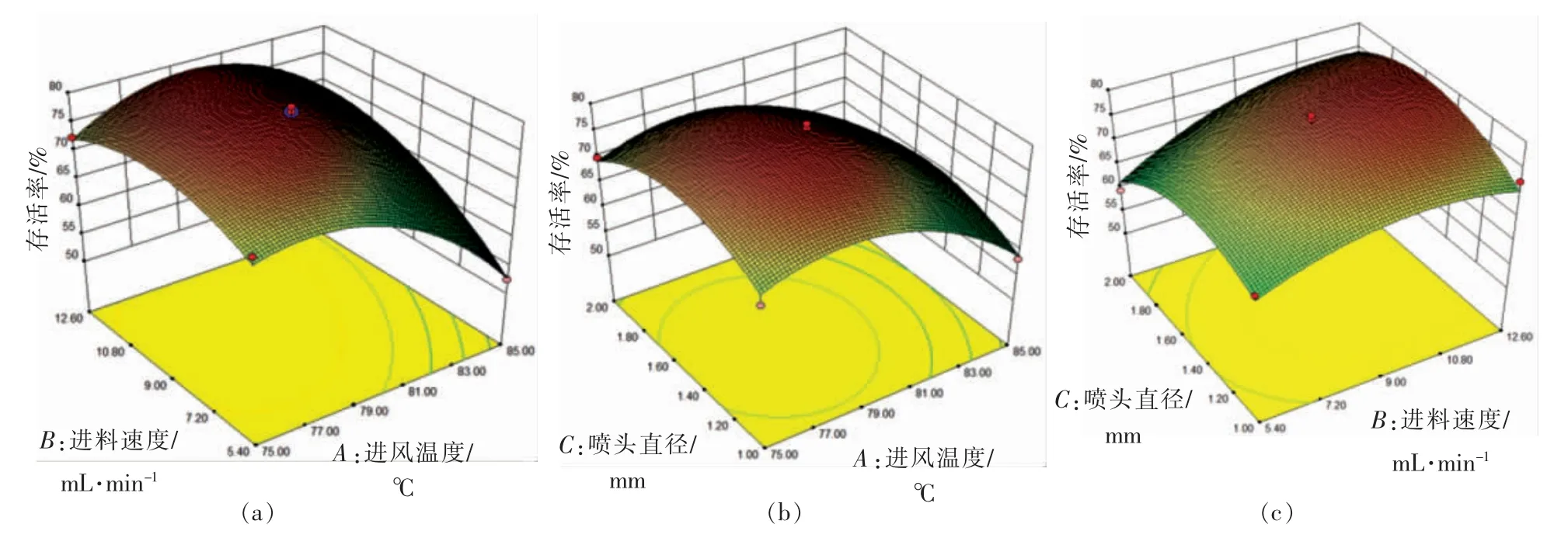
图4 因素交互作用响应曲面及相应的等高线图Fig.4 Response surface plot and contour map of interactive effects of various factors
2.3 干燥前后细胞膜脂肪酸变化
细胞膜是细菌抵御外部不利条件的第一道防线,首先对逆境影响产生有利于细胞的调节,为了适应各种环境的改变,使细胞膜的流动性与细菌的生命活动相适应[15-16],通过改变不饱和脂肪酸和饱和脂肪酸的比例来适应环境的改变,从而维持菌体细胞稳定生长[17-18]。表4显示了真空低温喷雾干燥对Probio-M8 细胞膜脂肪酸组分的影响。
真空低温喷雾干燥对Probio-M8 细胞膜脂肪酸组成变化如表4,主要由C12:0(月桂酸)、C14:0(肉豆蔻酸)、C16:0(棕榈酸)、C16:1(棕榈油酸)、C18:0(硬脂酸)、C18:1w9c(油酸)、C18:3(亚麻酸)、C19cyc11(环丙烷脂肪酸)8 种脂肪酸组成,占总脂肪酸含量的84%以上,此外对含量较低或不能稳定检测出的脂肪酸没有进行分析。从总体上看,干燥后Probio-M8细胞膜脂肪酸的UFA/SFA 的比值提高了0.44,可能是菌体通过改变它们细胞膜脂肪酸的成分来适应环境的变化,主要体现为干燥后饱和脂肪酸含量下降8.72%(P<0.05) 和不饱和脂肪酸含量上升11.78%(P<0.05)。不饱和脂肪酸棕榈油酸、油酸、环丙烷脂肪酸在干燥后相对含量都发生了不同程度的增加,研究表明,细胞膜中不饱和脂肪酸(即油酸) 的存在增强了不同种类乳酸菌的抗逆性[19-20],此外,环丙烷脂肪酸在细胞膜中起到调整细胞膜流动性、稳定细胞膜结构和控制细胞膜通透性的作用,在胁迫适应性反应中起到重要作用[21-23]。
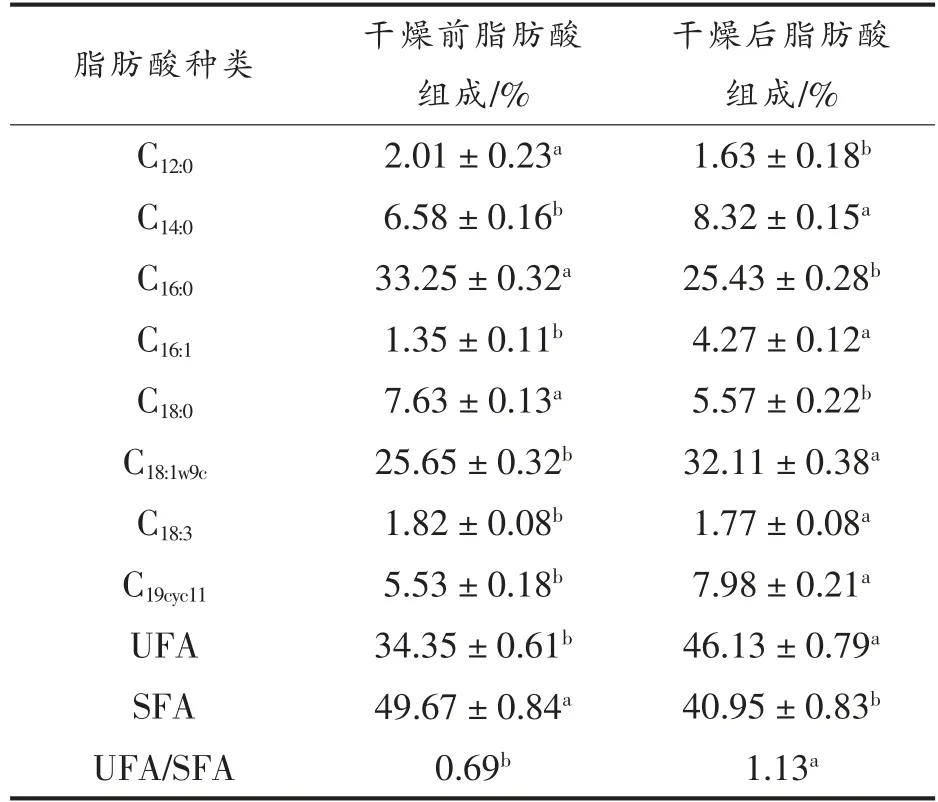
表4 Probio-M8 细胞膜脂肪酸相对含量Table 4 Relative content of fatty acid composition in the cell membrane of Probio-M8
2.4 细胞膜完整性
本试验用LIVE/DEAD 细菌荧光染色探针对菌细胞染色,LIVE/DEAD 细菌荧光染色探针由SYTO 9 和PI 两种荧光染色剂组成,其中SYTO 9可以穿过所有细菌的细胞膜,使菌体呈现绿色荧光,而PI 仅能穿过破损细胞膜使菌体呈现红色。
细胞膜作为对抗外界不良环境的重要屏障,维持着稳定的细胞内环境,在生长、代谢和抗逆性中起着至关重要的作用,细胞膜的完整性是维持细胞存活和代谢活性的关键因素[24]。流式细胞仪检测结果如图5所示。图5b 为未添加保护剂时的检测结果,Q1 区域为99.28%,表明在喷雾干燥的过程中,在高温作用下绝大多数菌体细胞发生死亡;而使用最佳工艺后,Probio-M8 微胶囊检测结果如图5c 所示,Q4 区域的量显著增加,达到78.80%,表明最佳工艺的使用显著降低了喷雾干燥过程中高温对细胞膜的损伤,有效保护了菌体细胞膜的完整性。

图5 Probio-M8 喷雾干燥前后的流式细胞图Fig.5 Flow cytometric fluorescence dot plot of Probio-M8 before and after spray drying
2.5 SEM 检测
通过使用扫描电镜对Probio-M8 微胶囊微观结构和表面形貌的分析,其结果如图6所示。由图可知,微胶囊表面结构完整,呈现球形和不同大小的颗粒,颗粒直径为10~18 μm,由于微胶囊颗粒水分含量均较低,因此没有明显的粘连现象。另外,颗粒表面并没有出现破裂以及孔洞现象,这说明对内部菌体有很好的保护作用。一方面可以避免高温对微球内部菌体造成的损伤,另一方面可以有效防止储存过程中细胞膜脂质的过氧化。但是颗粒表面出现了不同程度的凹陷和褶皱。这是由于在喷雾干燥过程中,高温作用使颗粒水分迅速蒸发而急速收缩导致的,没有对内部菌体造成损伤。

图6 Probio-M8 微胶囊SEM 图Fig.6 SEM pictogram of Probio-M8 microcapsules
2.6 玻璃化转变温度
在菌剂存储过程中,菌剂的状态对其稳定性具有十分重要的影响。有研究报道,当微胶囊颗粒处于玻璃态时,微胶囊内氧气、水分等的流动将会受到限制,细胞膜的氧化和化学反应降低,从而较好地保护益生菌,使益生菌可以在长时间的存储过程中保持较高的存活率[25-26]。
图7为Probio-M8 菌剂的DSC 扫描图,由曲线可知喷雾干燥制备的Probio-M8 菌剂的玻璃化转变温度(Tg)为57.46 ℃。由此说明,Probio-M8 微胶囊在常温下贮藏时处于玻璃态,复合壁材对于保持Probio-M8 微胶囊稳定性具有极其显著的保护效果,对Probio-M8 微胶囊的开发利用有重要的参考价值。

图7 Probio-M8 微胶囊DSC 扫描图Fig.7 DSC thermograph of Probio-M8 microcapsules
3 结论
本试验研究了乳双歧杆菌Probio-M8 微胶囊真空低温喷雾干燥的最佳工艺条件,最优喷雾条件为:进风温度80 ℃,进料速度9 mL/min,喷头直径1.5 mm;最优复配保护剂为:脱脂乳添加量13%,麦芽糊精10%,谷氨酸钠7%。最优工艺条件下得到的Probio-M8 微胶囊存活率是78.34%,水分含量为3.20%。干燥后细胞膜脂肪酸的UFA/SFA 的比值较干燥前提高了0.44,菌体通过调节细胞膜脂肪酸的成分来适应环境的改变。流式细胞术的检测表明最优工艺条件的使用显著降低了喷雾干燥过程中高温对细胞膜的损伤,有效保护了菌体细胞膜的完整性。最佳工艺条件制备的Probio-M8 微胶囊常温下处于玻璃态,并且扫描电镜下显示其结构完整,这对保持微胶囊稳定性方面发挥极其重要的作用。通过对真空低温喷雾干燥制备Probio-M8 微胶囊工艺的研究,对利用真空低温喷雾干燥技术高质量且快速生产益生菌剂有重要的指导作用。

