烟酰胺腺嘌呤二核苷酸对急性脊髓缺血再灌注损伤的保护作用
杨玉山,郭洪録,熊 健
脊髓缺血再灌注损伤(SCII)是脊髓组织缺血后恢复血流灌注时,引起的细胞代谢障碍和组织结构破坏。缺血再灌注损伤可引起脊髓缺血相关的复杂代谢紊乱,从而导致神经元变性和坏死[1]。脊髓神经损伤或功能障碍可导致许多严重并发症[2]。寻找一种有效的治疗方法来改善SCII导致的神经损伤是非常重要的。烟酰胺腺嘌呤二核苷酸(NAD+)是机体能量代谢的关键辅因子,也是多种酶的底物[3]。研究[4]表明,脑缺血再灌注会引起聚腺苷二磷酸核糖聚合酶-1(PARP-1)的过度激活,从而导致大脑中NAD+水平的降低。此外,NAD+的补充可预防大脑中星形细胞死亡[5]。由于大脑和脊髓对缺血再灌注损伤的炎症反应有一些相似之处[6],因此笔者假设NAD+对SCII可能有神经保护作用,并加以研究探讨其内在机制。
1 材料与方法
1.1 实验动物24只10周SD雌性大鼠,体重为210~230 g,购自上海实验动物公司,清洁级。按随机数字表法分成3组,每组8只,分别为A组(不夹闭主动脉)、B组(主动脉夹闭后注射生理盐水)和C组(主动脉夹闭后注射 NAD+)。大鼠的饲养操作严格按照长江大学实验动物规定进行,所有实验用动物饲养于有温度控制的环境中,并有照明和黑灯的循环,动物均自由进食,实验前做适应性喂养1周。所有程序经长江大学动物管理和使用委员会批准。
1.2 手术方法根据文献[7]的描述制备SCII动物模型。用2.5%戊巴比妥钠按60 mg/kg腹腔麻醉大鼠。从中线打开腹膜,暴露腹主动脉,A组不对主动脉进行夹闭,其他两组用50 g动脉夹在右肾动脉上方阻断主动脉,使脊髓缺血60 min,取出夹子,关闭腹部切口。B组动脉夹闭后腹腔注射0.9%生理盐水0.1 ml,C组动脉夹闭后腹腔注射50 mg/kg的NAD+。
1.3 神经功能评估脊髓损伤后大鼠的后肢神经功能采用大鼠脊髓损伤(BBB)评分[8]进行评估,由两位经验丰富但不清楚本实验设计的评估人员,在脊髓损伤术前及术后3、6、12、24、48 h进行评估并记录,将每只大鼠单独放在开阔的地方观察活动5 min,记录从0分(完全瘫痪)到21分(正常运动)的BBB评分。
1.4 固定、切片和染色术后48 h每组选取4只大鼠,2.5%戊巴比妥钠(60 mg/kg)腹腔麻醉,通过心脏对大鼠灌注200 ml生理盐水(35 ml/min),然后灌注4%多聚甲醛300 ml(25 ml/min)。收集脊髓组织固定于4%多聚甲醛中24 h。切取胸腰段脊髓区域组织1 cm,采用不同浓度的乙醇脱水,二甲苯透明处理,石蜡包埋。切取脊髓横截面,5 μm厚,每0.5 mm选取一片于载玻片上,每个脊髓组织切取20片,二甲苯脱蜡处理, 100%和95%乙醇水化,尼氏染色。切片浸入56 ℃甲苯胺蓝染液中30 min,酒精阶梯分色,二甲苯透明处理,树脂封片。
1.5 氧化应激及抗氧化能力检测术后48 h每组选取4只大鼠腹腔注射2.5%戊巴比妥钠(120 mg/kg),以脊髓损伤处(T13~L1)为中心切取新鲜脊髓组织约1.5 cm,取一半用预冷磷酸盐缓冲液(PBS)清洗,另一半留作用于蛋白免疫印迹实验。加入10倍脊髓重量的预冷PBS,用匀浆器转化为100 g/L的脊髓匀浆。4 ℃下对匀浆进行离心(3 500 r/min)15 min。根据试剂盒说明书测量脊髓组织中超氧化物歧化酶(SOD)活性与丙二醛(MDA)含量。
1.6 蛋白质免疫印迹取“1.5”项中获得的一半新鲜脊髓组织,用包含2 mg蛋白酶抑制剂的放射免疫沉淀法(RIPA)缓冲液进行匀浆。4 ℃下以12 000g离心力离心30 min,取出上清液,100 ℃加热10 min,用10%的聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶进行电泳,转膜后分别孵育Cleaved Caspase-3、Gapdh的一抗和相应二抗,在LAS 4000显色系统中进行显影并拍照,Image J 1.46软件分析显影的灰度值。

2 结果
2.1 3组神经功能比较见图1。BBB评分3组术前均为21分;术后3、6、12、24和48 h A组均为21分;B组依次为3~6(4.5±1.3)分、6~8(6.8±1.0)分、8~10(8.7±1.0)分、9~11(9.8±0.9)分和9~11(10.3±1.0)分;C组依次为7~9(8.3±0.9)分、9~11(10.5±1.0)分、10~13(11.5±1.3)分、11~15(12.8±1.7)分和11~13(12.3±1.1)分。术后各个时间点BBB评分B组和C组均低于A组(P<0.05),C组均高于B组(P<0.05)。
2.2 3组尼氏染色结果比较见图2。一侧脊髓前角正常运动神经元数目:A组7~11(8.8±1.7)个,B组 1~2 (1.3±0.5)个,C组 4~9个 (6.7±2.2)个,A组明显多于B组和C组(P<0.05),C组明显多于B组(P<0.05)。
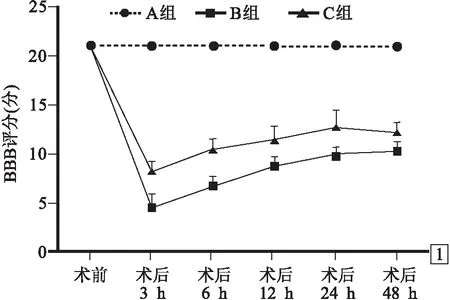
图1 手术前后3组BBB评分比较
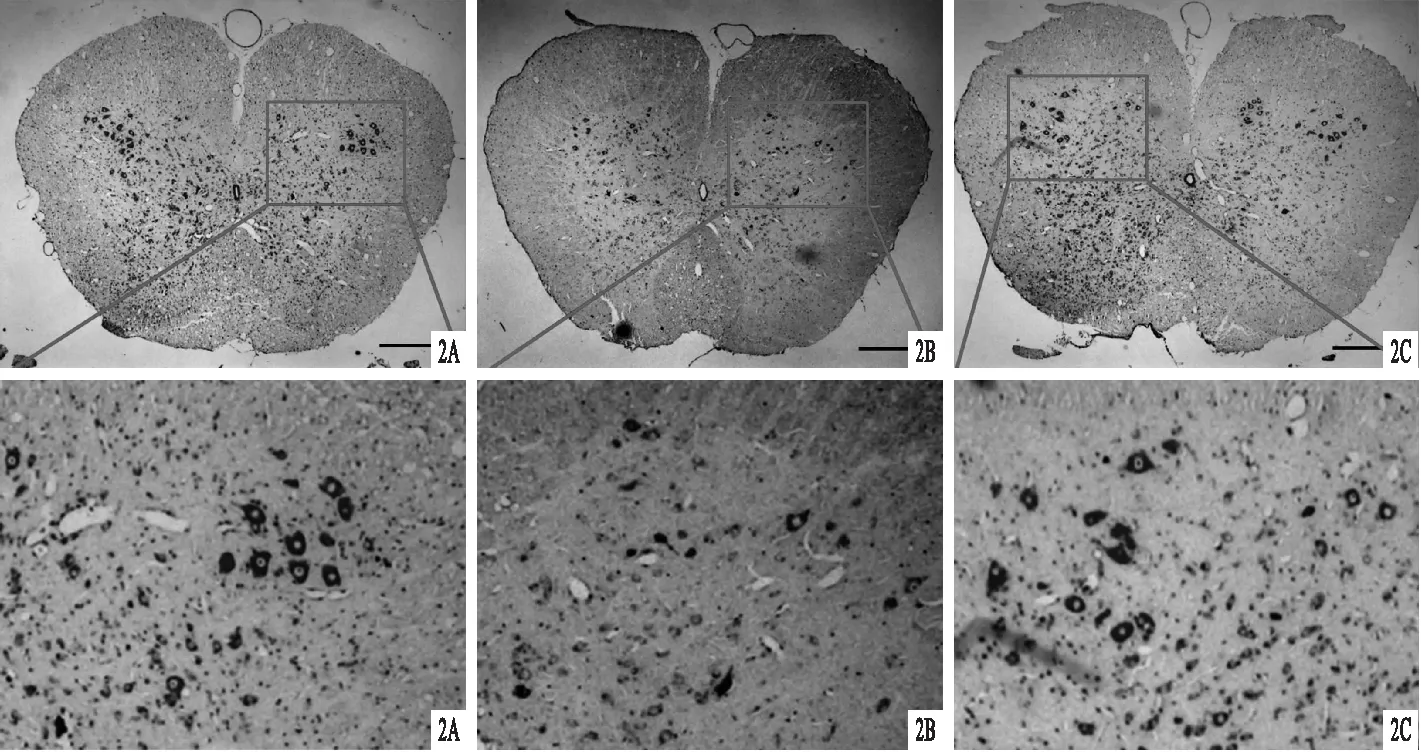
图2 3组尼氏染色结果 A.A组神经元形态正常,胞质清晰,胞核均匀;B.B组脊髓前角的完整运动神经元明显丧失,可见核萎缩和前角运动神经元细胞消失;C.C组脊髓前角的运动神经元得到了明显的保留
2.3 3组氧化应激和抗氧化能力的比较① 术后48 h SOD活性:A组为261.3~284.6(276.3±11.5)U/mg prot,B组为178.6~222.8(199.4±21.3)U/mg prot,C组为211.3~264.3(240.1±23.2)U/mg prot,B组和C组均低于A组(P<0.05),B组低于C组(P<0.05),见图3。 ② 术后48 h MDA含量:A组为5.5~6.8(6.2±0.5)nmol/mg prot,B组为12.1~15.4(13.3±1.5)nmol/mg prot,C组为8.3~11.5(9.9±1.3)nmol/mg prot,B组和C组均高于A组(P<0.05),B组高于C组(P<0.05),见图4。
2.4 3组蛋白质免疫印迹检测结果比较见图5。术后48 h Cleaved Caspase-3蛋白表达水平:A组为0.26~0.35(0.30±0.05),B组为0.82~1.00(0.91±0.09),C组为0.55~0.68(0.60±0.07)。B组和C组均高于A组(P<0.05),B组高于C组(P<0.05)。
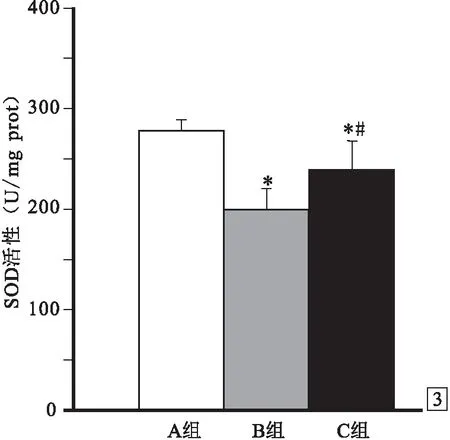
图3 3组术后48 h SOD活性比较 与A组比较:*P<0.05;与B组比较:#P<0.05
3 讨论
SCII是脊柱外科和血管外科较严重的并发症,尽管手术技术的提高减少了其发生,但近20%的高危患者仍会发生SCII[2]。尽管导致SCII的细胞和分子机制尚未清楚解释,但研究[1]表明,氧化应激在缺血发病机制中起着关键作用,可能是缺血再灌注损伤的治疗靶点。因此,针对SCII后的氧化应激可能为神经保护提供一种理想的治疗方法。
NAD+是机体能量代谢的关键辅因子,也是多种酶的底物。研究[9]表明,NAD+可降低氧化应激诱导的大鼠心肌细胞凋亡,改善脑缺血损伤。然而,关于NAD+对SCII是否有保护作用的研究还比较少。中枢神经系统含有大量的脂质,研究[10]提示脂质参与了脊髓损伤主要的病理生理变化,如自由基诱导的脂质过氧化和继发性神经元损伤。MDA来源于多不饱和脂肪酸的分解,是确定过氧化反应程度的关键和可靠指标[11]。SOD催化超氧化物阴离子歧化为过氧化氢和分子氧,是对抗活性氧代谢产物的主要防御手段[12]。本研究结果显示,术后48 h MAD含量B组和C组均高于A组(P<0.05),B组高于C组(P<0.05);SOD活性B组和C组均低于A组(P<0.05),B组低于C组(P<0.05)。这表明NAD+有利于改善SCII后的氧化应激反应。氧化应激被认为是细胞凋亡的一种强介质,氧化应激引起的线粒体功能障碍可能导致细胞色素C的释放和Cleaved Caspase-3的激活,进而导致细胞死亡[13]。Cleaved Caspase-3是一种经常被激活的死亡蛋白酶,是程序性细胞死亡的关键介质,催化许多关键细胞蛋白的特异性分裂。研究[14]提示,NAD+ 的补充可以防止细胞的死亡,并且NAD+的补充被认为是一种减少神经元缺血损伤的有效方法[15]。本研究结果显示,术后48 h Cleaved Caspase-3的蛋白表达水平B组高于C组(P<0.05),我们认为NAD+可能减少了SCII后的氧化应激并抑制线粒体Cleaved Caspase-3介导的凋亡,通过减少神经元凋亡来改善功能。另外,本研究结果显示,脊髓前角的正常形态运动神经元数目C组明显多于B组(P<0.05),术后各时间段BBB评分C组高于B组(P<0.05),提示NAD+ 改善SCII大鼠的运动神经功能可能是通过减少脊髓前角的正常运动神经元的凋亡来实现的。
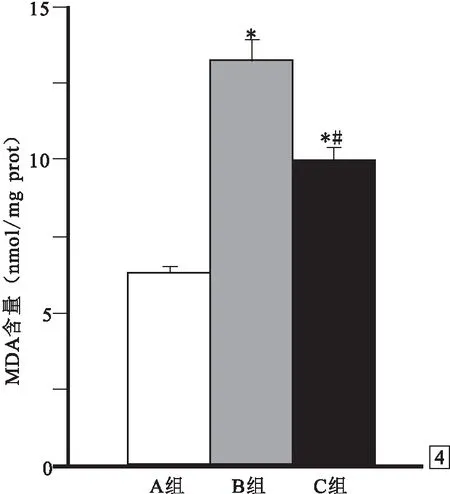
图4 3组术后48 h MDA含量比较 与A组比较:*P<0.05;与B组比较:#P<0.05
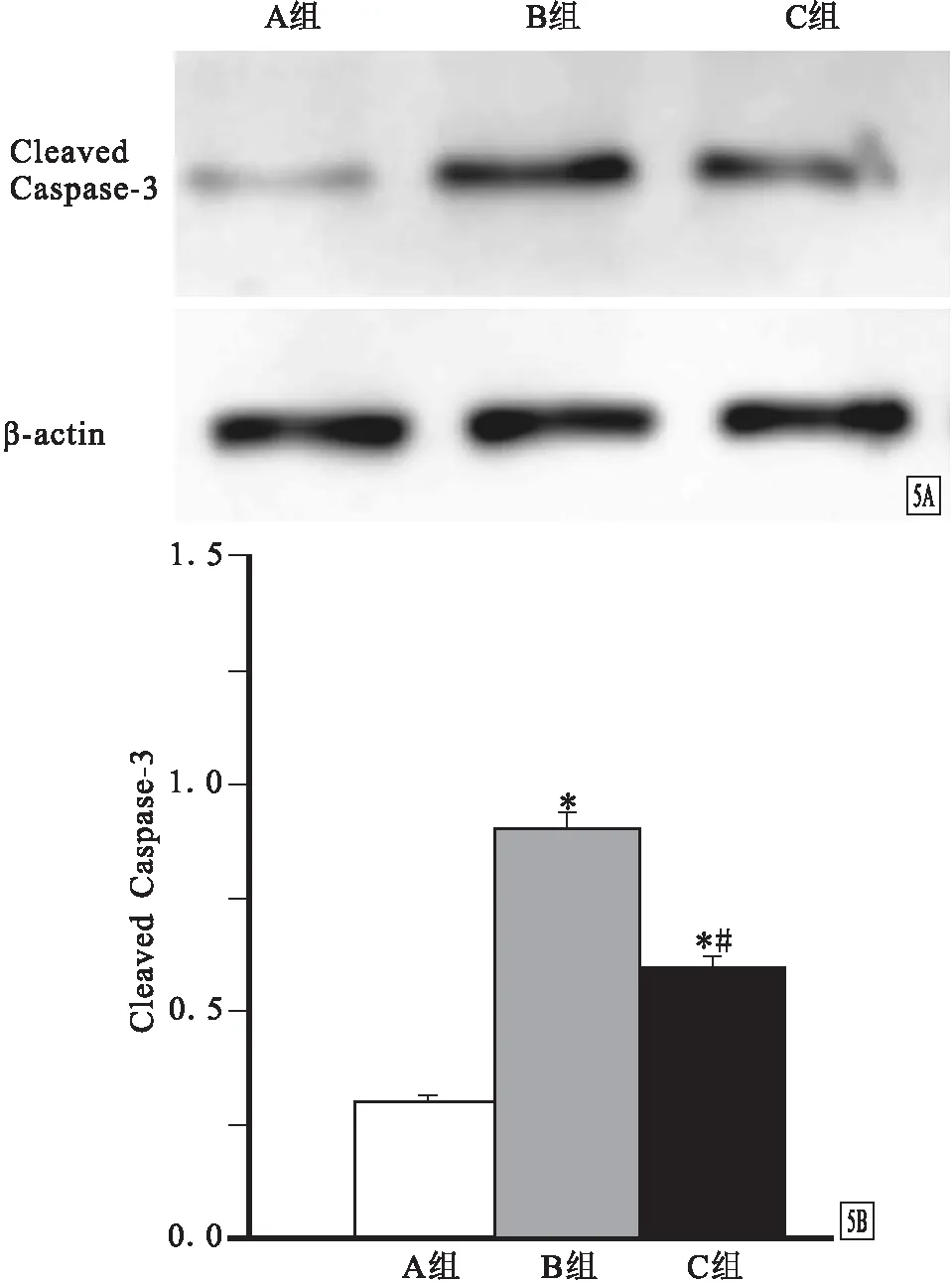
图5 3组术后48 h Cleaved Caspase-3的蛋白表达水平比较 A.3组Cleaved Caspase-3的蛋白质免疫印迹检测结果;B.3组Cleaved Caspase-3蛋白质免疫印迹的灰度值 与A组比较:*P<0.05;与B组比较:#P<0.05
综上所述,NAD+ 能够通过减弱SCII后的氧化应激反应,减少脊髓前角运动神经元的凋亡,从而改善SCII大鼠的运动功能。

