MEBO 在瘢痕疙瘩90Sr同位素放射治疗中的应用效果分析
刘新昊 刘先群 朱吉凤 张恒术
瘢痕疙瘩是外伤或手术后成纤维细胞大量增殖, 细胞外基质和胶原蛋白过度沉积于真皮层所致的皮肤纤维化疾病[1-2]。 瘢痕疙瘩好发于胸前区、肩胛、 四肢及耳部, 是具有瘙痒、 疼痛、 充血等临床症状的肿块样组织, 超出病损边缘向周围正常皮肤浸润性生长是其主要特征[3-4], 严重者可出现局部组织畸形, 位于关节部位者还可导致局部功能障碍, 进而影响患者的生活质量[5]。 目前, 临床上治疗瘢痕疙瘩的方法较多, 但临床疗效较差, 且极易复发, 是整形外科研究的重点及难点。 为提高瘢痕疙瘩的治疗效果, 自上世纪80 年代开始重庆医科大学附属第一医院整形外科应用手术切除联合锶-90 (90Sr) 同位素敷贴治疗瘢痕疙瘩, 虽然取得了一定的临床疗效, 但同位素剂量不足时远期复发率较高、 剂量过大时放射性皮炎发生率较高[6], 如何在达到有效照射剂量的同时避免放射性皮炎的发生成为临床亟待解决的难题。 本研究笔者鉴于湿润烧伤膏 (moist exposed burn ointment, MEBO) 能够有效防治放射性皮炎的发生及发展[7], 将其应用于瘢痕疙瘩90Sr 同位素放射治疗后的局部处理, 取得了较为满意的临床疗效, 现报道如下。
1 临床资料
1.1 一般资料
选取2019 年1 月至2020 年6 月重庆医科大学附属第一医院收治的79 例瘢痕疙瘩患者 (共99 处瘢痕疙瘩) 作为研究对象, 并按照随机数表法将其随机分为治疗组38 例 (46 处瘢痕疙瘩) 和对照组41 例 (53 处瘢痕疙瘩)。 两组患者性别、 年龄、 体重指数等一般资料对比,P均>0.05, 差异无统计学意义, 具有可比性 (表1)。 本研究经重庆医科大学附属第一医院医学伦理委员会批准, 且所有患者均签署了知情同意书。
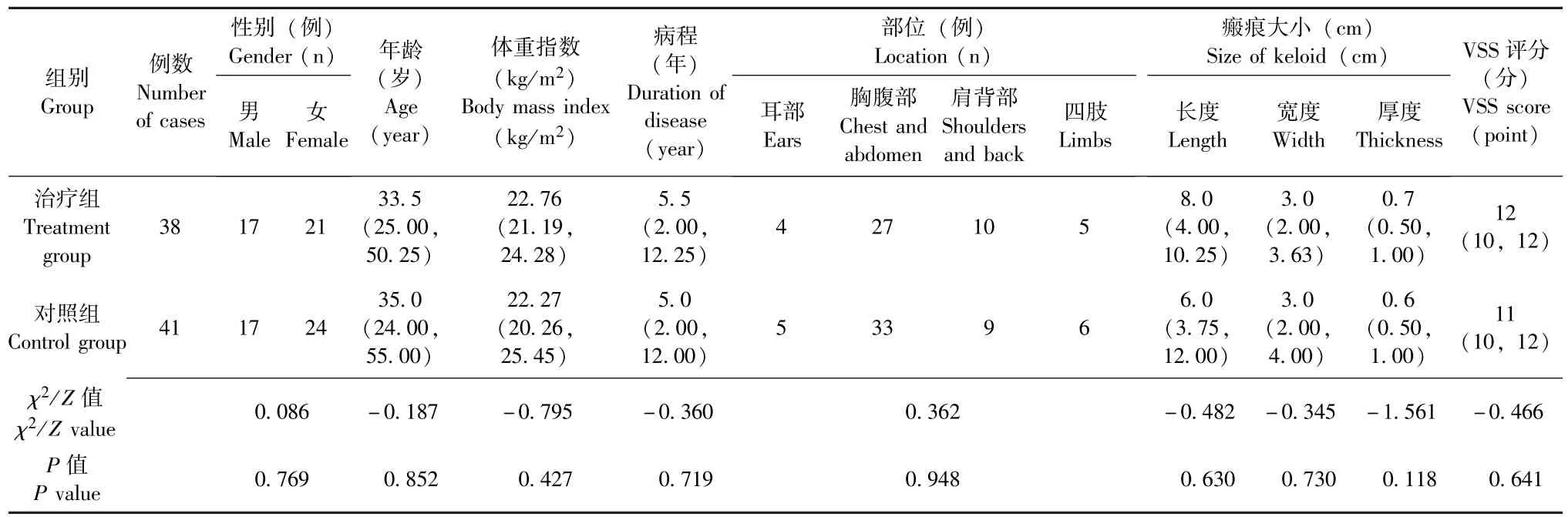
表1 两组瘢痕疙瘩患者一般情况对比Table 1 Comparison of general data of patients with keloids between the two groups
1.2 纳入与排除标准
纳入标准: 临床诊断及术后病理均证实为瘢痕疙瘩; 年龄≥16 岁; 能够按要求完成定期随访;对本研究知情, 并自愿签署知情同意书。 排除标准: 合并有恶性肿瘤、 糖尿病、 自身免疫性疾病等可影响本研究结果的全身性疾病; 合并有心、 脑、肝、 肾等重要器官功能障碍; 入选前3 个月服用过激素、 免疫抑制剂等可影响本研究结果的药物; 对本研究所用药物成分过敏; 妊娠期及哺乳期女性。
2 方法
2.1 治疗方法
所有患者瘢痕疙瘩均予以手术切除, 切除后使用2-0 至4-0 可吸收缝线行皮下缝合及皮内减张缝合; 继而, 使用6-0 单丝尼龙线缝合皮肤, 缝针边距控制在0.2 ~0.3 cm, 针距控制在0.5 cm (无法直接缝合者行局部皮瓣转移覆盖创面)。 术后48 h内开始行90Sr 同位素照射治疗, 非照射部位皮肤覆盖6 层锡箔纸进行保护, 距切口边缘0.5 cm 内暴露并使用90Sr 同位素照射治疗仪 (中国原子能研究院生产, 有效照射面积为2.0 cm×2.0 cm) 贴于皮肤表面逐步移动进行照射, 每次照射时间控制在150 s, 每周照射 1 次, 治疗 4 次后调整为每 2 周照射1 次, 连续照射治疗8 周。
治疗组: 术后及放射治疗后, 切口及照射部位均匀涂抹MEBO, 厚约1.0 mm, 涂抹范围超过照射边缘1.0 cm, 每天换药2 次, 直至放射治疗结束后1 周。
对照组: 术后及放射治疗后, 切口及照射部位应用碘伏常规换药, 每天1 次, 直至放射治疗结束后1 周。
注意事项: 治疗期间, 嘱患者保持照射区域皮肤清洁、 干燥, 避免挠抓及阳光直晒; 放射治疗前拭净残余MEBO, 禁止使用其他乳液或乳霜。
2.2 观察指标及评价标准
对比两组患者切口愈合时间、 治疗期间放射性皮肤损伤情况及疗程结束后瘢痕评分、 瘙痒与色素沉着情况。 放射性皮肤损伤情况采用美国肿瘤放射治疗协会 (radiation therapy oncology group, RTOG)急性放射损伤分级标准[8]进行评定, 0 级: 照射野皮肤无变化; 1 级: 照射野皮肤出现滤泡样暗红色斑、 脱发、 干性脱皮、 出汗减少; 2 级: 照射野皮肤出现触痛性或鲜红色斑, 片状湿性脱皮及中度水肿; 3 级: 照射野皮肤出现皮肤皱褶以外部位的融合性湿性脱皮及凹陷性水肿; 4 级: 照射野皮肤出现溃疡、 出血、 坏死。 治疗结束后, 采用温哥华瘢痕量表 (Vancouver scar scale, VSS)[9]对治疗部位进行评分, 量表共包含色泽、 厚度、 血管分布和柔软度四个方面, 总分为0 ~15 分, 分值越高说明瘢痕越严重。 瘙痒症状按照患者自身感受分为无瘙痒、 轻度瘙痒和重度瘙痒。 色素沉着由医生进行评定, 按实际情况分为无色素沉着、 轻度色素沉着和重度色素沉着。
2.3 统计学处理
采用SPSS 20.0 统计软件对所得数据进行统计学分析, 偏态分布的计量资料以中位数 (四分位数) 表示, 组间比较采用 Wilcoxon 秩和检验; 计数资料以频数或百分比表示, 采用卡方检验或等级资料的秩和检验; 均以P<0.05 为差异具有统计学意义。
3 结果
治疗组患者切口愈合时间及疗程结束后瘢痕评分与对照组无明显差异 (P均>0.05), 而放射性皮肤损伤、 瘙痒及色素沉着发生情况均轻于对照组(P均 <0.05), 详见表2。
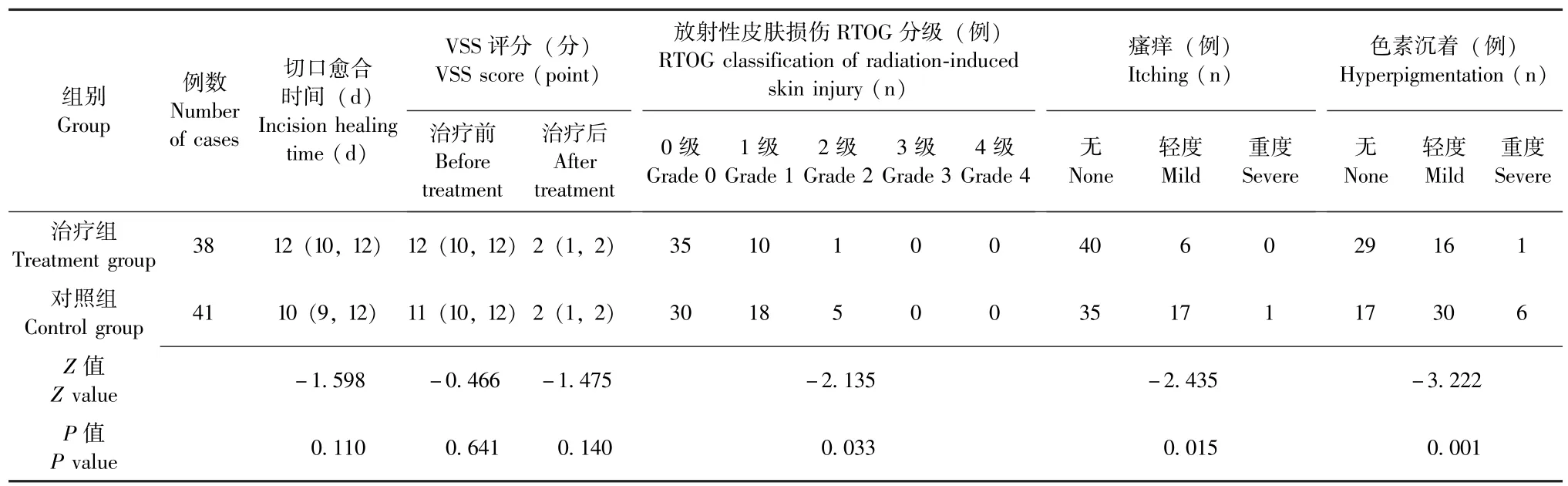
表2 两组瘢痕疙瘩患者治疗情况对比Table 2 Comparison of treatment condition of patients with keloids between the two groups
4 讨论
瘢痕疙瘩是皮肤创伤愈合后过度生长的异常瘢痕组织, 易发生于外伤或手术后, 多伴有局部不适、 瘙痒、 疼痛等症状, 若位于关节部位还可导致局部功能障碍, 严重影响患者的美观及生活质量[10]。 目前, 虽有研究证实瘢痕疙瘩是成纤维细胞的过度增殖及胶原的过度沉积, 并伴有新生血管大量形成及局部组织内炎症因子表达水平明显升高,但具体的形成机制尚不完全明确。 因此, 目前瘢痕疙瘩的治疗多以抑制成纤维细胞的增殖, 下调白细胞介素-1 (interleukin-1, IL-1)、 肿瘤坏死因子 α(tumor necrosis factor-α, TNF-α) 等炎症因子以及血小板衍生生长因子、 转化生长因子-β 等促纤维化细胞因子的表达为主[11-12]。
临床研究证实, 单纯行手术切除治疗瘢痕疙瘩的复发率可达45% ~100%[13-14], 而手术切除联合电子线、 浅层X 线或同位素等放射治疗可将复发率降至 10% ~ 23%[15-16]。 如 Laskar S 等[17]的研究显示, 放射性同位素90Sr 发生衰变释放的射线作用于真皮网状层后, 可通过降低成纤维细胞活力、 破坏细胞功能、 诱导细胞凋亡而抑制瘢痕疙瘩的形成,进而明显降低瘢痕疙瘩的复发率。 但临床研究显示, 当90Sr的使用剂量达到生物有效剂量时, 可出现皮肤红斑、 色素沉着、 伤口感染、 切口不愈、 瘙痒、 疼痛等一系列不良反应[18]。 因此, 对90Sr 同位素照射部位进行积极干预, 在有效抑制瘢痕增生的同时避免不良反应的发生尤为重要。
MEBO 是由黄连、 黄柏、 黄芩、 地龙、 罂粟壳等中草药提取物制成的软膏制剂, 具有促进创面愈合、 减轻创面炎症反应、 缓解创面疼痛等多种作用, 在烧伤、 创伤、 糖尿病足等多种急慢性创面的治疗中取得了较为显著的临床疗效。 且有研究显示, MEBO 能够有效防治放射性皮肤损伤的发生及发展[7]。 鉴于此, 本研究笔者对治疗组患者瘢痕疙瘩术后切口及照射部位采用MEBO 换药治疗, 结果显示, 治疗组患者切口愈合时间及疗程结束后瘢痕评分与对照组无明显差异, 而放射性皮肤损伤、 瘙痒及色素沉着发生情况均较对照组轻微。 可见,MEBO 内含有的脂肪酸、 维生素、 碳水化合物、 氨基酸等成分可为局部组织提供充足的营养物质, 加速上皮再生和角质层成熟, 促进皮肤生理屏障功能修复, 提高局部组织的免疫功能, 减少皮肤损伤的发生[19]; 可在皮肤表层形成一层纤维隔离膜, 从而避免衣物对局部组织的摩擦, 将局部皮肤置于生理性湿润环境内, 减少皮肤损伤的发生; 且纤维隔离膜还可隔离外界空气对创面裸露神经末梢的刺激, 降低创面瘙痒程度[20]。 另外, 创面的炎症反应可刺激表皮基底层产生色素细胞, 加重创面的色素沉着程度, 而 MEBO 可抑制 TNF-α 与 IL-1 等炎症介质的产生与释放, 减轻局部与全身炎症反应,从而防治创面因炎症反应而导致的色素沉着[21]。此外, El-Hadidy MR 等[22]的研究显示, MEBO 内含有的有效成分还可抑制成纤维细胞过度分化增殖, 防止胶原蛋白黏多糖过量合成与分泌, 促使皮肤缺损创面修复早期上皮细胞和纤维细胞即按1∶4的比例生长, 从而减少瘢痕组织形成。 但本研究治疗组与对照组患者瘢痕评分无明显差异, 可能与本研究样本量较小有关, 有待进一步研究探讨。
综上所述, MEBO 可减轻瘢痕疙瘩切除术后90Sr同位素放射治疗所致的放射性皮肤损伤及色素沉着程度, 缓解瘙痒症状, 疗效显著, 值得进一步深入研究探讨。

