辽宁省三城市社区居民子宫体癌10年生存率分析
李爽,安晓霞,李恂,张微微,潘国伟,穆慧娟
0 引言
根据世界卫生组织(WHO)国际癌症研究机构(IARC)最新发布的2020年全球癌症数据显示,子宫体癌位居全球女性癌症发病第6位,发病率达到8.7/10万[1]。1998—2007年十年间我国子宫体癌发病率年均增长速度达3.3%[2]。根据中国肿瘤登记年报显示,2016年城市女性子宫体癌中标发病率达6.85/10万[3],较2005年(5.09/10万)增长了34.6%[4]。根据国家癌症中心2018年发布的研究结果显示2003—2005和2012—2015年我国城乡女性子宫体癌的5年生存率分别为55.1%和72.8%[5],低于美国2005—2011年子宫体癌患者5年相对生存率(82%)[6]。加拿大、欧洲、日本等报道子宫体癌的10年生存率为75%~84%[7-9],国内有基于医院的10年生存率报道[10],但还未见人群队列10年相对生存率报道。本研究采用被动结合主动随访方式对2000—2002年诊断的426例子宫体癌患者进行进一步随访,首次报道辽宁省城市女性子宫体癌患者10年生存率,并分析不同诊断分期和不同治疗方式对患者长期生存率的影响。
1 资料与方法
1.1 资料来源
根据《中国肿瘤登记工作指导手册》登记数据质量的评价体系规定,主要质量评价指标包括死亡/发病比(mortality/incidence ratios,M/I)(M/I应为0.55~0.85)、病理诊断比例(proportion of morphologic verification,MV%)(MV%应为55%~95%)、仅有死亡医学证明书比例(percentage of death certificate only,DCO%)(DCO%应小于15%)[11],辽宁沈阳、本溪、鞍山市城区肿瘤登记工作始于1984年,长期以来数据质量可靠,见表1。故选取三市城区的子宫体癌抽样病例开展主动随访与被动随访相结合的调查研究。根据国际疾病分类第10版(ICD-10)国际肿瘤分类将编码为C54-55的患者纳入分析。

表1 2000—2002年辽宁省三市肿瘤登记质量评价表Table 1 Quality control index of cancer registry in three cities of Liaoning Province,2000-2002
2000—2002年三市共报告子宫体癌426例,采用分层随机抽样方法,按年龄段(≤44岁、45~54岁、55~64岁、65~74岁和≥75岁)分层,根据发病年龄构成,采用等比分配法确定每个年龄层的抽样例数,在每层中进行单层随机抽样。最终抽取319例作为调查对象,抽样比例为74.9%。对319例调查对象开展查阅病历及面访等形式的主动随访。经调查确认排除死亡补发病14例(4.4%),排除外地确诊、非本地城市户籍、非恶性肿瘤(除中枢神经系统)、非原发癌种、非2000—2002年间确诊以及重复病例(同一癌种)等病例10例(3.1%)。排除以上情况后,对295例患者开展主动随访,失访77例(26.1%),最后纳入218例(73.9%)患者进行分析。
1.2 研究方法
主动随访调查患者的基本情况、临床诊疗信息和生存状况。通过辽宁省死因监测数据库、医院病历和公安局人口信息库对患者是否死亡及死亡日期进行被动随访调查。对于上述情况未查到死亡信息的患者,进行电话或入户随访,了解其生存状态。生存期调查为首次确诊日至2012年12月31日。具体方法参考相关文献[12-13]。
采用寿命表法计算观察生存率(observed survival rate,OSR)。通过2000—2012年辽宁省三市(沈阳、鞍山、本溪)居民简略寿命表计算生存概率,应用Ederer Ⅱ方法(Ederer and Heise,1959)计算期望生存率(expected survival rate,ESR)和相对生存率(relative survival rate,RSR),即:RSR=OSR/ESR×100%。分别以2000—2002年辽宁省三市子宫体癌人群为标准人群,采用Brenner and colleagues(2004)方法计算年龄标化相对生存率(age-standardized relative survival,ASRS)。
1.3 统计学方法
采用SPSS18.0软件进行数据分析。两时点之间生存率的比较采用Z检验,相对生存率的曲线比较采用Buckley氏Pearson检验,采用Cox模型进行多因素影响分析。检验水准为α=0.05(双侧)。
2 结果
2.1 子宫体癌患者疾病特征及10年OSR和RSR水平分析
218例子宫体癌患者中,55岁以下占51.4%;Ⅰ~Ⅱ、Ⅲ和Ⅳ期病例分别占70.6%、11.0%和8.7%;手术占90.4%;病例诊断率为80.3%。
218例患者子宫体癌10年OSR和RSR分别为59.6%和67.5%。55岁以下低年龄组OSR(70.5%)和RSR(72.4%),均高于55岁及以上年龄组(48.1%和62.3%),见表2。
不同诊断分期的子宫体癌10年OSR和RSR规律一致,Ⅰ、Ⅱ期(OSR:68.8%,RSR:77.9%)>Ⅲ期(OSR:41.7%,RSR:46.1%)>Ⅳ期(OSR:10.5%,RSR:11.0%),差异均有统计学意义(均P<0.05)。
不同治疗方式的子宫体癌10年OSR和RSR存在显著差异。手术治疗的10年OSR为62.9%,是非手术治疗方式(8.3%)的7.6倍(Z=6.3,P=0.000)。手术治疗的10年RSR为71.3%,是非手术治疗(10.8%)的6.6倍(Z=5.5,P=0.000)。
不同病理分型子宫体癌10年OSR和RSR差别不大。腺癌10年OSR(57.7%)和RSR(66.7%)分别低于其他癌种OSR(66.7%,Z=1.1,P=0.271)和RSR(74.4%,Z=0.8,P=0.424),见表2。
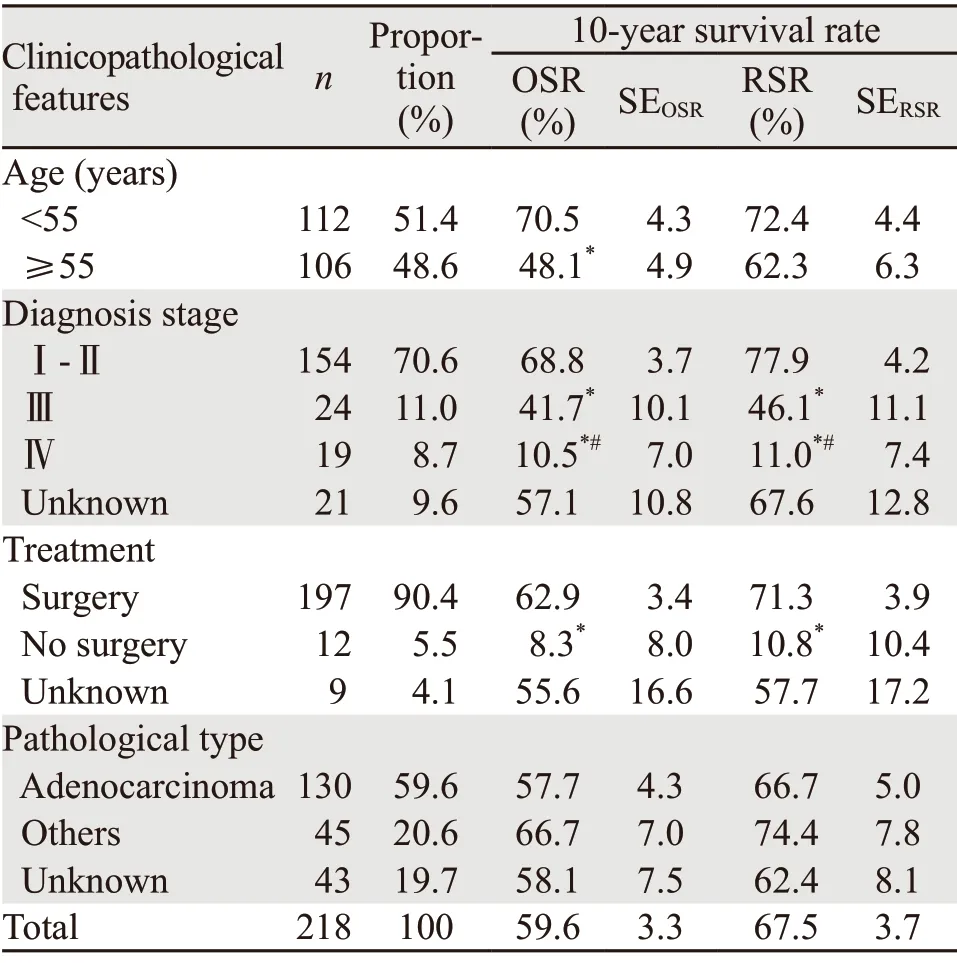
表2 辽宁省3市218例抽样子宫体癌患者临床特征及10年生存率Table 2 Clinicopathological features and 10-year survival rate of 218 uterus cancer cases in three cities of Liaoning Province
2.2 不同诊断分期子宫体癌1~10年RSR变化分析
子宫体癌1~10年RSR的范围为88.4%~67.5%,1、3、5和10年RSR分别为88.4%、75.7%、71.2%和67.5%。55岁以下年龄组1~10年RSR显著高于55岁及以上年龄段(χ2=56.5,P=0.000),见图1。
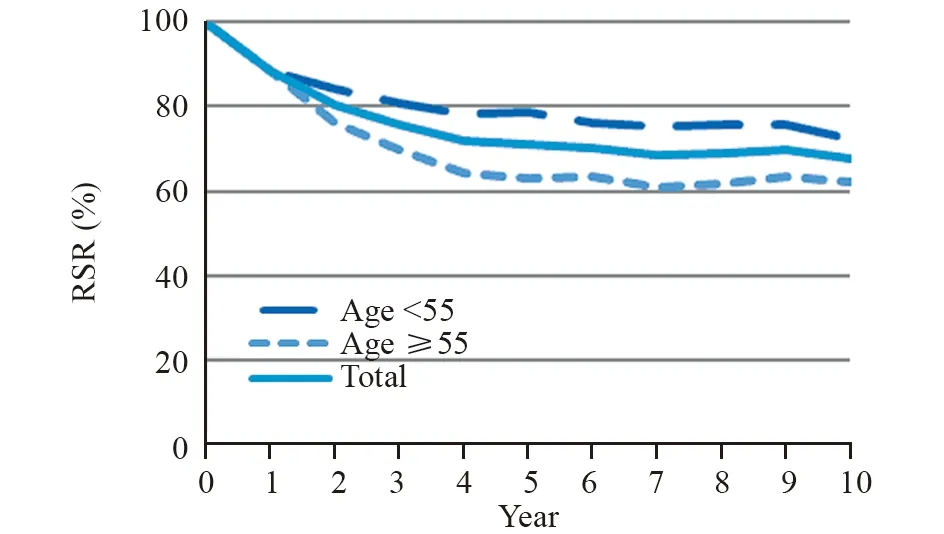
图1 不同年龄子宫体癌患者10年生存趋势Figure 1 Age-specific 10-year survival trend of corpus uteri cancer cases
Ⅰ、Ⅱ期1~10年RSR范围为95.7%~77.9%,Ⅲ期RSR范围为71.4%~44.5%,Ⅳ期RSR范围为58.4%~11.0%。各期别呈现相对生存率Ⅰ期、Ⅱ期>Ⅲ期>Ⅳ期的特征。经Pearson检验,差异有统计学意义(χ2=4.2~68.9,P=0.000~0.040),见图2。

图2 不同诊断分期子宫体癌患者10年生存趋势Figure 2 Diagnosis stage-specific 10-year survival trend of corpus uteri cancer cases
接受手术诊疗的子宫体癌患者1~10年RSR为90.2%~71.3%,而非手术治疗患者降到67.5%~9.9%,且5年以上RSR仅约10%。接受手术治疗患者的1~10年RSR显著高于非手术治疗患者(χ2=14.3,P=0.000),见图3。

图3 不同治疗方式子宫体癌患者1~10年相对生存率Figure 3 Treatment-specific 10-year survival trend of corpus uteri cancer cases
2.3 多因素Cox模型生存分析
结果表明,年龄>55岁、诊断分期晚、不能手术治疗是影响10年生存率的主要因素。55岁以上患者死亡相对风险度是55岁以下患者的2.05倍。临床诊断Ⅳ期患者死亡相对风险度是Ⅰ、Ⅱ期患者的6.57倍。非手术治疗死亡相对风险度是手术治疗的2.71倍,见表3。
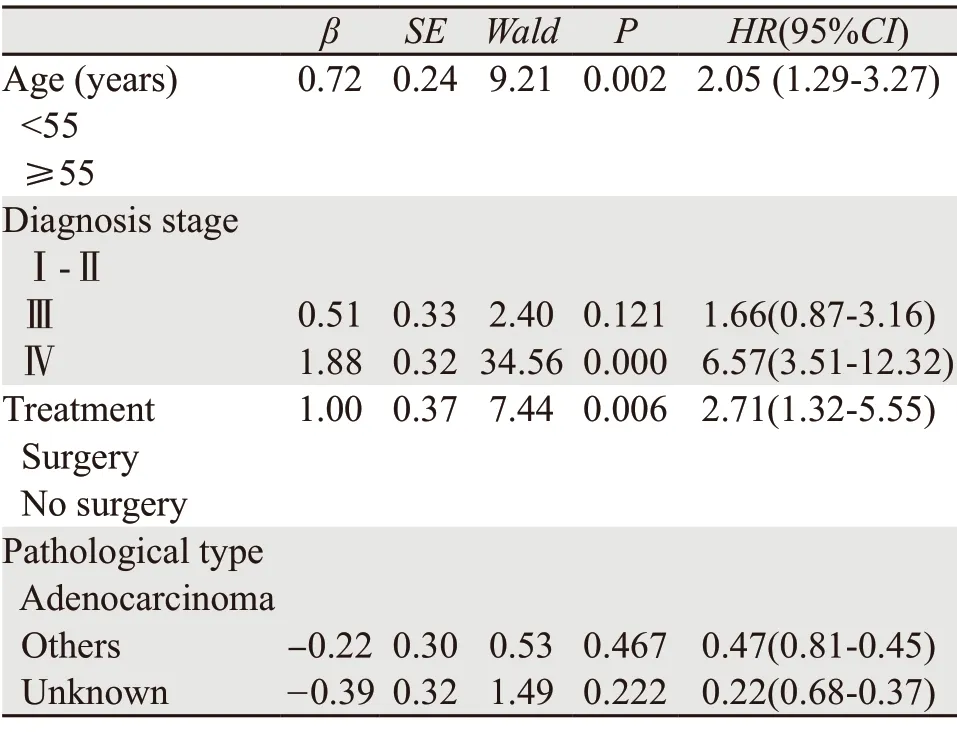
表3 2000—2002年辽宁省3市218例抽样子宫体癌患者Cox生存多因素分析Table 3 Multivariate Cox model analysis of 218 cases with corpus uteri cancer in three cities of Liaoning province,2000-2002
3 讨论
本研究结果显示,辽宁省城市社区2000—2002年子宫体癌患者10年OSR(59.6%)显著低于南通地区2000—2014基于医院的10年OSR(78.5%)[10]。由于基于医院的患者生存率是基于患病特殊人群通过被动随访的方式获得,因此与基于人群采用主动与被动随访相结合的方式得出的OSR有较大差距。有研究表明基于专科医院癌症患者的随访数据推算社区患者的生存率,将严重高估其生存水平[13]。相关研究同样指出,通过主动与被动随访相结合的方式,诊断的准确率以及随访率均有较高提升[10]。
通过基于社区人群的研究,辽宁省城市社区2000—2002年子宫体癌的1、3、5和10年RSR分别为88.4%、75.7%、71.2%和67.5%,均低于加拿大2004—2006年子宫体癌RSR(1年94%、3年88%、5年85%、10年84%)[7]。10年相对生存率与新加坡1998—2002年水平(64.7%)相近[14],低于欧洲(75.8%)[8]和日本(75.6%)[9]同期研究结果。
研究结果发现,辽宁省城市社区55岁以下年龄段的子宫体癌患者10年OSR显著高于55岁以上年龄段患者,与美国、欧洲和日本的子宫体癌患者5年RSR一致[15]。55岁以下患者Ⅰ、Ⅱ期占比较高,而且早期的临床症状和医疗管理都对生存期的延长有积极作用[16]。由于高龄(70岁以上)患者接受手术治疗可能造成的不良反应和耐受性较差等因素,往往手术治疗受到限制,从而导致较差的治疗效果和较高的死亡率[17-18]。
研究结果证实,子宫体癌相对生存率随着诊断期别的降低显著降低,但Ⅰ期和Ⅱ期无显著差异,这与欧洲研究结果一致,该研究同样指出,由于诊断水平的限制,子宫体癌的Ⅱ生存率可能被高估[19]。在子宫体癌患者已知诊疗方式中,97%患者进行手术治疗。手术治疗患者10年RSR(71.3%)是非手术患者(10.8%)的6.6倍,表明手术治疗对10年RSR的重要影响,与美国相关研究一致[20]。
本研究报道了子宫体癌的10年生存率,结果显示早期诊断和手术治疗可显著提高患者的长期生存率。子宫体癌自90年代末期以来,发病率呈上升趋势[2-4,21],目前我国开展的癌症早诊早治项目并未将子宫体癌纳入免费筛查范围,该项目筛查年龄范围为40~69岁,正是子宫体癌发病率峰值所处范围,从患者的长期生活质量以及卫生经济学角度考虑[21],子宫体癌有可能更适合开展早诊早治项目。目前,我国子宫体癌筛查及早期诊断的相关策略仍不完善,在将来经济发达地区有可能会成为严重的公共卫生问题[22],因此,应加强对子宫体癌的早发现、早治疗,规范子宫体癌筛查方案,加大子宫体癌筛查力度。
限于调查地区的经济和肿瘤登记及随访工作的开展情况等制约因素,本研究是基于辽宁省三市地区的抽样人群开展的调查与分析,而非全人群。相较于全人群的被动随访所产生的误差,通过对抽样人群开展主动随访与被动随访相结合的形式进行肿瘤生存期的调查,应答率更高,结果也更加可靠[12,23]。本研究虽然在一定程度上存在抽样偏差,但是通过年龄标化的统计学方法以及使用相对生存率等方法减少不同年龄的影响因素,结果与其他地区的结果具有可比性。以2000—2002年辽宁省三市子宫体癌人群为标准人群计算得出子宫体癌10年ASRS为67.9%,标准化后的ASRS与抽样人群的10年RSR(67.5%)基本一致,说明本次调查的结果具有较强的代表性。随着地区经济的发展以及各部门对肿瘤随访工作的持续投入,未来应尽快完善全人群、全癌种、可持续的肿瘤生存期相关研究。

