以燃烧机理为切入点设计煤的发热量测定教学实验
杨锐明, 李 辉, 王 哲
(清华大学动力工程及工程热物理国家级实验教学示范中心;热科学与动力工程教育部重点实验室;能源与动力工程系,北京100084)
0 引 言
煤的发热量作为煤质的一个重要指标,用于计算燃烧设备的理论空气量和燃烧温度,是燃烧设备选型的重要依据,燃烧设备热效率和热平衡计算的重要参数,因此燃烧学课程教学中不可避免地要进行发热量测定的教学实验,我校实验室开展此教学实验已有几十年的时间。
1 煤的发热量测定实验简介
煤的发热量测定是一项高度规范化的操作,国家标准《GB/T 213-2008煤的发热量测定方法》做出了详细规定,所使用的仪器叫做氧弹量热仪,从最开始的纯手动仪器,后来是半自动仪器,现在使用的是全自动仪器。
纯手动仪器称量样品,充氧,加水,搅拌和点火都是人工操作完成,点火热、搅拌热、冷却校正值、硫酸校正热、硝酸形成热也都要根据公式人工计算后扣除,步骤如图1中实线所示,测定一次需要2 h,由于还要测定平行样,即使实验一切顺利,也要半天时间。随着仪器自动化水平的提高,操作步骤越来越少,现在只需要称量样品、充氧、系点火丝这几个步骤,如图1中虚线所示,10几min后仪器自动得出弹筒发热量数值,大大减少了测定时间的同时也提高了测量准确性。实验过程中的大部分时间学生都在等着仪器自动打印结果,工作量减少了,但并不利于理解整个测定过程,学生反映上完实验课没有留下什么印象,没什么收获。
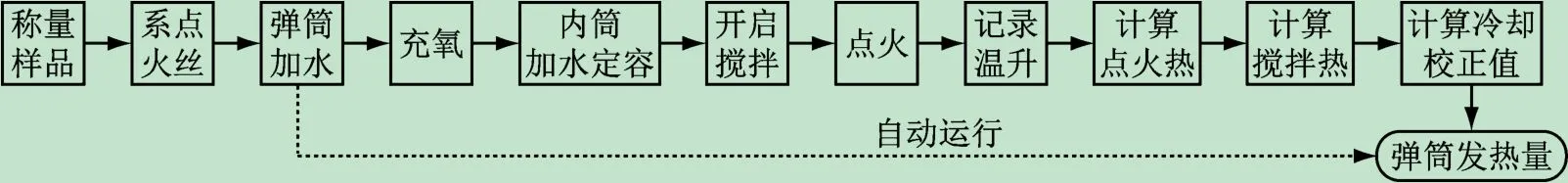
图1 氧弹量热仪手动操作与自动运行流程图
如果单纯地废弃掉自动步骤,多让学生进行手工操作作为教学思路,把自动点火换成手动点火,自动上水改为手动上水,自动计算改为人工计算,以此来“充实”实验内容,这显然是一种片面的思想。那么,如何改进教学内容,让学生深入理解发热量测定过程中存在的重要技术问题以及我国煤质分析工作者在解决这些问题时做出的努力和取得的成果,就可以作为重点实验教学内容向学生进行展示。我校是综合性研究型大学,注重学生的实践能力培养,但更注重研究现象背后的机理。基于此,进行了一些有益的探索。尝试从煤在氧化性气氛下燃烧以后,硫氧化物和氮氧化物的生成机理以及它们最终生成硫酸和硝酸带来的热效应的计算作为切入点设计实验教学内容,使学生更深入地理解氧弹量热仪的工作原理,推导出仪器测定的弹筒发热量与高位发热量的关系,弹筒发热量与酸校正的关系,酸校正经验公式与燃烧过程之间的关系,以及为什么需要进行冷却校正。由于对煤燃烧机理的深入探讨,学生在煤发热量测定与分析时更加得心应手,学习兴趣更浓厚,实验效果也大大提高。
2 氧弹量热仪的工作原理
氧弹量热仪是将一定质量的煤样置于高压不锈钢弹筒中,充入约3 MPa的纯氧,使煤样在纯氧中完全燃烧,对释放出的热量进行测量,得到单位质量煤样的发热量,即弹筒发热量。
但测定热量是不容易的,而测量温度就容易得多,因此,是将煤样置于一个称为内筒的水桶中,内装一定质量的水,燃烧释放的热量传导到水中,通过测量水的温升经过计算得到煤样的发热量。而内筒置于一个装有大量水并精确恒温的外筒中,这种仪器称为恒温式量热仪,其结构如图2所示。这种仪器结构简单,但需要考虑内筒向外筒的散热,需要进行冷却校正。另一种类型的仪器是在外筒中增加了加热器,它能够跟踪内筒水的温升,及时加热外筒中的水,使内外桶之间没有温差,也就没有散热,也就不需要冷却校正,这种仪器称为绝热式量热仪,其结构比较复杂,加热装置的温度跟踪效果不好,测量准确性比恒温式仪器差。现在的商品仪器以恒温式为主。
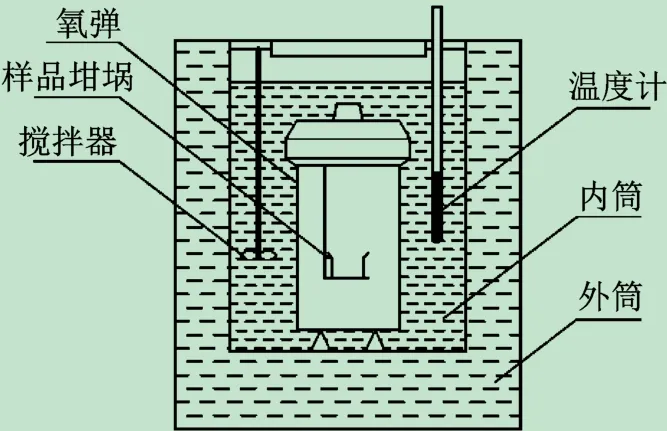
图2 氧弹量热仪结构简图
由此可知,仪器设计中要考虑的一个核心问题是减少内外桶之间的传热。通常仪器的热容量为13 000 J/℃,氧弹容积300 mL,内外桶间距10 mm,外筒高于内筒3℃且温度控制在±0.002℃,采取以上措施后,仪器的散热基本上是内外桶温差的函数[1],通过温度测量就能计算散热量。
3 煤发热量测定的技术关键与实验操作
3.1 高位发热量计算中的酸校正
用氧弹量热仪测得的发热量为弹筒发热量,它是能得到的最大的发热量数值,也是唯一完全通过测定得到的发热量数值。由于在测定过程中,平行测定样品的质量、主期终点温度、硝酸和硫酸的生成量等参数均不同,因此,以弹筒发热量报结果是不妥当的,应以两次高位发热量的测定平均值报结果[2]。弹筒发热量减去硫酸校正热和硝酸形成热后就是高位发热量。国标GB/T 213—2008中高位发热量计算式为:

式中:94.1Sb为硫酸校正热,是以SO2为起点,生成H2SO4并溶于水后为终点产生的反应热;αQb为硝酸形成热,是以元素氮为起点,生成HNO3为终点产生的反应热[3]。
(1)硫酸校正热。煤中的硫有多种形态,其中可燃硫主要为存在于黄铁矿中的FeS2和均匀分布的有机硫,它们在氧弹中的燃烧过程处于绝对的氧化性气氛下,燃烧温度高,生成H2S较少,主要氧化成SO2[4-5],随后被氧化为SO3,并溶于水形成H2SO4,反应路径为:

但根据反应机理,在没有催化剂的情况下,SO2氧化为SO3是比较困难的,弹筒中的SO2在相当于铅室法硫酸制造工艺的条件下,被共存的氮氧化物的交替氧化、还原催化作用氧化为SO3[3],过量空气越多,火焰温度越高,SO3生成量越多[6]。
由于SO2直接生成SO3的难度远大于在有水存在的情况下生成H2SO3[7],而弹筒内预先加入了10 mL水,SO2极易溶于水生成H2SO3(严格讲为二氧化硫水合物SO2·nH2O),H2SO3解离出HSO3-和SO32-,它们极易被水溶液中的溶解氧氧化为SO42-,形成硫酸水溶液,对硫酸校正热有贡献。此即相当于火电厂湿法脱硫的强制氧化工艺,通过向浆液中鼓风,以确保氧绝对过量,从而将亚硫酸钙强制氧化为硫酸钙(石膏)。实验室测定水溶液中的SO32-时要提前加入稳定剂甲醛溶液,否则,SO32-很快会被氧化为SO42-[8]。常温常压下水中的溶解氧即可导致反应的发生,根据亨利定律,在一定范围内,气体在溶液中的溶解度和液面上该气体的分压成正比,弹筒内纯氧压力为3 MPa,水中的溶解氧含量大大增加,促进了氧化过程的进行。此反应路径为:

式(2)反应路径与式(3)反应路径的反应热不同且比例不能准确计算,因此硫酸校正热的计算需要通过经验公式。
GB/T 213—2008规定,在Sb<4%或Qb,ad>14.60 MJ/kg时可以使用全硫代替弹筒硫计算硫酸校正热。对于不同的硫含量,根据硫在煤中的赋存形态和燃烧机理,高硫煤中的硫一般为无机硫,即FeS2和硫酸盐[9],其中只有FeS2参与了弹筒燃烧反应,对硫酸校正热有贡献,而硫酸盐硫可能未及全部分解为SO2,而只是以硫酸根形态由于燃烧飞溅从灰分中进入弹筒洗液,对硫酸校正热无影响,因此应采用弹筒硫而不是全硫。而低硫煤中主要为有机硫,几乎全部氧化为SO2,对硫酸形成热有贡献,因此可采用全硫进行计算,免去了测定弹筒硫的繁琐操作。对于不同的发热量,罗颖都[10]认为,“低热值高硫煤在氧弹中燃烧时,硫并未全部转化为SO3和H2SO4,约有20%以上只转化为SO2”,从弹筒排气排掉了,“而高热值煤的弹筒排气中不含SO2”,即低热值高硫煤中的硫至多只有80%的硫转化为了H2SO4,只能用弹筒硫校正,而高热值煤中的硫几乎都转化为了H2SO4,则可以用全硫替代。张力等[11]的实验测定也表明,对于应该使用弹筒硫的高硫煤,如果使用了全硫,会造成较大的误差。学生在实验中更愿意使用现成的全硫数据而不愿意滴定测定弹筒硫,通过对其背后硫氧化物和氮氧化物的燃烧生成机理的解释,可以更好地应用这两个判据。
(2)硝酸形成热。硝酸形成热的计算使用的也是经验公式,其校正系数α的确定同样和燃烧机理密切相关。罗颖都[3]使用不含氮和硫的苯甲酸在弹筒内燃烧,证实生成了酸,显然是硝酸,氮来自于充氧前弹筒内留存的空气;且硝酸的生成热和苯甲酸的释热量存在正相关关系。当苯甲酸的量增加时,燃烧温度增加,NO的生成量增加,则认为其发生的反应为:

3步反应中第1步反应最困难,其只和温度有关[12]。国家煤检中心用不同的煤种进行的实验表明,硝酸形成热和煤种无关,只和氧弹内的总释热量有关[13],并由此得出了硝酸形成热的校正系数α,其取值为0.001 0(Qb<16.70 MJ/kg时),0.001 2(16.70 MJ/kg<Qb<25.10 MJ/kg时),0.001 6(Qb>25.10 MJ/kg时)。
此国标主要应用于煤和焦炭,煤燃烧生成氮氧化物(NOx)的机理很复杂,主流观点认为有3个来源,热力型NOx中的氮来自于空气,是吸热反应,高温有利于提高NO的产率;燃料型NOx中的氮来自于煤中以胺簇形式存在的氮,通过NH3→NH2→NH→NO等一系列中间过程生成,外界影响因素主要是氧量和温度[4],快速型NOx是空气中的氮和燃料中的碳氢基团反应,不含氮的碳氢燃料在较低温度时遵从这个机理。
由燃烧苯甲酸得出α的过程倾向于“热力型”机理,氮氧化物中的氮来源于空气,但并不能由此即断定燃烧煤粉时产生的氮氧化物也是来源于空气中的氮,现在的主流观点认为煤燃烧产生的NOx中3种类型都有[6],其中90%是“燃料型”的[9],即煤中的C-N键因为键能远远小于空气中氮气分子的氮氮三键(N≡N),因而更容易被破坏,其中一部分氮生成NO,另有一部分转化为NH3,并最终转化为N2。由此机理,硝酸生成热的决定因素为煤中氮的含量、燃烧温度、富氧条件等,煤粉在氧弹中燃烧过程中的NOx生成为多种机理共同作用,其比例不可确知,因此使用经验公式进行简化计算是必要的。由于我国的煤中氮元素含量一般较低,均值为0.98%[14],使用热力型机理解释实验结果也能自圆其说,但是,当煤样进行过特殊处理而导致氮元素含量显著增大时,则需使用另外的经验公式进行计算[2],这从侧面证实了“燃料型”机理在NOx生成中占比很大。
3.2 冷却校正
各国的科研工作者提出了多个冷却校正公式,其中公认瑞方(Regnault-Pfaundler)公式是最准确的[15],但其测定过程和计算方法也是最繁琐的,为此,各国学者都开发了近似公式用于简化计算,其中奔特(Bunte)公式计算结果稍高,但计算特别简单,曾在我国电力系统长期应用[16]。煤炭科学研究总院的煤研Ⅰ式在准确度上极为接近瑞方公式,但计算方法却大大简化,逐渐替代了奔特公式,其后,提出了更为准确的罗-李公式并替代了煤研Ⅰ式,用于GB/T 213—1987及以后的版本[17],以上工作是我国煤炭科学工作者的很大贡献,在实验教学中要给与充分说明,使学生知晓。随着自动量热仪的普及,多次读取温度和复杂的计算已经不再是问题,《JJG 672—2001氧弹热量计检定规程》规定使用瑞方公式,GB/T 213—2008推荐自动量热仪使用瑞方公式。
3.3 实验操作
为了加深对酸校正的理解,实验使用的是需要用弹筒硫进行酸校正的煤样。学生拿到的样品并不标明硫含量,此时学生应该先测定弹筒发热量,收集弹筒洗液进行滴定,并进行平行测定。得到硫含量并结合弹筒发热量数值,判断样品适用弹筒硫还是全硫,计算出硫酸校正热和硝酸形成热,然后计算出高位发热量,判定平行误差小于重复性限后以平均值作为实验结果。实验全程约需1.5~2 h,时长比较合理。
4 结 语
科学技术在进步,即使是基础教学实验,其内容和形式也不是一成不变的,本教学实验方案设计取得的效果有如下几点:①煤的燃烧机理的研究这些年有了很大的进展,本实验以最新的燃烧机理为切入点,深入分析自动测定背后的关键技术问题,对理解燃烧学课程教学内容起到了促进作用,激发了学生的学习热情。②我国的煤质分析工作在世界上处于领先地位,是建立在我国煤炭分析工作者多年的理论研究和实验验证工作基础上的,教学实验中通过讲述这些内容,把这种严谨求实的科学精神传达给学生。③通过这样的实验课程设计,实验内容讲解和实验操作的占比合理,实验时长适宜,实验效果良好。

