EB病毒编码的BARF1对GES-1细胞的影响
杨佳宁,李 娜,董鸿铭,徐 媛,李淑英
胃癌(Gastric cancer,GC),是严重危害人类健康的恶性肿瘤[1]。据有关报道表明,每年大致出现100万左右的GC新发病例,GC通常表现出全球发病率高、存活率低的特点[2],其发生发展过程较为复杂,受到多重因素的影响,可涉及表观遗传学改变、EBV感染、幽门螺旋杆菌感染、年龄、生活方式不健康、食用腌制品、烤鱼、烤肉、水果食用量低以及吸烟等诸多方面[2-5]。EBV被认为是人类世界最早被发现的致癌病毒[6],存在归属于疱疹病毒家族的γ病毒亚群,全世界约超过95%的人表现为潜伏感染[7],并且该病毒以双链DNA形式存在[8],一旦发生感染,就会存在于人类整个生命过程中,是与人类多种恶性肿瘤发生密切相关的一种病原体[8]。据相关研究所述,EBV目前被认为是诱发人类癌症的一级危险物[6],在全世界有10%左右的GC患者会同时检测到感染了EBV[6,9]。EBV相关胃癌(Epstein-Barr virus-associated gastric carcinoma,EBVaGC)[10]如今已被归属为EBV相关恶性肿瘤中最常见的一种疾病类型[7,11]。胃环境呈现明显酸性,包膜病毒表现为不耐酸的特征,迄今为止EBV如何感染并引起胃癌还没有明确的解释[12]。已报道的EBV感染胃上皮细胞的可能诱因包括以下两个方面:首先可能由于胃炎发生过程中存在潜伏感染EBV的B淋巴细胞[13],并通过上皮细胞分泌的囊泡得以激活[14];其次可能由于持续摄入带有EBV的唾液,使EBV可以在恶劣的酸性环境下复制并使胃上皮细胞癌变[15]。研究表明,在EBV基因组中有多种与癌症发生存在关联的基因,除了公认的EB病毒核抗原1(EBNA1)、潜伏膜蛋白1(LMP1)和潜伏膜蛋白2(LMP2)之外,还包括BARF1基因[16]。BARF1(Bam HI-A rightward frame 1)基因存在于EBV基因组Bam HⅠA最右侧开放读码框[17],主要表达在EBV裂解早期,它如今被认为是可诱导多种不同的上皮细胞发生恶性损伤的基因之一,推动上皮细胞持续性增殖及异常转化的进程,促使恶性肿瘤生长,起到阻断细胞凋亡的作用,并以潜在的方式促进EBV相关肿瘤的发生发展[16,18-19]。即使已经进行了多项研究,但对于EBVaGC的发病机制依旧不很明朗[4,7-8,20]。本文在体外构建了可稳定表达外源pIRES-EGFP/BARF1基因的人胃上皮细胞模型,探讨外源基因BARF1的表达在人胃上皮细胞增殖、迁移及细胞周期分布。
1 材料与方法
1.1 材料 p IRES-EGFP/BARF1重组质粒、GES-1(人胃上皮细胞)、PBS缓冲液、PI工作液、RNA提取、逆转录PCR及IHC染色相关试剂由本室保存;Lipofectamine 2000为美国Invitrogen公司产品;双抗、胎牛血清、胰酶(0.25%,含EDTA)为美国Hy-Clone公司产品;新霉素类似物(G418)为中国北京Solarbio公司产品;培养板(6、24、48、96孔)为美国康宁公司产品;CCK8试剂盒为中国上海Beyotime公司产品;DMEM高糖及RPMI 1640基础培养基分别为中国北京Biosharp和美国Gibco产品。
1.2 方 法
1.2.1 细胞培养 GES-1细胞(人胃上皮细胞)从冰箱(-80℃)取出后迅速放入恒温水浴箱(37℃)中融化,离心并吸除冻存液,加入一定体积的完全培养基(10%FBS,1%双抗的RPMI 1640培养基)制成均匀分布的细胞悬液,将细胞悬液加入培养瓶轻轻摇匀,放到无菌、加湿、恒温培养箱(37℃,5%CO2)中进行常规培养,平均每1~3 d更换1次培养基;当细胞密度适宜(90%以上),用胰酶(0.25%,含EDTA)消化细胞,若镜下细胞变圆,吸除消化液,加一定体积的完全培养基,使细胞分布均匀并无细胞聚集成团,转种至24孔板,过夜培养。
1.2.2 细胞转染 上述细胞生长至转染所需密度(约50%~70%),去除废培养液,用PBS缓慢清洗细胞至背景洁净,弃PBS,加入一定体积(0.25 m L)不含FBS和抗生素的高糖DMEM;按照脂质体转染试剂(Lipofectamine 2000)说明书并结合自身细胞情况调整各物质加入量后实施细胞转染,将3组细胞(即转染pIRES-EGFP/BARF1组、p IRES-EGFP空载体组及未转染组)做上标记,轻轻摇晃24孔板,使质粒/脂质体混合液于各孔中均匀分布,常规培养;6 h后补充高糖DMEM(含20%血清)培养基0.25 m L,相同环境下继续培养;转染24 h后,再补充0.35 m L普通完全培养基(10%FBS,1%双抗的高糖DMEM培养基),继续培养;转染48 h后将培养板密封放到荧光倒置显微镜(Nikon ECLIPSE Ti-U)下进行细胞转染情况的观察。
1.2.3 确定G418筛选浓度 在24孔板中选10个孔加入等量的GES-1细胞,常规培养细胞至70%~80%汇合度时,将细胞培养液更换为含不同浓度梯度G418的RPMI 1640培养基(G418浓度分别为0.1,0.3,0.5,0.8,1.0μg/μL),将对应孔做好标记,观察2周内细胞生长及死亡情况,筛选出最适宜的G418筛选浓度。
1.2.4 G418抗性单细胞克隆筛选 当转染后的细胞密度适宜(约70%~80%)时,将细胞培养基更换为上述筛选培养基,进行细胞筛选,每3~5 d更换1次培养液,直至筛选出抗性单克隆,挑出单克隆根据细胞汇合度陆续转至96孔板、48孔板扩大培养。
1.2.5 RT PCR鉴 定
1.2.5.1 提取细胞RNA 收集3组细胞(生长状态优良、数量适宜)并用PBS洗涤、重悬,低速离心(1 000 r/m,3~5 min),弃上清;用无菌镊子夹取1.5 m L无 酶EP管(需 经0.1%DEPC水 处 理 并 湿热灭菌),加入1 m L Trizol Rengen,来回吹打细胞,使得细胞得到充分裂解从而释放出RNA;用镊子小心盖好EP管盖,倒置、翻转混匀,静置(室温,5 min);加入氯仿(0.2 m L),用力颠倒混匀,静置(室温,5 min);4℃,12 000 r/m离心10 min;将水相单独吸出(体积小于750μL),与异丙醇按比例(1∶1)混合均匀而后静置;再次相同条件离心15 min,弃上清;加1 m L冰乙醇(用无菌DEPC水将无水乙醇稀释至浓度为75%)洗涤沉淀及管壁,再次相同条件离心10 min,吸出上清,室温干燥,未完全干燥时在含有RNA产物的EP管中加入一定体积(60μL)的无菌DEPC水,将RNA产物进行电泳检测,放到冰箱(-80℃)保存备用。
1.2.5.2 逆转录PCR(RT-PCR) 待上述提取的RNA验证无误后,进行逆转录反应。该反应为20 μL反应体系:先加入9μL RNase free H2O(无核酸酶水),再取3μL RNA提取产物作为模板,1μL d NTP Mix,1μL Oligo(d T)18primer,在PCR反应仪上70℃孵育5 min,取出后放到冰上。在上述反应管中加入4μL 5×first-strand buffer缓冲液,1 μL M-Mu LV TUREscript H-RTase(逆转录酶),1 μL RNase inhibitor,42℃反应50 min,65℃反应15 min,以获取cDNA。
1.2.5.3 BARF1的PCR检测 该反应为20μL反应体系(需冰上操作):10μL 2×M5 HiPer plus Taq HiFi PCR Mix,上下游检测引物各0.5μL(10 μM),加入不足1μg的cDNA模板,补足dd H2O至反应体系达到20μL。反应条件为:1个循环:95℃5 min(预变性);35个循环:94℃30 s,55℃30 s,72℃30 s;1个循环:72℃5 min;4℃保持;PCR产物在不含Gold View(核酸染料)的1%琼脂糖凝胶电泳,并用成像仪观察和分析电泳图。
1.3 BARF1基因表达效果分析
1.3.1 细胞增殖活力分析
1.3.1.1 细胞计数法 在各组细胞几乎覆盖到整个培养板时,收集3组细胞,取几乎相同数量的细胞接种到24孔板(本实验每孔加入300μL细胞悬液,约900个细胞),每组接种6个平行孔;每次分别收集3组细胞,并将细胞均匀、无聚集地分布于培养基中,吸取细胞悬液(10 μL),采用改良的牛鲍式(Neubauer)计数板计数培养0~6 d各组细胞数量,计算出3次计数结果的平均值以及标准差。应用Microsoft Excel工作表来绘制各组细胞的生长曲线,横坐标选用培养时间(Time,以“d”为单位),纵坐标选用细胞数量(×103个/m L)。
1.3.1.2 CCK8法 将3组细胞(处于对数生长期)接种到96孔板(100μL细胞悬液,约300个细胞),分别设立6个平行复孔,按不同分组标记清晰;设置只加CCK8溶液和RPMI 1640培养基的空白对照组;常规培养,根据细胞自身状态和培养基情况适当调整更换培养基的频率(约1~3 d);分别将各个分组中的细胞培养0~6 d后,每天在相同时间点将细胞培养板取出并滴加少量CCK-8溶液(10μL),培养1 h,用酶标仪测定并记录450 nm处的吸光度值(A450)。利用Microsoft Excel工作表来制作细胞的生长曲线,其中,横坐标选用培养时间(Time,以“d”为单位),纵坐标选用吸光度(OD值)。
1.3.2 细胞迁移能力分析 细胞划痕实验:将一定量的细胞悬液(约5×105个细胞)加入到培养板(24孔),培养24 h,次日选取适当的观察点,做好标记,用0.2 m L无菌枪头比着直尺划线,缓慢加PBS将细胞背景洗净,加入低血清培养基(含1%FBS)常规培养,分别于划线后0、24、48 h取相同位置拍照。使用图像处理软件(Image Pro Plus 6.0)进行灰度、对比度等指数的调整,获得迁移面积与高度的值,计算3次实验所得细胞迁移距离的平均值和标准差。根据所得数据用Microsoft Excel工作表制作柱形图,以培养时间作为横坐标(Times,以“h”为单位),纵坐标为迁移率(用小数表示)。
1.3.3 细胞周期检测 流式细胞术:收集3组细胞,用预冷的PBS溶液洗涤并调整细胞悬液至所需浓度(1×106个/m L);缓慢加入乙醇溶液(调整终浓度至70%),4℃过夜处理;第2 d,离心(2 000 g/min)并将上清液吸出,加入预冷PBS并离心以洗除固定液,按照一定比例(9∶1)配制PI工作液与RNase A的混合液(二者混合后总体积为500μL),黑暗、无光环境中处理(4℃,30 min),将细胞充分混合均匀并进行过滤(300目尼龙),采用流式细胞仪对细胞周期的分布情况进行上机检测。
1.3.4 细胞周期蛋白Cyclin D1表达情况的评估IHC染色法:收集3组细胞(生长状态良好、数量适宜),加入一定体积的完全培养基使细胞沉淀呈现均匀分布的单个悬浮状态,并按照实验需要对细胞浓度进行调整(约1×104个细胞/m L)。将无菌盖玻片固定6孔板底,将3组细胞分别接种于各孔,使细胞覆盖盖玻片,终止培养;用PBS清洗(2~3次);4℃环境下,用4%多聚甲醛(Paraformaldehyde Fix Solution,PFA)处理20 min;用过氧化氢(H2O2,3%)处理5 min;加入一定体积的Triton X-100(0.2%,或者吐温20)通透剂处理20 min;加入BSA(牛血清白蛋白,5%)封闭20 min;分别加入鼠源性一抗和 阴性对照(PBS),在4℃环境下,于湿盒中过夜孵育;次日,将盖玻片从4℃拿到室温环境下平衡20 min;加入试剂1(山羊抗鼠IgG抗体—HRP多聚体1),孵育(25℃,2 h);再加入试剂2(山羊抗鼠IgG抗体—HRP多聚体2),室温孵育20 min;滴加DAB显色液,室温暗处理10 min(以上各步骤之间需用PBS或PBST洗涤并根据实际情况调整洗涤时间和次数);自来水缓水流冲洗,苏木素复染细胞核,用体积分数70%、80%、80%、90%、95%、100%的乙醇脱水;二甲苯处理2×1 min,封片,镜下观察。
1.4 统计分析 应用SPSS 25.0软件进行数据统计分析,组间比较采用独立样本t检验,检验水准α=0.05。
2 结 果
2.1 GES-1细胞质粒转染效果分析 转染后第3 d,应用Nikon ECLIPSE Ti-U荧光倒置显微镜观察稳定转染BARF1组及稳定转染空载体组GES-1的转染效果,并以未转染组作为空白对照,结果显示稳定转染BARF1组和空载体组GES-1细胞都存在绿色荧光,如图1所示。
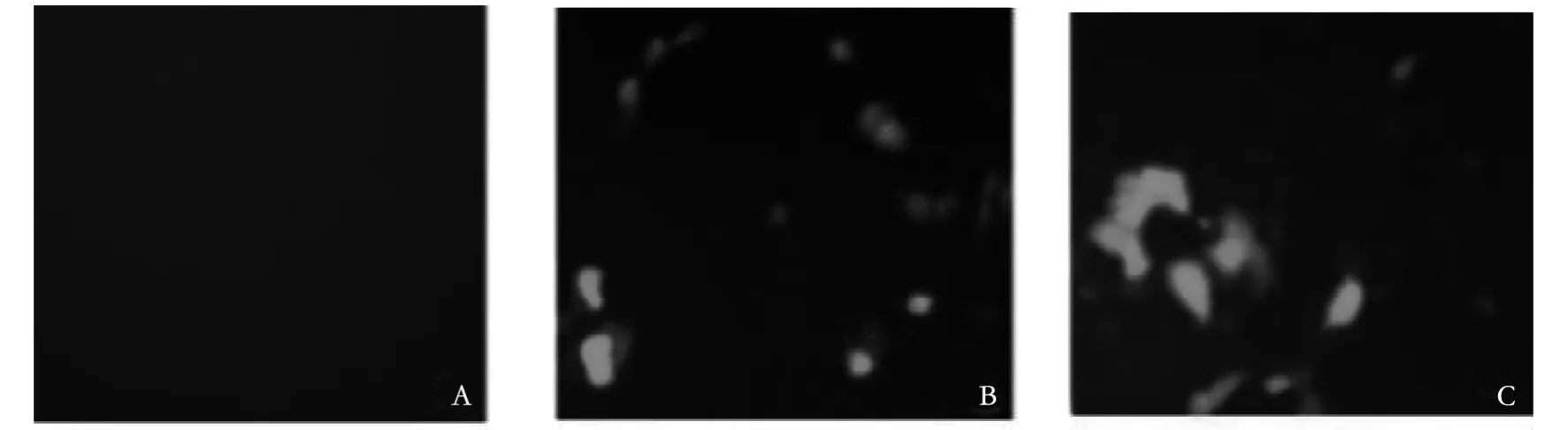
图1 荧光显微镜观察转染后第3 d各组细胞绿色荧光蛋白表达情况(200×)Fig.1 Fluorescence microscope to observe the expression of green fluorescent protein in each group on the third day after transfection(200×)
2.2 G418耐药性单克隆细胞的获得 通过建立不同浓度梯度的G418选择性培养基确定合适的筛选浓度。用筛选培养基(300μg/m L G418,10%血清的RPMI 1640培养基)大约筛选2周后,转染BARF1组及转染空载体组中可稳定表达外源基因的细胞得以存活,从而获得可耐受G418的阳性单细胞克隆,每种转染细胞分别挑出3个单克隆陆续转移至96孔板和48孔板扩大培养,获得大量可稳定表达外源基因(空载体和重组质粒)的GES-1细胞。
2.3 BARF1基因表达情况的鉴定 从上述获得的耐G418单克隆细胞(包括稳定转染BARF1组及稳定转染空载体组GES-1细胞)中提取RNA,经逆转录,并将其产物作为模板进行PCR扩增,获得的产物大小为524 bp。分别以B95-8 cDNA和GES-1的c DNA PCR产物作为阳性和阴性对照,结果如图2所示。
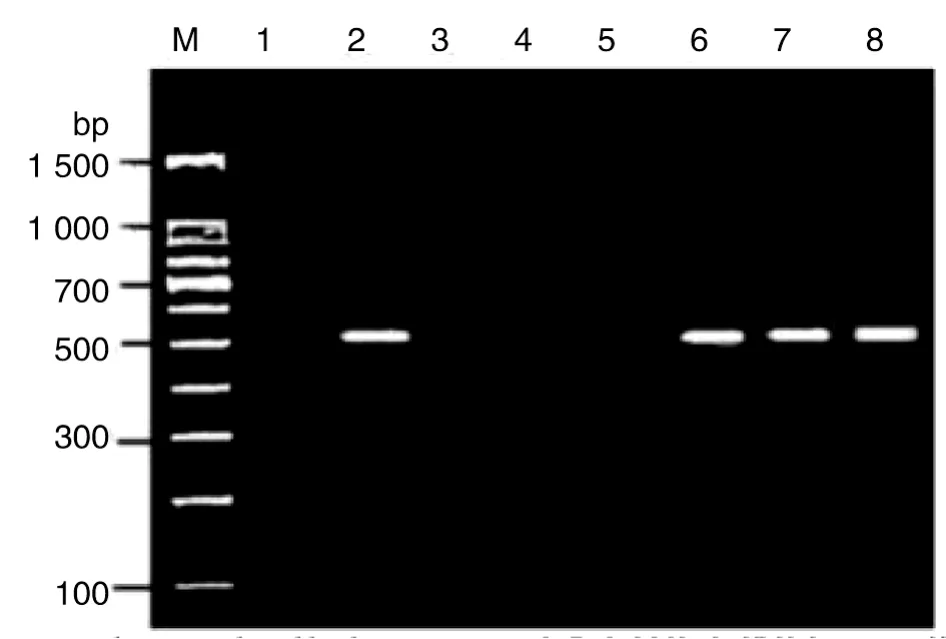
图2 RT-PCR鉴定转染各组细胞中BARF1的表达Fig.2 Expression of BARF1 in transfected cells was identified by RT-PCR
2.4 细胞增殖能力测定
2.4.1 细胞计数法 通过细胞计数评估对GES-1细胞增殖能力的影响,结果显示外源基因BARF1与空载体组和未转染组相对比,稳定转染BARF1组GES-1细胞增殖能力显著提高,结果如图3所示。
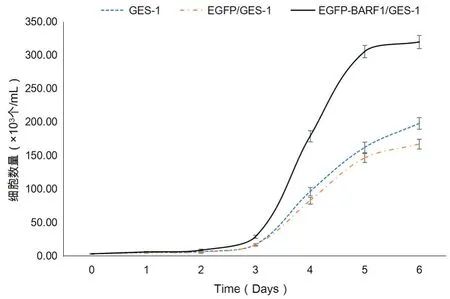
图3 细胞计数法测定各组细胞增殖能力Fig.3 Cell proliferation ability of each group was determined by cell counting method
2.4.2 CCK8法 为进一步验证BARF1基因是否对细胞增殖能力产生正向促进作用,采用CCK8法对各组细胞进行处理并用酶标仪进行检测分析;根据各组细胞经处理后所得到的450 nm处的吸光度值,作出如下图所示的生长曲线(图4),经过分析可知,CCK8法与细胞计数法所得到的结果相呼应,即稳定转染BARF1组的GES-1细胞增殖能力要明显高于空载组和未转染组。
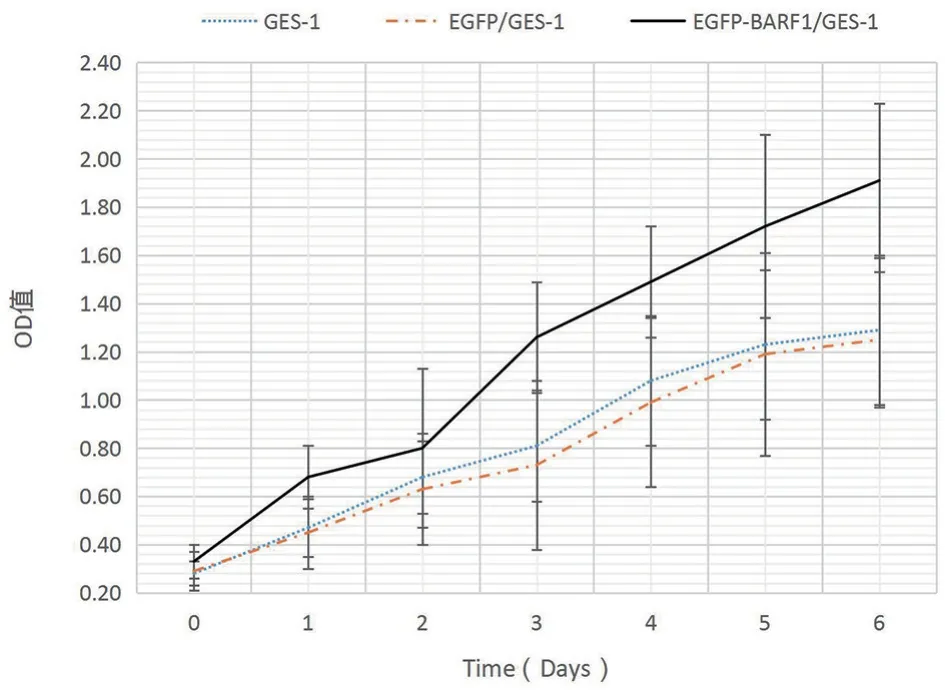
图4 CCK8法检测细胞增殖能力Fig.4 Ability of cell proliferation was detected by CCK8 method
2.5 IHC法检测细胞周期蛋白Cyclin D1的表达状况 显微镜下观察3组细胞IHC法染色结果发现:未转染组、稳定转染空载体组染色结果均为阴性,经苏木素复染后呈现蓝色,未检测到Cyclin D1的表达;而稳定转染BARF1组细胞核中呈现明显的棕褐色,结果显示为阳性,表明转染BARF1后人胃上皮细胞GES-1中Cyclin D1表达,结果如图5所示。
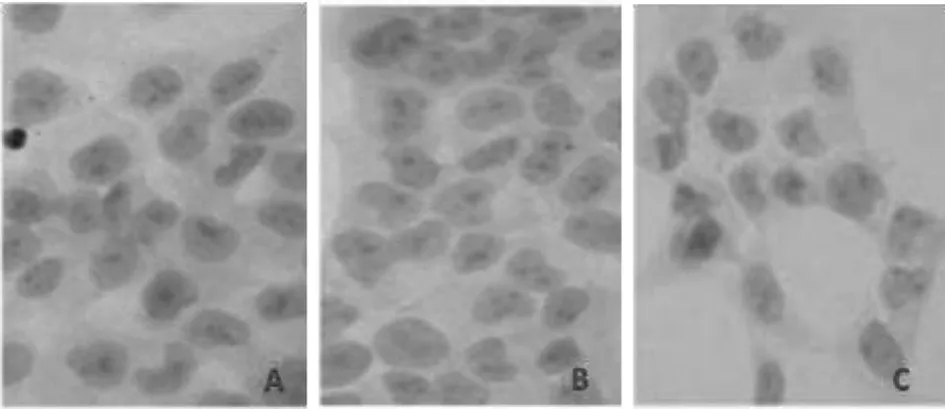
图5 IHC法细胞周期蛋白Cyclin D1的检测(400×)Fig.5 Cyclin D1 was detected by IHC method(400×)
2.6 划痕实验评估各组细胞划痕愈合能力 评估及观测各组细胞迁移能力的差异,结果显示,稳定转染BARF1组GES-1细胞、稳定转染空载体组GES-1细胞的24 h划痕愈合率分别为(0.38±0.04)和(0.26±0.02),48 h迁移效率分别为(0.70±0.02)和(0.58±0.02),经统计 学分析可 知,稳 定转染BARF1组GES-1细胞迁移效率高于空载体组,结果如图6所示。

图6 各组细胞迁移能力检测(100×)Fig.6 Detection of cell migration ability in each group(100×)
2.7 流式细胞术检测细胞周期分布情况 为探讨BARF1表达与细胞周期分布情况是否存在明显相关性,采用流式细胞仪对各组细胞周期分布情况进行检测。结果显示,未转染组GES-1细胞各分期所占比例分别为G1期61.98%、G2期13.87%及S期24.15%;稳定转染空载体组GES-1细胞G1期、G2期及S期 所 占 比 例 分 别 为68.59%、6.89%、24.52%;而可稳定表达外源基因BARF1组的GES-1细 胞 周 期分 布 为:G1期55.68%、G2期6.22%,S期38.10%;以上研究结果表明,与空载体组和未转染组相比,稳定转染BARF1组细胞S期明显延长。结果如图7所示。
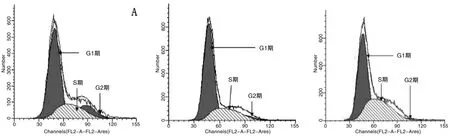
图7 流式细胞术检测细胞周期分布Fig.7 Cell cycle distribution was detected by flow cytometry
3 讨 论
胃癌是多种因素共同作用引发的消化系统恶性肿瘤,众所周知,在我国常见的几种恶性肿瘤中GC表现出发病率高、预后差、存活率低等特点,被认为是对人体造成严重威胁的恶性肿瘤之一[21];EBV也称人疱疹病毒4型(Human Herpesvirus 4,H HV4),在人群中多数是以潜伏感染的方式威胁着人们的健康[6]。据有关报道指出,这种“致癌病毒”正在以一种不为人知的方式推动着胃癌的发生和发展[18];BARF1存在于右侧EBV基因组的Bam HIA转录框架中,所编码的蛋白大小约是31-33 k Da,通过自分泌/旁分泌的方式刺激细胞周期的启动,并促进不同上皮细胞发生恶性改变[22],可能对EBVaGC的出现和发展有关键的促进作用。即使人们已经把关注的焦点逐渐投向了BARF1刺激GC发生上,但其究竟如何诱导GC发生发展仍然需要更详细的解释,其中所涉及的诱导机制仍然需要大量的实验加以考证[23]。GES-1细胞系是胎儿胃粘膜细胞永生化后获得的细胞系,拥有可以在体外进行稳定转化和传代的良好特性,本文通过体外构建稳定表达BARF1基因的GES-1细胞模型,探讨了BARF1基因对胃上皮细胞GES-1的影响。
本文通过细胞计数和CCK8法验证BARF1对GES-1细胞增殖能力的影响,结果显示,稳定表达外源基因BARF1基因的GES-1细胞的增殖速度快,与空载组和未转染组有着显著差异,则BARF1基因会对胃上皮细胞GES-1的增殖产生促进作用;为评估BARF1基因是否会对Cyclin D1蛋白的表达产生影响,通过IHC染色法对三组细胞的细胞周期蛋白Cyclin D1进行检测,发现只有稳定表达BARF1组Cyclin D1表达阳性,而其余两组未见该蛋白的表达,这可能与BARF1上调NF-κB和Cyclin-D1对细胞增殖发挥促进作用的机制相关[24];之所以人体会出现各种癌变信号,一个十分重要的条件就是相关细胞表现出异常强大的迁移和侵袭能力[25],本文通过划痕实验比较、分析稳定转染BARF1组和空载体组GES-1的迁移能力,两组间细胞迁移能力存在明显的差别,即稳定转染BARF1组细胞的迁移效率更高,该结果进一步验证了BARF1基因的致癌特性;细胞周期分析结果显示,稳定转染外源基因BARF1组的人胃上皮细胞S期明显延长,表明BARF1基因具有促细胞有丝分裂的生物学特性,这与Sall A、Sakka E等[22,26]的研究结果相一致。
综上所述,BARF1基因的表达可促进GES-1细胞增殖、迁移及分裂,最终诱导正常胃上皮细胞发生恶性改变,因此,BARF1基因可能在EBVaGC的发生发展中发挥重要作用。
利益冲突:无
引用本文格式:杨佳宁,李娜,董鸿铭,等.EB病毒编码的BARF1对GES-1细胞的影响[J].中国人兽共患病学报,2021,37(12):1071-1077,1083.DOI:10.3969/j.issn.1002-2694.2021.00.162

