hsa_circ_0026782对肺腺癌细胞的增殖、迁移及凋亡作用
邹晓莉,王慧敏,曹碧月,谷文露,袁海涛,严玉兰
0 引 言
随着全球经济化的发展,全球的空气污染,包括PM 2.5、雾霾、烟草等导致全球空气质量严重下降,均导致肺癌成为全球发病率及死亡率最高的恶性肿瘤[1]。按病理形态分类,可分为小细胞肺癌及非小细胞肺癌,其中非小细胞肺癌包括:鳞癌、腺癌、大细胞癌等,而肺腺癌作为最常见的非小细胞肺癌,其5年生存率为10%~15%[2],多数起源于支气管黏膜上皮,早期可无症状,故多数发现时已是晚期,已错失手术机会,迫切需要敏感性及特异性较高的特异性指标。
近年来,环状RNA (circular RNAs, circRNAs)被证实是一种新型的非编码RNA亚型,在各种癌症中发挥重要作用,与传统线性RNA不同,circRNA呈闭合环状RNA,不受外切酶影响[3],在细胞中更加稳定,不易降解。已有多种环状RNA被验证对肿瘤的增殖、迁移及侵袭具有重要作用[4-5],已有部分研究发现环状RNA对肺癌细胞增殖及迁移等具有重要作用,包括hsa_circ_0043265及hsa_circ_0008234[6-7],然而,更多关于环状RNA在肺腺癌中的调控尚不清楚,在针对早期肺腺癌的检测和在对肺腺癌免疫微环境的影响尚不清楚。
本课题组通过前期高通量测序,发现hsa_circ_0026782在肺腺癌组织中显著下调,通过检索文献发现hsa_circ_0026782位于人类染色体12q13,已被研究报道与骨肉瘤、结肠癌的发生具有相关性[8-9],其在肺腺癌中的研究尚未被报道。
本研究旨在探索肺腺癌组织、肺腺癌血清、肺腺癌细胞中hsa_circ_0026782的差异表达,并探索hsa_circ_0026782在肺腺癌增殖、迁移及凋亡方面的作用及部分机制,为肺腺癌的早期诊断及临床治疗提供新型靶点。
1 材料与方法
1.1 肺腺癌组织与血清
1.1.1 组织2019年12月至2021年12月在我院接受手术切除的肺腺癌患者28对纳入本研究。筛选标准包括:①确诊肺腺癌后未经过任何治疗且同意手术治疗,且签署知情同意书;②手术治疗前无传染性疾病、高血压、糖尿病、慢性阻塞性肺病等基础性疾病;③标本经病理学检查确诊为肺腺癌;④手术标本可对肺腺癌组织及癌旁组织进行保留,由病理科医师切除并放入样本内,做好标记后放入样本储存室液氮中保存。如果患者失去随访或伴有其他恶性肿瘤,则被排除在外。本研究我院机构审查委员会以及从患者或其监护人处收集的书面同意或口头协议(带有磁带录音)批准。患者临床信息可从医院电子病例系统提取,包括但不限于:年龄、性别、肿瘤大小、TNM分期。本课题经医院批准(批准号:K-20180043-Y)后,从样本储存室采集组织。
1.1.2全血2019年12月至2021年9月在我院接受手术切除的肺腺癌患者,并符合上述筛选标准的,收集术前、术后全血,选取健康体检者全血,并用离心半径为21.00 cm,1200 r/min、20 min离心,吸取上清置于无酶无菌离心管中,做好标记,并放置于-80 ℃冰箱保存备用。所有样本收集均得到患者知情同意并签署了知情同意书,且得到江苏大学附属人民医院伦理委员会的批准(批准号:K-20180043-Y)。
1.2细胞株人肺腺癌细胞株A549、PC9、H1975以及人正常支气管黏膜上皮细胞株BEAS-2B购买于中国科学院上海生科院细胞中心。A549细胞的培养基为含10 %胎牛血清、1 %双抗的DMEM培养基;PC9、H1975、BEAS-2B细胞的培养基为含10 %胎牛血清、1 %双抗的1640培养基。将细胞置于二氧化碳浓度为5%,温度为37 ℃的恒温培养箱。
1.3主要试剂高通量测序(上海欧易生物医学技术有限公司);小干扰RNA(siRNA)由上海生工生物技术有限公司设计合成。过表达质粒由上海吉凯基因科技有限公司设计合成;胎牛血清、RPMI 1640、DMEM培养液及胰蛋白酶购自美国Gibco公司;PCR引物由上海生工生物工程股份有限公司设计合成;LipofectamineTM 2000转染试剂、Trizol及Trizol LS 试剂购自美国Thermo Fisher Scientific公司;逆转录试剂盒及实时荧光定量 PCR 试剂盒购于日本TaKaRa公司;CCK-8试剂购自南京厚载生物科技公司;Transwell小室购自美国康宁公司;兔抗CMTM4抗体购自Immunoway有限公司,兔抗表皮生长因子受体(EGFR)、兔抗bax(Bcl- 2 Associated X Protein, BAX)、bcl-2(B cell lymphoma/lewkmia-2)、Cleaved cas pase-7(Cysteine aspartic acid specific protease-7)、鼠抗β-actin抗体及羊抗鼠二抗均购自武汉三鹰生物技术有限公司。
1.4实验方法
1.4.1 高通量测序与下游靶点预测选取5对筛选标准内的肺腺癌组织及癌旁组织,提取其总RNA,并采用RNase R去除线性RNA,测序程序及分析由上海欧易生物医学技术有限公司。通过高通量测序结果数据库、circbank(http://www.circbank.cn/)、starbase(http://starbase. Sysu. Edu.cn /) 数据库预测CMTM4(CKLF-like MARVEL跨膜结构域含4)是hsa_circ_0026782的下游靶点
1.4.2细胞培养A549细胞培养在含10% 胎牛血清、1% 双抗的DMEM培养液中;PC9、H1975、BEAS-2B细胞培养在含有10%胎牛血清、1%双抗的RPMI 1640培养液中,放置于环境温度为37 ℃、二氧化碳浓度为5%的恒温细胞培养箱中培养,每1~2 天更换细胞培养液,当细胞贴壁生长到密度为80%~90%时进行细胞传代。
1.4.3细胞转染将PC9及A549细胞分别接种于2个6孔板中,A549细胞6孔板设置过表达组(circ_0026782)及对照组(Empty-vector),PC9细胞6孔板设置si组(si-circ _0026782)及对照组(si-NC)。当细胞贴壁生长密度达约80% 时,按照使用说明书,LipofectamineTM 2000与质粒、siRNA混匀并室温静置20 min后移入6孔板培养皿中进行转染,并做好标记,转染24 h后提取RNA并进行qRT-PCR验证其转染效率,转染48 h后提取蛋白并进行蛋白印迹实验验证蛋白表达水平。
1.4.4qRT-PCR检测hsa_circ_0026782及CMTM4 mRNA表达水平按照Trizol提取RNA的使用说明书提取肺腺癌组织及细胞总RNA,按照Trizol LS使用说明书提取血清总RNA,并用RNase R去除线性RNA,并使用分光光度计测定所提取RNA浓度及纯度,制定的筛选标准为A260/280控制于1.80~2.00,浓度控制400~500 ng/μL。对符合标准的RNA按照TAKARA逆转录试剂盒说明书对总RNA逆转录为cDNA。对逆转录的cDNA进行荧光定量,依照使用PCR仪器(ABI 7500HT)进行扩增,每组设置4个复孔。GAPDH作为内参,hsa_circ_0026782、CMTM4 mRNA表达量用2-ΔΔCt的方法进行计算。引物如下:hsa_circ_0026782前引物(5′‐3′):ACTCGCTGCCTTGCCTCATA、后引物(5′‐3′):ATTTGGGTTCTGCCAGCAGG;CMTM4 mRNA前引物(5′‐3′):TTCA A TCGTACTGGCTGCTTT,后引物(5′‐3′):CCAGGAATGTGTTCATGCTA。
1.4.5平板细胞克隆实验选取转染24 h后的A549、PC9细胞分别种于2个6孔板中,做好标记后放入环境温度为37 ℃、CO2浓度为5%的恒温细胞培养箱中培养,约14 d观察形成菌落后取出。4%多聚甲醛在4 ℃下固定,0.1%的结晶紫染液染色并倒置晾干,后在显微镜下拍照。使用TB tools软件计算细胞克隆数目,每组试验设置3次重复试验,细胞克隆计算方法,公式如下:
克隆形成率(%)=(克隆数/接种细胞总数)×100%
1.4.6CCK-8实验将分别转染24 h后的过表达质粒、空载体的A549细胞,转染siRNA、si-NC的PC9细胞用胰酶消化后离心重悬,按照5000个细胞/(孔·100 μL)分别放置于96孔板,每组设置3个复孔,培养24 、48 、72 、96 h后换液,并每孔加入10 μL CCK-8试剂,孵育1~4 h,使用酶标仪记录每孔450 nm处的光密度A值。
1.4.7细胞划痕实验选取处于正常对数期的A549分组为过表达组、空载体组,每组设置3个复孔种于6孔板中;PC9细胞按照siRNA组、si-NC组,每组设置3个复孔种于6孔板中;当细胞贴壁生长单层细胞贴壁率约80%时弃去培养基,用10 μL枪头垂直于6孔板底部作直线,然后用PBS清洗 2次,按照转染方法进行转染,并在显微镜下对所划直线宽度拍照,记录时间为0 h,将6孔板放置于环境温度为37 ℃、CO2浓度为5%的恒温细胞培养箱中继续培养,48 h后取出置于显微镜下拍照直线宽度,记录时间为48 h。
1.4.8Transwell 迁移实验将转染siRNA的PC9细胞和转染质粒的A549细胞用胰酶消化后,经过1200 r/ min,5 min离心后弃掉上清,用无血清RPMI 1640培养液重悬细胞,并用细胞计数板计数,在24孔板下层中加入600 μL含10%胎牛血清的RPMI 1640培养液,放入小室,在小室上层加入100 μL含10 000个细胞的细胞重悬液,随后置入恒温培养箱,24 h后取出,用4%的多聚甲醛固定,0.1%的结晶紫染液染色,倒置晾干后放置在显微镜下观察,随机取5个视野取平均值,实验重复3次。
1.4.9Western Blot 检测将转染48 h后的细胞从恒温培养箱中取出,弃培养液,并用PBS缓冲液冲洗1次。按照RIPA裂解液的使用方法提取蛋白并做好标记。随后在电压80 V下进行120 min 12%的SDS-PAGE凝胶电泳分离蛋白质;后恒流300 mA转膜120 min;室温下用5%脱脂奶粉进行封闭,时间为2 h;取出条带后孵育一抗(鼠抗 β-Actin 1∶5000,兔抗CMTM4 1∶500,兔抗EGFR 1∶5000,兔抗bcl-2 1∶5000,兔抗 bax 1∶5000,兔抗Cleaved caspase-7 1∶5000),并放入4 ℃ 冰箱孵育过夜;第2天取出后用TBST摇床清洗3次,每次约10 min;再分别予以室温孵育羊抗鼠、羊抗兔二抗(1∶5000)2 h,接着用TBST摇床清洗3次,每次10 min,最后予以ECL化学发光显影。使用Image J软件对条带进行半定量分析。
2 结 果
2.1 hsa_circ_0026782筛选将5对肺腺癌组织及其癌旁组织进行高通量测序,并筛选出在肺腺癌组织和其癌旁组织相比,相对表达量差异较大的环状RNA:h sa_circ_0026782,并绘制热图,见图1。

图 1 hsa_circ_0026782明显下调Figure 1 Hsa_circ_0026782 is obviously down
2.2hsa_circ_0026782在组织、血清、细胞中的表达hsa_circ_0026782在28对肺腺癌组织中的表达相对于其癌旁组织下调;hsa_cir c_0026782在40对肺腺癌患者术前血清中的表达相对于正常健康体检者明显下调;h sa_circ_0026782在25组肺腺癌患者术后第1天血清中的表达量相对于术前明显增加;hsa_circ _0026782在3种肺腺癌细胞PC9、A549、H1975中的表达量相对于正常支气管黏膜上皮细胞BEAS-2B中的表达量均减少;其中,hsa_circ_0026782在肺腺癌A549细胞中减少最为明显,在PC9细胞中减少相对较少。见图2。
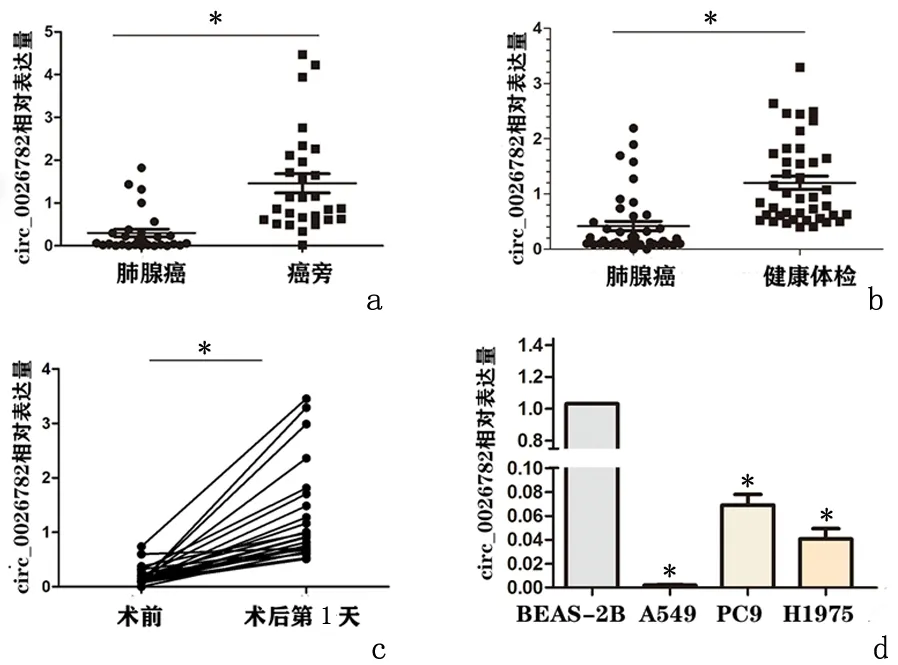
a:组织; b:血清肺腺癌与健康体检的比较; c:血清中术前与术后第1天比较; d:肺腺癌细胞系与BEAS-2B比较,*P<0.01图 2 has_circ_0026782在组织、血清、细胞中差异性表达Figure 2 Hsa-circ-0026782 was differentially expressed in tissues, serum and cells
2.3hsa_circ_0026782的过表达及敲减效率相对于空载体组(1.19±0.52),转染过表达质粒组(534.2±39.12)能明显提高hsa_circ_002678的表达;相对于对照组(si-NC)(1.06±0.13),用小干扰RNA敲减hsa_circ_0026782(si-circ_0026782)(0.052±0.004)能明显减少hsa_circ_0026782的表达。
2.4hsa_circ_0026782的过表达及敲减对肺腺癌细胞增殖的影响平板细胞克隆实验表明,对A549细胞进行质粒转染,过表达hsa_circ_0026782 (circ_0026782)组较空载体(Empty-vector)组明显抑制细胞的的克隆形成;对PC9细胞进行siR NA敲减hsa_circ_0026782(si-circ_0026782)组较si-NC组促进细胞的克隆形成。CCK-8实验表明,过表达hsa_circ_0026782(circ_0026782)组较空载体(Empty-vector)组明显抑制细胞的增殖;siRNA敲减hsa_circ_0026782组(si-cir c_0026782)较阴性对照组(si-NC)组促进细胞增殖。Western blot实验结果表明,过表达hsa_circ_0026782(circ_0026782)组较空载体组可抑制表皮生长因子受体(EGFR)的表达量,而siRNA敲减hsa_circ_0026782组(si-circ_0026782)较si-NC组可促进EGFR的表达。见图3。
平板克隆实验、CCK-8实验及Western blot实验结果均表明,hsa_circ_0026782的表达上调可明显抑制肺腺癌细胞增殖,敲减hsa_circ_0026782的表达下调可明显促进肺腺癌细胞的增殖。
2.5hsa_circ_0026782的过表达及敲减对肺腺癌细胞凋亡的影响过表达hsa_circ_0026782(circ_0026782)可促进肺腺癌细胞凋亡,敲减hsa _circ_0026782(si-circ _0026782)可抑制肺腺癌细胞凋亡,见图3、图4、图5。
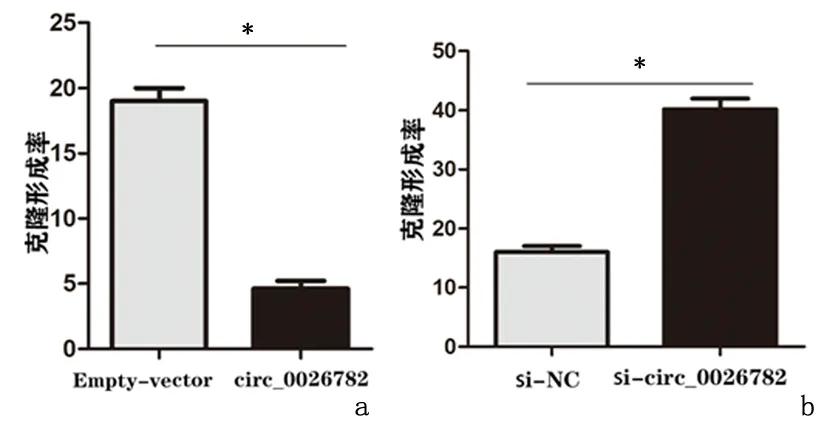
a:A549细胞; b:PC9细胞*P<0.01图 3 过表达及敲减hsa_circ_0026782对肺腺癌细胞的增殖的影响Figure 3 The expression level of hsa_circ_0026782 has an effect on the proliferation of lung adenocarcinoma cells
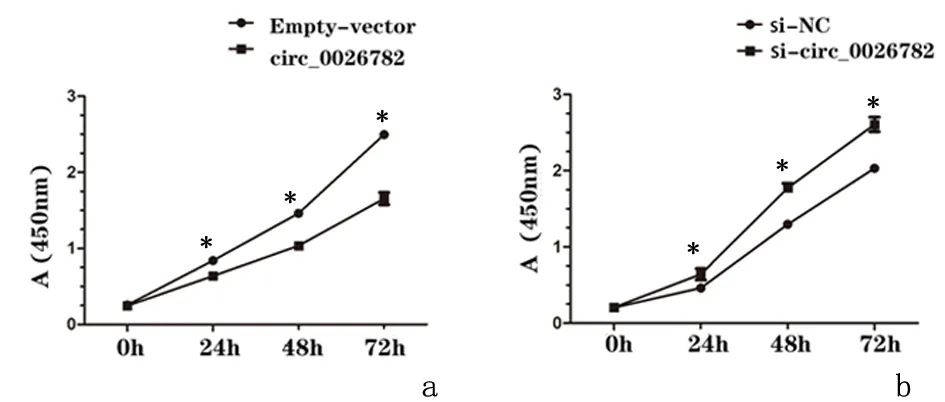
a:A549细胞; b:PC9细胞*P<0.01图 4 过表达及敲减hsa_circ_0026782对肺腺癌细胞的增殖的影响Figure 4 The expression level of hsa_circ_0026782 has an effect on the proliferation of lung adenocarcinoma cells

*P<0.01图 5 过表达及敲减hsa_circ_0026782对肺腺癌细胞的迁移的影响Figure 5 The expression level of hsa_circ_0026782 has an effect on the migration of lung adenocarcinoma cells
2.6hsa_circ_0026782的过表达及敲减对肺腺癌细胞迁移的影响细胞划痕实验表明,在A549细胞中,过表达hsa_circ_0026782(circ_0026782)组(22.37±1.47)较空载体(Empty-vector)组(62.74±1.99)可抑制细胞迁移;PC9细胞中,siRNA敲减hsa_circ_ 0026782组(si-circ_0026782)组(63.99±1.75)较阴性对照组(si-NC)组(39.03±2.62)促进细胞迁移。Transwell 实验表明,在A549细胞中,过表达hsa_circ_0026782(circ_0026782)组(89.53±0.50)较空载体(Empty-vector)组(20.63±0.71)的细胞迁移数明显下降;siRNA敲减hsa_circ_ 0026782(si-ci rc_0026782)组(100.50±0.90)较阴性对照组(si-NC)(46.13±0.51)细胞迁移数明显增多。见图6、图7。

a:A549细胞; b:PC9细胞*P<0.01图 6 过表达及敲减hsa_circ_0026782对肺腺癌细胞的迁移的影响Figure 6 The expression level of hsa_circ_0026782 has an effect on the migration of lung adenocarcinoma cells

a:A549细胞; b:PC9细胞图 7 过表达及敲减hsa_circ_0026782对肺腺癌细胞的迁移的影响Figure 7 The expression level of hsa_circ_0026782 has an effect on the migration of lung adenocarcinoma cells
2.7hsa_circ_0026782的过表达及敲减对CMTM4的影响过表达hsa_circ_00 26782 (circ_0026782)组(4.877±0.769)较空载体(Empty-vector)(0.948±0.229)组CMTM4 mRNA表达量增加;siRNA敲减hsa_circ_0026782 (si-circ_0026782)组(0.167±0.07423)较阴性对照组(si-NC)组(1.166±0.311)CMT M4 mRNA表达量下降。Western blot实验结果表明,过表达hsa_circ_0026782(circ_0 026782)组较空载体(Empty-vector)组CMTM4蛋白表达量增加,敲减hsa_circ_0026782(si-circ_0026782)组较阴性对照组(si-NC)CMTM4蛋白表达量下降,见图8。
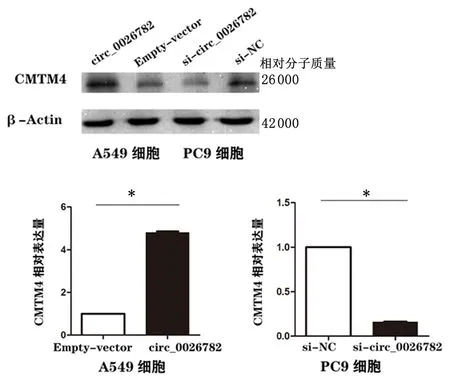
*P<0.01图 8 过表达组与空载体组和敲减组与对照组中CMTM4蛋白的表达Figure 8 Expression of CMTM4 protein in the overexpression group versus the empty vector group and the knockdown group versus the control group
3 讨 论
肺癌作为世界范围内发生率和死亡率最高的恶性肿瘤,目前临床医学上尚缺少敏感和特异性的指标。越来越多的证据表明,环状RNA参与了肿瘤的病理生理过程,影响了肿瘤细胞的大多数细胞行为,包括增殖、迁移、侵袭、细胞周期上皮间质转化和耐药[10-11]。例如,circMTO1通过调控miR-17/QKI-5通路抑制肺腺癌细胞的增殖[12];hsa_circ_0000199通过干扰miR206/613介导的PI3K/Akt/mTor信号转导通路促进三阴性乳腺癌的化疗耐受[13]。
在本研究中,通过高通量测序及肺腺癌组织与癌旁组织、肺腺癌血清与健康体检、肺腺癌术前血清与术后血清、肺腺癌细胞系与正常支气管黏膜上皮qRT-PCR实验,发现hsa_circ_0026782在肺腺癌中明显下调。通过对下调最为明显的肺腺癌细胞A549过表达hsa_circ_0026782、PC9细胞进行siRNA敲减,本课题组发现,过表达hsa_circ_0026782可明显抑制肺腺癌细胞增殖、迁移,促进细胞凋亡,而敲减hsa_circ_0026782则出现相反结果,提示hsa_circ_0026782发挥抑癌作用。
CMTM4基因位于染色体16q22.1上,一个包含众多抑癌基因的基因位点,有CMTM4-V1、CMTM4-V2 和 CMTM4-V3 3个剪接体,其中CMTM4-V1 和 CMTM4-V2 是主要的形式,广泛表达于多种组织。CMTM4具有的MARVEL跨膜结构域的基因编码产物具有广谱趋化作用,参与多种肿瘤的发生发展与迁移。已有文献报道,CMTM4 在胰腺癌、肝癌、大肠癌等多种类型肿瘤抑制基因[14-16],卜梁等[17]发现CMTM4在非小细胞肺癌中明显下调,作为一个潜在的抑癌基因。
在肿瘤免疫方面,Mezzadra 等[18]在 Nature 上报道了 CMTM4与CMTM6与 PD-L1 (程序性死亡配体1)蛋白存在相互作用,证明CMTM4是CMTM6的备用调控分子,可结合肿瘤细胞表面PD-L1,减少PD-L1泛素化降解,增加PD-L1半衰期,从而增强PD-L1抑制免疫T细胞的作用,PD-L1也依赖CMTM4与CMTM6发挥作用。目前肿瘤免疫治疗受到肿瘤复杂免疫微环境的限制,Imamovic 等[19]提出CMTM6 和 CMTM4 可作为增强免疫检查点抑制剂治疗作用的新途径。本课题组发现hsa_circ_0026782表达与CMTM4的水平成正相关,提示hsa_circ_0026782可能通过潜在的抑癌基因CMTM4发挥其抑癌作用并影响肿瘤免疫微环境。
综上所述,hsa_circ_0026782在肺腺癌细胞中显著下调,通过对肺腺癌细胞系进行细胞实验表明其可抑制肺腺癌细胞增殖、迁移,并促进细胞凋亡而发挥抑癌作用,而改变hsa_circ_0026782的表达可明显影响CMTM4的表达量,提示hsa_circ_0026782可能通过影响CMTM4发挥抑癌作用,同时可能作为一个调节分子影响肿瘤免疫逃逸过程,为肺腺癌的诊断及免疫治疗提供新的理论依据,但其具体机制尚不明确,本课题组正进一步研究。

