RNAi分析舞毒蛾谷胱甘肽S-转移酶(GST)基因对黄酮和槲皮素胁迫响应
齐 琪,孙丽丽,许力山,曹传旺,2*
(1. 东北林业大学林学院,哈尔滨 150040;2. 东北林业大学森林生态系统可持续经营教育部重点实验室,哈尔滨 150040)
近年来,植物与昆虫间的相互作用逐渐成为研究新热点(Howe and Herde, 2015)。植物主要是通过产生化学物质,尤其是次生代谢物质来抵御昆虫取食等胁迫,从而影响昆虫取食行为,影响昆虫生长发育,而昆虫则通过改变体内解毒酶活性来减少次生物质对其影响(张永清, 1991; Heil, 2008; Royetal., 2016)。植物次生代谢物质主要包括黄酮类、萜类和生物碱类化合物(高微微等, 2006; Constabel and Lindroth, 2009;郭映雪和孙墨珑,2020)。黄酮和芦丁是杨树Populus等植物主要的次生代谢物,均属于黄酮类化合物,对斜纹夜蛾Spodopteralitura、苹果棉蚜Eriosomalanigerum、南方灰翅夜蛾Chrysodeixiseriosoma、桃蚜Myzuspersicae、美国白蛾Hyphantriacunea等多种农林害虫均有抑制生长发育或毒杀作用(Lindroth and Peterson, 1988; Ateyyatetal., 2012; Suetal., 2017; 刘鹏, 2018; 王沫等, 2020)。
谷胱甘肽S-转移酶(glutathione-S-transferase, GST)是一类多功能超家族酶系,广泛分布在动植物、昆虫以及微生物体内(Danieletal., 2008),根据GST的功能、编码基因相似度、组织形式和生化特性,昆虫体内的GSTs可分为Delta、Epsilon、Omega、Sigma、Theta和Zeta6个家族(Kettermanetal., 2011)。GST主要通过催化谷胱甘肽的疏基与有毒的亲电、疏水底物发生共价轭合反应(Nerinoetal., 2009),从而参与昆虫体内多种解毒代谢过程。不同种类的次生代谢物可诱导不同GST程度上调。Zhang等(2012)发现槲皮素诱导家蚕Bombyxmori体内GST活性最高为对照的4.1倍(Zhangetal.,2012)。Zou等(2016)发现斜纹夜蛾幼虫SlGSTe1能被芥菜Brassicajuncea中的次生物质吲哚-3-甲醇诱导上调(Zouetal., 2016),Abdallah等(2019)从龙葵Solanumnigrum和红果龙葵Solanumvillosum等茄属植物中提取的糖苷生物碱可导致马铃薯甲虫Leptinotarsadecemlineata死亡,抑制了马铃薯甲虫GST活性(Abdallahetal., 2019)。Yuan等(2020)发现单宁酸可引起美国白蛾幼虫GST活性高于对照组,说明单宁酸介导的GST解毒酶在美国白蛾解毒过程中起着关键作用(Yuanetal., 2020)。
舞毒蛾Lymantriadispar属鳞翅目Lepidoptera毒蛾科Liparidae毒蛾属Lymantria是一种危害多种林木的世界性害虫。据报道,舞毒蛾可以取食500多种植物(Lazarevieetal., 1998; Robertetal., 2014)。通过前期研究,对舞毒蛾取食咖啡酸、水杨素、芦丁、槲皮素、儿茶酚、黄酮等6种次生代谢物,对LdGSTe4、LdGSTe2等13个GSTs候选基因的功能进行了初步研究,证明LdGSTe2、LdGSTs1、LdGSTs2和LdGSTz1基因参与了舞毒蛾对植物次生物质解毒代谢过程(Maetal., 2021)。因此,本文在前期研究基础上,利用RNAi介导技术进一步探讨舞毒蛾LdGSTe2、LdGSTs1、LdGSTs2和LdGSTz1基因的生理功能以及对黄酮、槲皮素等杨树次生物质的响应机制,为舞毒蛾对植物次生物质的适应性提供理论参考。
1 材料与方法
1.1 试验材料
1.1.1供试昆虫
舞毒蛾卵块和人工饲料均购于中国林业科学研究院森林生态与环境保护研究所。幼虫孵出后置于人工气候箱(温度25℃、光周期14 L ∶10 D、相对湿度70%)饲养。挑选健康、活泼、大小一致的舞毒蛾3龄幼虫作为供试昆虫。
1.1.2供试药剂
黄酮(Flavone)购自Amresco公司,纯度为99.0%;槲皮素(Quercetin)购自Scientific Instrument公司,纯度为97.0%。
1.2 RNAi分析
采用RNeasy Mini动物组织RNA提取试剂盒(Qiagen)提取舞毒蛾3龄幼虫的总RNA。通过分析和比对舞毒蛾转录组数据,设计并合成CDS序列引物,以PrimeScriptTMRT试剂盒(TaKaRa)合成的cDNA第1链为模板进行RT-PCR。将合成的cDNA使用RNase Free ddH2O稀释10倍,作为基因克隆和荧光定量RT-qPCR的模板,采用含有T7启动子序列的引物(表1)扩增靶基因的cDNA片段。PCR反应体系为:目的基因质粒2.5 μL,10×buffer(含Mg2+)5 μL,引物Primer-F/ Primer-R(10 μM)各2.5 μL,dNTPs(2.5 mM)1 μL,Taq DNA聚合酶(5 U/μL)1 μL,DEPC水补足至50 μL。PCR的反应条件为:95℃ 3 min;95℃ 30 s,58℃ 30 s,72℃ 2 min,35个循环;72℃延伸10 min,4℃保存。PCR产物经琼脂糖凝胶电泳和切胶回收纯化后作为合成dsRNA的模板,并使用MEGAscript RNAi试剂盒(Ambion)进行dsRNA的合成,经电泳检测并测定浓度,稀释至1 000 ng/μL,于-80℃保存备用。
选取健康、活泼的舞毒蛾3龄幼虫,使用显微注射器将1.0 μL (1 μg/μL)LdGSTe2、LdGSTs1、LdGSTs2、LdGSTz1的dsRNA分别注射到幼虫腹部倒数第2腹节间膜位置,以注射等量的绿色荧光蛋白(green fluorescent protein, GFP)基因的dsRNA作为对照组。每个处理注射10头幼虫,重复3次。处理后48 h随机挑取活泼的舞毒蛾3龄幼虫,经液氮速冻后保存于-80℃冰箱,用于GSTs基因沉默效率的检测。
1.3 LdGSTs基因沉默效率检测
采用实时荧光定量RT-PCR的方法检测LdGSTe2、LdGSTs1、LdGSTs2和LdGSTz1基因的表达量。引物采用Primer 5.0软件按照RT-qPCR要求进行设计。反应体系为:10 μL 2×SYBR premix Ex Taq酶,l μL Primer mix (10 μmol /L),2 μL cDNA,7 μL DEPC水,总体积20 μL。反应条件为:94℃预变性30 s;94℃变性12 s,60℃退火45 s,72℃延伸45 s,81℃读板1 s,45个循环,每个样品重复3次。GSTs基因的荧光定量引物(Maetal., 2021)以及内参Actin、EF1a、TUB基因引物序列(Yinetal., 2020)如表1。
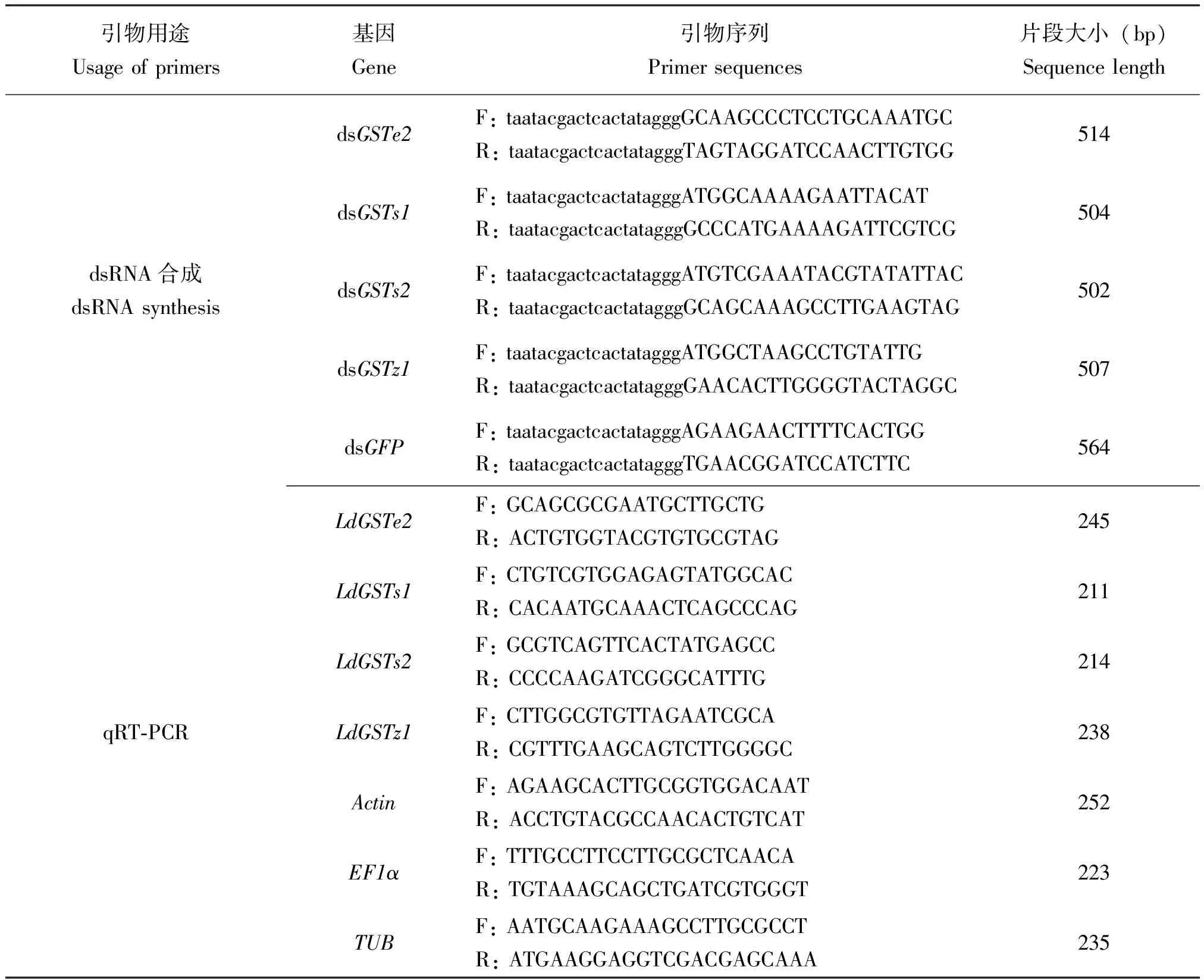
表1 合成dsRNA和RTq-PCR所用引物
1.4 GSTs基因沉默对舞毒蛾幼虫生长发育影响检测
称取注射dsRNA舞毒蛾3龄幼虫的鲜重,待取食人工饲料120 h后,将幼虫、取食后的饲料及粪便放入烘箱,50℃烘干24 h,再升温至120℃温烘至恒重,称取幼虫、粪便及饲料干重,每个处理20头,重复3次。另取刚蜕皮的30头舞毒蛾3龄幼虫饥饿24 h后称重,并取新鲜人工饲料称重,按上述方法烘烤至恒重测定其干重, 以计算试前幼虫和饲料的干湿比;计算幼虫体重、存活率和营养指标。依据Waldbauer(1964)方法计算各营养指标(Waldbauer, 1964)。相对生长率(RGR)=(D-C)/((C+D)/ 2)×100%;相对取食量(RCR)=(A-B)/((C+D)/ 2)×100%;食物利用率(ECI)=(D-C)/(A-B)×100%;食物转化率(ECD)=(D-C)/(A-B-E)×100%;近似消化率(AD)=(A-B-E)/(A-B)×100%。式中:A为试验前的饲料干质量;B为试验后的饲料干质量;C为试验前的幼虫干质量;D为试验后的幼虫干质量;E为幼虫的粪便干质量。
1.5 GSTs基因沉默的舞毒蛾幼虫对次生物质敏感性
为鉴定LdGSTe2、LdGSTs1、LdGSTs2和LdGSTz1基因是否参与舞毒蛾对次生物质的响应,使用含有次生物质0.8%黄酮(w/w)和0.02%槲皮素(w/w)的人工饲料分别饲喂注射GSTsdsRNA或dsGFP舞毒蛾3龄幼虫。对照组人工饲料中加入等量二甲基亚砜(DMSO)溶剂。基因沉默方法同1.2,生理指标检测同1.4。
1.6 数据处理
采用Excel 2007进行数据处理和分析,实时荧光定量RT-PCR数据经仪器自带的Opticon Monitor 3软件处理,利用SPSS 17.0进行差异性分析,采用Duncan方法进行显著性差异分析(P<0.05)。舞毒蛾GSTs基因表达量用2-△△Ct方法进行相对表达量分析(Livak and Schmittgen, 2001)。
2 结果与分析
2.1 舞毒蛾GSTs基因沉默效率分析
采用实时荧光定量RT-PCR检测LdGSTe2、LdGSTs1、LdGSTs2和LdGSTz1基因的沉默效率(图1)。处理48 h,靶基因的相对表达量均低于对照组dsGFP,且LdGSTs1、LdGSTs2和LdGSTz1基因相对表达量均显著下降,分别比对照组降低了45.00%±10.4%、42.92%±6.7%和32.71%±2.8%(P<0.05)。处理72 h,注射LdGSTe2处理组的转录水平显著降低,为对照组dsGFP的0.42倍(P<0.01)。结果表明通过舞毒蛾体内注射目的基因dsRNA可有效沉默靶标基因。
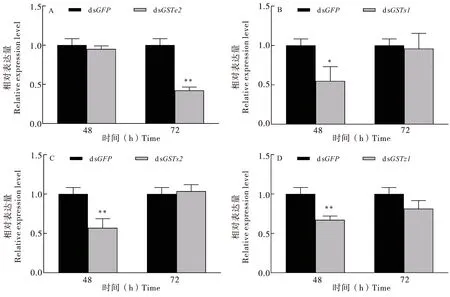
图1 舞毒蛾GST基因沉默效率Fig.1 Silencing effiency of GST genes in Lymantria dispar larvae注:柱形图中*表示同一处理时间处理组与对照组间差异显著P<0.05;**表示差异极显著P<0.01,独立样本t检验。Note:* showed significantly difference between treatments and control groups by student’s t test at 0.05 level. ** showed significantly difference between treatments by student’s t test at 0.01 level.
2.2 GSTs基因沉默对舞毒蛾幼虫生长发育和存活率的影响
注射GST基因dsRNA舞毒蛾幼虫饲喂正常人工饲料,注射dsGFP对照组舞毒蛾鲜重均高于注射dsGSTs基因处理组(表2)。处理72 h,注射LdGSTsdsRNA处理组体重为dsGFP对照组的29.83%~71.68%。注射dsGFP与dsGSTs后舞毒蛾幼虫存活率均在90.00%以上,所有注射GST基因dsRNA处理组与注射dsGFP对照组存活率无显著性差异,表明GST基因沉默对舞毒蛾幼虫存活无影响(图2)。

表2 舞毒蛾幼虫GST基因沉默对体重增长的影响

图2 舞毒蛾GST基因沉默对幼虫存活率的影响Fig.2 Effects of GST gene silencing on survival rate of Lymantria dispar larvae注:不同小写字母表示同一时间不同处理组间差异显著性(P<0.05)。Note: Different lowercase letter showed significantly difference between different treatment groups at the same time (P<0.05).
注射dsGFP、dsGSTe2、dsGSTs1、dsGSTs2和dsGSTz1舞毒蛾3龄幼虫营养利用指标如表3所示。除近似消化率外,dsGSTe2、dsGSTs1和dsGSTs2处理组相对生长率、相对取食量、食物利用率和食物转化率依次为对照组dsGFP的53.67%~73.94%、59.33%~82.08%和77.41%~90.46%,均显著低于对照组dsGFP;除食物转化率外,dsGSTz1处理组相对生长率、相对取食量、食物利用率和近似消化率依次为对照组dsGFP的73.94%、82.08%、90.46%和76.98%,显著低于对照组dsGFP。
2.3 GSTs基因沉默舞毒蛾幼虫对黄酮和槲皮素胁迫响应
分别饲喂含黄酮和槲皮素的人工饲料72 h后,dsGFP对照组舞毒蛾3龄幼虫体重显著高于dsGSTs处理组(图3)。其中,dsGSTe2处理组舞毒蛾幼虫体重最低,分别为dsGFP对照组体重的80.83%和85.65%(P<0.05);dsGSTz1处理组舞毒蛾幼虫体重最高,分别为dsGFP对照组体重的93.57%和92.62%(P<0.05)。dsGSTs2处理组与dsGSTe2处理组间体重差异不显著,分别为对照组体重的81.34%和88.66%。
经次生物质黄酮和槲皮素分别饲喂GSTs沉默后的舞毒蛾幼虫存活率显著降低(图4)。注射dsGSTe2和dsGSTs1的舞毒蛾幼虫饲喂黄酮后存活率分别为对照组dsGFP的66.67%和71.43%,饲喂槲皮素后存活率更低,为对照组dsGFP的65.00%和62.85%(图4-A和4-B);注射dsGSTs2和dsGSTz1的舞毒蛾幼虫饲喂槲皮素后存活率分别为对照组dsGFP的83.33%和65.00%;饲喂黄酮后,存活率分别为对照组dsGFP的62.97%和69.84%,差异性显著(图4-C和4-D)。
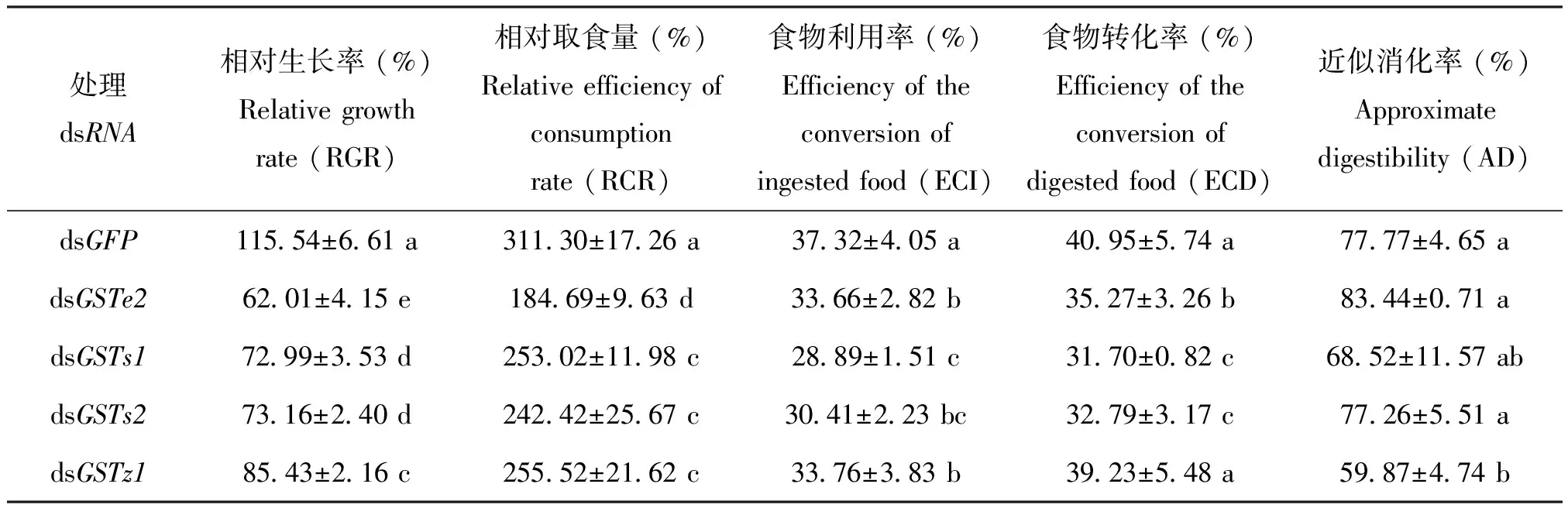
表3 舞毒蛾GSTs基因沉默对营养利用的影响
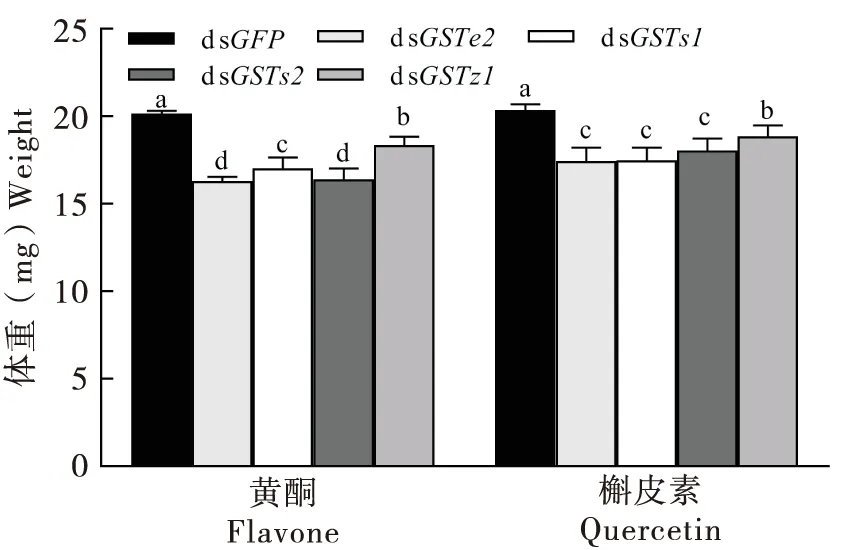
图3 不同次生物质处理72 h对GSTs基因沉默舞毒蛾幼虫体重影响Fig.3 Effects of different secondary metabolites on body weight of silenced Lymantria dispar larvae for 72 h注:不同小写字母表示同一时间、喂食同种饲料、不同基因沉默组之间的差异显著性(P<0.05)。Note: Different lowercase letters showed significantly difference between treatments at the same time and fed by Duncan’s analysis at 0.05 level.
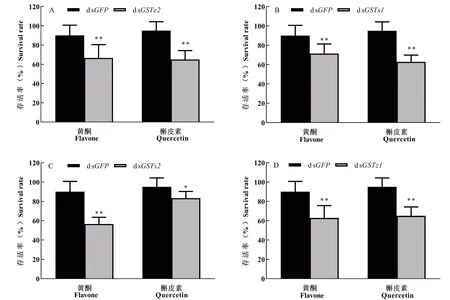
图4 不同次生物质对GSTs基因沉默舞毒蛾幼虫存活率的影响Fig.4 Survival rate of silenced Lymantria dispar under different secondary metabolites stress注:A、B、C和D分别为注射dsGSTe2、dsGSTs1、dsGSTs2和dsGSTz1基因72 h时舞毒蛾的存活率。柱形图中*表示同一处理时间不同处理组和对照组间差异显著P<0.05;**表示差异极显著P<0.01,独立样本t检验。Note: A, B, C and D showed the survival rates of Lymantria dispar injected with dsGSTe2, dsGSTs1, dsGSTs2 and dsGSTz1 respectively at 72 h. * showed significantly difference between treatments and control group by student's t test at 0.05 level; ** showed significantly difference between treatments by student’s t test at 0.01 level.
3 结论与讨论
植物次生物质能影响昆虫取食、生长发育、繁殖,甚至对昆虫有毒杀作用。这些次生物质能够诱导昆虫体内解毒酶活性发生变化(陈澄宇等, 2015)。GST家族作为昆虫三大解毒酶系之一,在抵御植物次生代谢物胁迫的过程中发挥着重要的解毒作用(Weinholdetal., 1990)。次生代谢物进入昆虫体内后,GST可保护昆虫细胞抵御有毒物质的侵害,同时在抗氧化和运输内生性亲脂化合物上发挥着不可替代的作用(Lietal., 2007)。Zhang等(2018)通过饲喂方式沉默亚洲玉米螟OstriniafurnacalisOfGST1,幼虫取食含dsOfGST1和6-甲氧基-2-苯并噁唑酮的饲料,死亡率高达54.00%,表明GST1在亚洲玉米螟的解毒过程中具有重要作用(Zhangetal., 2018);研究报道舞毒蛾幼虫经芦丁和水杨苷饲喂后,LdGSTe1、LdGSTd1、LdGSTo1和LdGSTz1基因的表达被诱导,且经水杨苷处理后LdGSTz1基因转录水平是对照的29.24倍(Maetal., 2021);陈锐等(2020)发现抗虫品种科农1006小麦中阿魏酸含量高于其它感虫品种,阿魏酸能够诱导麦红吸浆虫Sitodiplosismosellena体内GST家族基因的表达(陈锐等, 2020)。本文利用RNAi介导技术分别有效沉默舞毒蛾LdGSTe2、LdGSTs1、LdGSTs2和LdGSTz1基因,注射LdGSTsdsRNA处理组幼虫的体重显著低于注射dsGFP对照组舞毒蛾体重。进一步分析舞毒蛾幼虫营养利用指标显示,注射dsGSTs处理组的RGR、RCR、ECI均显著低于对照组dsGFP。但注射dsGFP与dsGSTs舞毒蛾幼虫存活率均在90%以上,差异不显著,这表明GST基因表达量降低对舞毒蛾幼虫存活无影响,但对舞毒蛾幼虫生长发育产生影响。
王晓丽等(2014)将单宁酸、绿原酸分别饲喂舞毒蛾2龄幼虫后蜕皮困难,不能正常生长发育,分别饲喂水杨酸和丁香酸后产卵率显著降低(王晓丽等, 2014)。Yang等(2017)对稻飞虱Nilaparvatalugens若虫饲喂dsNlGSTD1,dsNlGSTE1和dsNlCE3 d后,继续饲喂含阿魏酸的饲料3 d,发现若虫死亡率显著高于饲喂对照饲料的若虫,死亡率分别提高了92.90%、119.90%和124.6%,表明沉默NlGSTD1、NlGSTE1和NlCE增强了阿魏酸对稻飞虱的毒性(Yangetal., 2017)。分别沉默LdGSTe2、LdGSTs1、LdGSTs2和LdGSTz1后,饲喂含次生物质黄酮和槲皮素的人工饲料,注射dsGSTe2、dsGSTs1、dsGSTs2和dsGSTz1基因的舞毒蛾体重同注射dsGFP对照组相比分别下降了6.25%~19.17%和7.38%~14.35%,幼虫取食黄酮和槲皮素的人工饲料后存活率分别为对照的62.97%~71.43%和62.85%~83.33%,舞毒蛾幼虫存活率、体重显著下降,这可能与解毒酶活性降低有关。GST解毒酶活性降低使舞毒蛾对植物次生物质的敏感性增加,导致寄主适应性降低。因此,LdGSTe2、LdGSTs1、LdGSTs2和LdGSTz1可能参与了黄酮和槲皮素的代谢和解毒,舞毒蛾GST基因沉默通过抑制取食和消化过程降低幼虫体重,进而影响舞毒蛾幼虫的生长发育,导致死亡率上升。

