外源补充多巴胺对异色瓢虫突变体gr生长发育及鞘翅颜色的影响
陈明娟,刘长仲,保吉婷,唐 蓉,刘 韬,孙元星*
(1. 甘肃农业大学植物保护学院,兰州 730070;2. 甘肃省农作物病虫害生物防治工程实验室,兰州 730070)
异色瓢虫Harmoniaaxyridis是一种重要的捕食性天敌,在农林害虫生物防治中具有广泛应用。该瓢虫具有丰富的鞘翅色斑变化,我国目前已发现200余种鞘翅色斑型(Koch, 2003; 李佳琳等, 2011; 赵天璇和袁明龙, 2017)。研究表明,瓢虫鞘翅色斑变化在环境适应(如温度)中发挥着重要作用,是研究色素沉积与环境适应的重要模式昆虫(Michieetal.,2011)。异色瓢虫鞘翅上的色斑通常由黑色(黑底型,Melanic)或者淡黄色(又称非黑底型,Non-melanic)作为底色,镶嵌以黑色或者红色圆点状色块(Dobzhansky, 1933),其中黑色部分主要由黑色素沉积形成(Bezzeridesetal., 2007)。
在昆虫整个黑色素合成代谢过程中,多巴胺(dopamine, DA)处于黑色素代谢通路的中心结点,其含量的累积会造成黑色素合成通路的增强,进而加深黑化程度(Arakaneetal., 2009; Shamimetal., 2014)。具体代谢过程为:酪氨酸在酪氨酸羟化酶(tyrosine hydroxylase, TH)的作用下转化为多巴(dopa),然后在多巴脱羧酶(DDC)的作用下转化为DA,一方面积累形成黑色素进而产生黑化体色;另一方面在N-乙酰转移酶(arylalkylamine N-acetyl transferase, aaNAT)的作用下生成N-β丙酰多巴胺(N-β-alanyl dopamine, NBAD)等黄色化合物和N-乙酰多巴胺(N-acetyl dopamine, NADA)等无色化合物(朱福兴和王沫, 2007)。此外,多巴胺还参与调控昆虫的取食学习、交配发育、睡眠嗅觉等多种生理反应和行为过程(吴顺凡等, 2013; Lagiszetal., 2016; Kadow, 2019),其浓度在生物体内是被严格调控的(徐刚和叶恭银, 2020)。有研究表明地中海实蝇Ceratitiscapitata突变品系表皮中因缺少NBAD而呈现为无色或透明,并造成骨化不正常(Pabloetal., 1996);张元建等(2009)发现甜菜夜蛾Spodopteraexigua黑化品系在生长发育、存活率、产卵量等方面均优于正常品系,种群增长指数也明显提高,并发现外源补充DA可以使甜菜夜蛾正常品系体色变黑。上述研究表明黑色素合成途径某些关键基因突变造成的物质含量变化对昆虫体色及生长发育具有重要影响。
目前有关异色瓢虫黑色素代谢途径已有较多研究(Chenetal., 2019; Zhangetal., 2020),表明DA为主要的合成前体,但针对DA对其生长发育的影响尚不清楚。本实验室前期发现一异色瓢虫浅色突变体gr,体色较野生型浅,经检测发现其幼虫表皮的多巴及DA含量与野生型相比具有显著差异,表现为黑色素合成通路异常;遗传学试验证明gr为单基因隐性突变体。此外,gr在生长发育方面也与野生型具有明显差异(羽化率、新羽化成虫体重及生殖力均显著低于野生型)。结果表明,该黑色素合成途径关键基因与适合度紧密相关,具有明显的多效性(Sunetal., 2018a)。本研究以添加不同浓度DA的人工饲料饲喂异色瓢虫突变体gr,测定幼虫各龄期的存活率、发育时间、新羽化成虫体重及鞘翅颜色参数,以明确DA对该突变体幼虫生长发育是否会造成影响,同时明确幼虫期补充DA能否有助于恢复成虫鞘翅黑色斑点的颜色。研究结果将为进一步探究异色瓢虫鞘翅黑化的形成机理及与生物学特性的关联机制奠定基础。
1 材料与方法
1.1 供试昆虫
异色瓢虫突变体gr在实验室(温度25℃±1℃,光周期L ∶D=16 ∶8)条件下长期使用桃蚜Myzuspersicae进行饲养。桃蚜为相同条件下长期饲养于辣椒苗上的种群。
1.2 人工饲料配制
供试人工饲料主要成分为猪肝及蜂蜜,参照Sun等(2018b)的配方配制并进行改进,具体成分及配比见表1。配制饲料时,首先将猪肝粉、酵母粉与食用油于250 mL烧杯中充分搅拌均匀,然后将其他成分溶解于10 mL蒸馏水中并与前者混合,充分搅拌形成基础人工饲料。用万分之一天平准确称取DA标准品溶解于蒸馏水中,并依次稀释添加入基础人工饲料中(5 mL),形成3个不同DA浓度的饲料(10 mg/g,1 mg/g与0.1 mg/g,依次简称D-H,D-M与D-L),以未添加DA的饲料作为对照(CK)。将配制好的人工饲料分装于1.5 mL的离心管内,做好标记后保存于-20℃冰箱内备用。

表1 异色瓢虫人工饲料各组分含量
1.3 异色瓢虫幼虫饲养
分别将两对异色瓢虫突变体成虫饲喂在直径为9 cm的培养皿内,每天提供充足的桃蚜并收集所产卵,将卵孵育在直径为3 cm的培养皿内(提供一浸透水的棉球保湿)。每天观察卵的孵化情况,所得1龄幼虫用于后续试验。试验在人工气候箱内进行(温度25℃±1℃,光周期L ∶D=16 ∶8,相对湿度60%±10%)。
将孵化后12~24 h的1龄幼虫单头饲养在直径为3.5 cm的培养皿内,每天提供充足的人工饲料和水分,观察并统计幼虫的龄期及存活情况,每2 d更换一次饲料。前期预试验发现,直接将幼虫饲养在人工饲料上,低龄(1~2龄)幼虫的死亡率极高(大于90%)。因此,本试验首先将1龄幼虫用桃蚜分别饲喂至2龄或4龄后,再使用人工饲料进行饲喂(以获得大量成虫),并统计相关数据。待幼虫化蛹后,每天观察成虫的羽化情况。统计各龄幼虫的存活率及发育历期、羽化率及新羽化成虫体重(羽化后24~36 h,精确到0.1 mg),并将新羽化成虫保存在-80℃冰箱内,用于测定鞘翅的颜色参数。
1.4 成虫鞘翅的颜色分析
从冰箱取出冷藏的异色瓢虫突变体成虫样品,用尖头镊子取下左鞘翅,在体视显微镜下使用相同光照条件进行拍照。将照片导入Adobe Photoshop CS6软件中,统计鞘翅黑色斑点的HSB平均值[Hue(色调),Saturation(饱和度),Brightness(明亮度)]。
1.5 数据分析
试验所得数据利用SPSS 19.0软件进行分析。其中,存活率采用4×2联表进行分析(Sighinolfietal., 2013),其他参数采用单因素方差分析进行比较,采用Tukey HSD法进行多重比较(P<0.05)。使用Excel作图。
2 结果与分析
2.1 外源补充多巴胺对幼虫生长发育的影响
2.1.1桃蚜饲喂至2龄后取食人工饲料
对照组幼虫无法成功发育至3龄(部分个体发育至蜕皮但未成功),取食添加DA的人工饲料后,各处理的存活率随龄期增加均呈下降趋势。其中,在2~3龄及3~4龄的发育过程中,3个饲料处理间无显著差异(χ2=0.46~2.83,P=0.09~0.50),仅有30%的4龄幼虫可发育至蛹期(图1)。
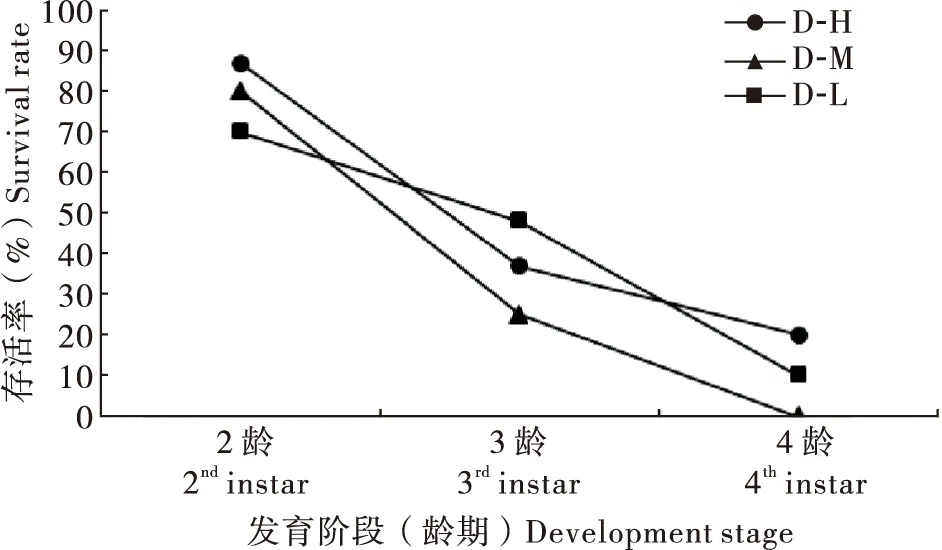
图1 异色瓢虫突变体gr取食不同饲料后的存活率Fig.1 Survival rate of Harmonia axyridis mutant gr feeding on different diets注:D-H、D-M与D-L分别表示多巴胺添加浓度为10 mg/g、1 mg/g与0.1 mg/g的人工饲料,下同。Note: D-H, D-M, and D-L respectively represented artificial diet with a dopamine concentration of 10 mg/g, 1 mg/g and 0.1 mg/g, the same below.
在2~3龄发育过程中,D-L处理幼虫的发育历期显著短于D-H与CK处理(F3, 86=4.971,P=0.003);在3~4龄发育过程中,D-L处理幼虫的发育历期显著短于D-H与D-M处理(F2,64=8.310,P=0.001);在4龄~蛹的发育过程中,各饲料处理的发育历期均无显著差异(F2,27=2.396,P=0.110),但D-L处理短于D-H和D-M处理(图2)。
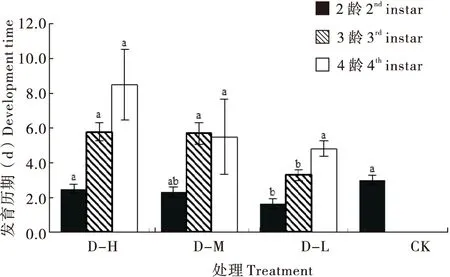
图2 异色瓢虫突变体gr取食不同饲料后的发育历期Fig.2 Development time of Harmonia axyridis mutant gr feeding on different diets注:不同小写字母表示某一龄期幼虫的发育历期在不同饲料处理之间具有显著差异(P<0.05)。Note: Different lowercase letters represented a significant difference of the larval developmental time of a given instar among different treatments (P<0.05).
2.1.2桃蚜饲喂至4龄后取食人工饲料
在4龄发育过程中,取食D-M的幼虫全部发育至蛹期,显著高于D-H处理(72%)(χ2=6.02,P=0.014),但均与D-L及CK处理差异不显著(χ2=1.51~3.47,P=0.06~0.22)。在蛹期发育过程中,取食D-M与D-L的成虫羽化率分别为83.3%和82.6%,稍高于D-H与CK处理(66.7%与71.4%),但均差异不显著(χ2=0.004~1.40,P=0.24~0.95)(图3)。
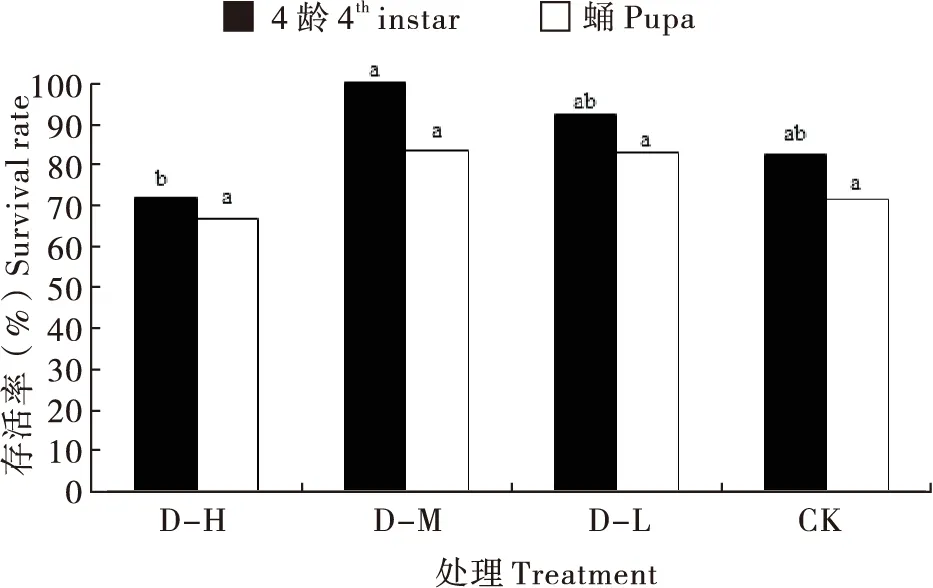
图3 异色瓢虫突变体gr取食不同饲料后的存活率Fig.3 Survival rate of Harmonia axyridis mutant gr feeding on different diets注:不同小写字母表示某一龄期幼虫的存活率在不同饲料处理之间具有显著差异(P<0.05)。Note: Different lowercase letters represented a significant difference of the larval survival rate of a given instar among different treatments (P<0.05).
4龄及蛹期的发育时间在各处理间无显著差异(4龄:F3, 64=1.781,P=0.160;蛹:F3, 59=1.297,P=0.284),其中,饲喂D-M的4龄幼虫的平均发育时间为7.2 d,稍长于其它3种饲料处理(D-H:6.1 d;D-L:5.8 d;CK:6.4 d)(图4)。
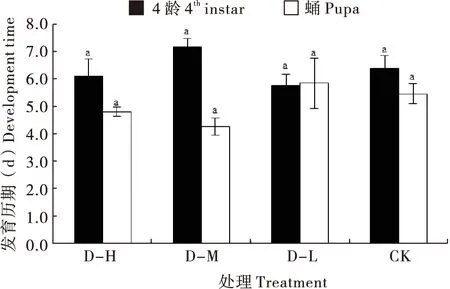
图4 异色瓢虫突变体gr取食不同饲料后的发育历期Fig.4 Development time of Harmonia axyridis mutant gr feeding on different diets注:相同小写字母表示某一龄期幼虫的发育历期在不同饲料处理之间无显著差异(P>0.05)。Note: Same lowercase letters represented larval developmental time of a given instar among different treatments had no significant differences (P>0.05).
取食不同饲料后,新羽化雌雄成虫体重在各处理间均无显著差异(雌:F3, 20=0.405,P=0.751;雄:F3, 20=0.153,P=0.927),但D-M处理中雌成虫的平均体重(17.5 mg)和雄成虫的平均体重(10.8 mg)均稍高于其它3种饲料处理(图5)。
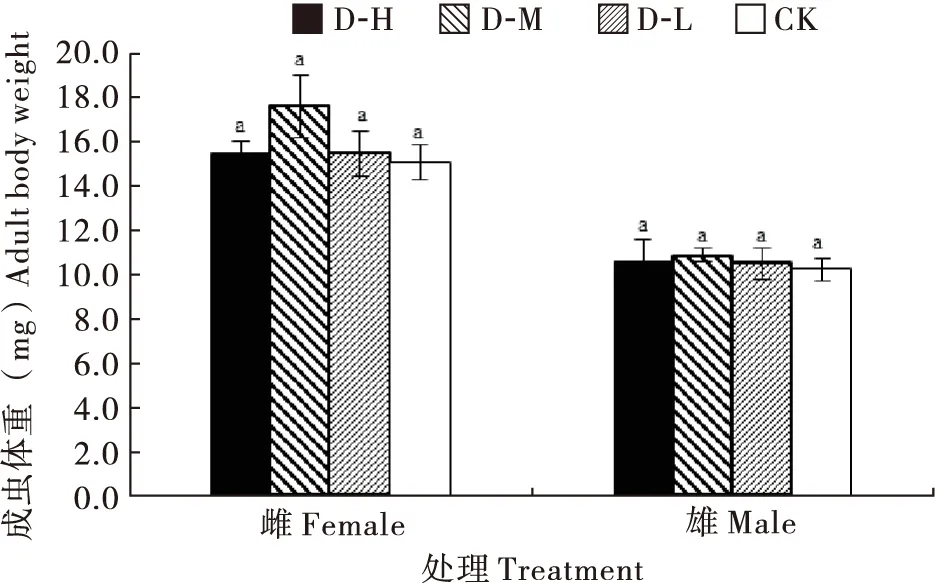
图5 不同饲料饲喂下异色瓢虫突变体gr成虫的体重Fig.5 Body weight of Harmonia axyridis mutant gr feeding on different diets注:相同小写字母表示雌雄成虫体重在不同饲料处理间无显著差异(P>0.05)。Note: Same lowercase letters represented male and female adult body weights among different treatments has no significant differences (P>0.05).
2.2 外源补充多巴胺对鞘翅颜色参数的影响
鞘翅黑色斑点的Saturation值(饱和度)在不同处理间无显著差异(F3, 88=1.269,P=0.290);D-M处理成虫鞘翅黑色斑点的Hue值(色调)显著高于其它3个处理(F3, 88=4.231,P=0.008);Brightness值(亮度)在各处理间均无显著差异,但D-L处理的Brightness值均低于其它3个处理(F3, 88=2.652,P=0.054)(图6)。
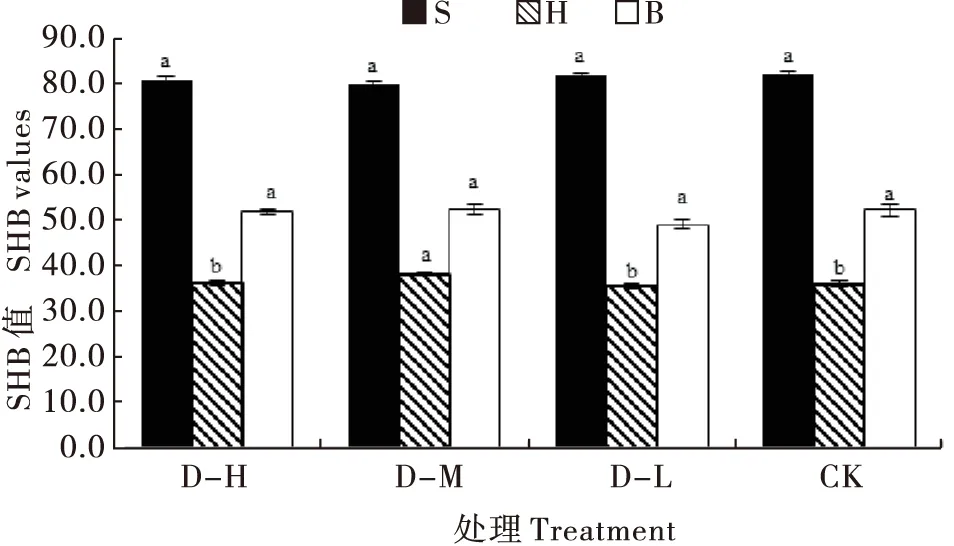
图6 不同饲料饲养新羽化成虫鞘翅黑色部分颜色参数(SHB值)Fig.6 The SHB values of the elytra dark spots of newly emerged adults feeding on different diets注:不同小写字母表示某一颜色参数在不同饲料处理间具有显著差异(P<0.05),S、H和B分别表示饱和度、色调和亮度。Note: Different lowercase letters represented a certain parameter among different treatments had significant differences (P<0.05), S, H and B respectively represented saturation values, hue values and brightness values.
3 结论与讨论
在本试验中,使用未添加DA的饲料(CK)饲喂gr2龄幼虫,均不能成功发育至3龄。前期研究中用相同人工饲料饲喂野生型异色瓢虫1龄幼虫,超过80%的2龄幼虫可发育至3龄(Sunetal., 2018b)。上述结果表明,gr幼虫可能对人工饲料的营养利用具有缺陷,但取食添加DA的人工饲料后,超过69%的gr2龄幼虫可发育至3龄,且D-H处理最高(87%)。此外,利用添加DA的人工饲料饲喂gr4龄幼虫,各处理所得成虫的平均体重均高于CK处理;D-M与D-L处理的羽化率高于CK处理。上述差异可能是DA促进gr幼虫取食量的增加,进而提升了营养水平。在果蝇Drosophilamelanogaster中的研究表明,DA能够调控饥饿个体或已饱个体的觅食行为(Tsaoetal., 2018),在应对饥饿状态中起着重要作用。以上结果表明DA对异色瓢虫的幼虫存活率、成虫体重和羽化率具有促进作用。
此外,本试验发现DA对异色瓢虫的影响程度还取决于添加浓度。使用人工饲料饲喂发育至2龄的幼虫,D-L处理的3龄幼虫发育时间显著短于D-H与D-M。此外,使用D-M饲喂发育至4龄幼虫时,化蛹率及羽化率均高于其它3种饲料处理,且新羽化雌雄成虫的平均体重均高于其它3种饲料处理。使用人工饲料饲喂发育至4龄幼虫时,D-L饲喂下的幼虫发育时间均短于其它饲料处理。上述结果表明中低浓度的DA适于异色瓢虫生长发育,浓度过高可能会影响取食或营养摄取及吸收。DA浓度影响gr生长发育可能具有如下原因:首先,DA在昆虫体内是一种神经递质,其浓度是被严格调控的,浓度过高过低都将扰乱相应的信号通路,引起昆虫死亡或发育不良(Fuchsetal., 2014; Conleyetal., 2015; Bai and Palli, 2016)。其次,研究表明DA还可直接或间接调节其他激素的水平。体内DA浓度变化造成相关激素的浓度变化过大同样会影响昆虫的生长发育(Gruntenkoetal., 2005; 路玉婷, 2016; 杨文豪, 2018)。本试验饲喂发育至4龄的幼虫时,D-L饲喂下的幼虫发育时间均短于其他饲料处理。上述结果表明中低浓度多巴胺适于异色瓢虫生长发育。
本试验还发现在异色瓢虫突变体gr幼虫人工饲料中添加DA可促进成虫鞘翅黑色素的沉积,但仍受添加浓度的影响。D-L处理成虫鞘翅黑色斑点的Brightness值最小(颜色最黑),低于其他3种饲料处理。作为一种表皮着色的中间底物,DA在众多昆虫体色表型上起决定性作用,是昆虫体内重要的黑色素合成前体物质(Walteretal., 1996)。本研究表明,在异色瓢虫突变体幼虫食物中低浓度补充DA有利于恢复成虫鞘翅黑色斑点的颜色。前期也有研究表明在食物中添加类胡萝卜素(另外一类重要的体色色素)可恢复瓢虫Coleomegillamaculata突变体鞘翅黄-红色部分的颜色(Allen, 2016)。近年来,随着组学(Sunetal., 2017; Pietrantonioetal., 2018)、实时成像等分子生物学技术的发展流行,大量研究表明DA合成通路的关键酶TH和DDC在参与调控昆虫翅斑的形成(Luetal., 2019)、蛹的黑化(melanization)(张道伟等, 2019)和翅鳞的颜色形成(Matsuoka and Monteiro, 2018)等生理过程中发挥重要作用。因此,在以后的研究中,从两个合成关键酶着手可进一步揭示DA在异色瓢虫中的作用及其调控机理。
综上所述,外源补充黑色素合成底物DA可影响异色瓢虫突变体gr幼虫的生长发育,并可影响成虫鞘翅黑色素的沉积。本研究结果对进一步探究DA调控异色瓢虫表型及与生物学特性的关联机制具有重要意义。

