间充质干细胞膜包被的仿生纳米载体的构建及其对巨噬细胞极化基因表达影响的研究
李家琳, 苏俭生
(上海牙组织修复与再生工程技术研究中心,同济大学口腔医学院,同济大学附属口腔医院口腔修复科,上海 200072)
细胞膜包被的仿生纳米载体是利用细胞膜包被纳米技术(cell membrane coating nanotechnology),将天然细胞的细胞膜融合到核心微纳米颗粒上所构建的仿生纳米递送体系[1]。这些双层结构的仿生纳米载体在保留核心纳米载体自身理化性能的同时, 其细胞膜结构还能继承类似于原始细胞的生物学功能,在利用细胞膜特性及源细胞生物功能的同时, 搭载纳米颗粒,负载药物或因子,发挥抗炎、减伤、生物解毒等作用。目前,已成功构建的仿生纳米载体所采用的细胞膜来源包括中性粒细胞、巨噬细胞、红细胞、干细胞及其他细胞如细菌、血小板、癌细胞等[2-4]。
近年来的研究发现,巨噬细胞极化在炎症调节和修复过程中发挥着重要的作用。 通过促进巨噬细胞经典活化M1 型向替代活化M2 型的表型转换,能够促进炎症由损伤走向修复的进程,这一点在牙周炎这一口腔医学领域中最常见的慢性细菌感染性疾病中也得到了验证[5-7]。 姜黄素(curcumin,Cur)是一种天然抗炎、抗氧化及抗肿瘤的多酚类药物[8-9],被证实能够诱导巨噬细胞向M2 型的极化[10]。 但游离的Cur 仍存在生物利用度低、水溶性差、代谢消除速率过快等不足。 此外,组织工程技术在牙周炎中的作用也不容小觑。间充质干细胞(mesenchymal stem cells, MSCs)作为组织工程的种子细胞,近来研究发现还可表现出较强的免疫调节功能。 其膜结构在组织再生和细胞交流中均具有重要作用[11],能够趋向炎症、肿瘤等部位,参与到免疫抑制、抗炎、和维持组织稳态的过程中[12]。
基于此, 本实验拟构建负载Cur 的MSCs 细胞膜包被的聚乳酸-羟基乙酸共聚物(PLGA)纳米颗粒(Cur-loaded, MSCs membrane-coated poly [lacticco-glycolic]nanoparticles,Cur-PLGA-NPs),利用 MSCs细胞膜趋向炎症部位行使细胞膜相关的抗炎和骨保护功能;同时利用纳米核心,在炎症微环境中释放Cur,调控巨噬细胞向M2 型极化。
1 材料和方法
1.1 主要仪器和试剂
姜黄素(MCE 公司,美国);PLGA(75:25,相对分子质量 30 000;济南岱岗公司,中国);DMEM 培养基、α-MEM 培养基、0.25%胰蛋白酶、磷酸缓冲盐溶液(phosphate buffered saline,PBS;HyClone 公司,美国);胎牛血清(FBS;Gibco 公司,美国);逆转录试剂盒、RT-PCR 试剂盒、TRIzol(TaKaRa 公司,日本);CCK-8 试剂盒、BCA 试剂盒、 考马斯亮蓝快速染色液(碧云天公司,中国);脂质体挤出器(Avanti Lipids 公司,美国);聚碳酸酯膜(200 nm、400 nm;Whatman 公司,美国);Dounce 匀浆器(Sigma 公司,美国);超速离心机(Beckman 公司,美国);Zetasizer Nano ZS 粒度分析仪(Malvern 公司,英国)。
1.2 方法
1.2.1 细胞培养 麻醉并处死2~3 周龄的SD 大鼠,用注射器冲洗去除骨骺端的股骨及胫骨新鲜骨髓腔至含有10%胎牛血清及1%青霉素、链霉素的α-MEM培养基中, 并于37 ℃、5% CO2的细胞培养箱中培养,间隔2~3 d 换液。待细胞密度80%~90%时胰蛋白酶消化法传代。 后续实验均选用第3 代细胞进行。
1.2.2 MSCs 细胞膜的分离 采用Yang 等[13]的MSCs细胞膜分离方法获得大鼠骨髓间充质干细胞膜囊泡(mesenchymal stem cells plasma membranes, MSCPMs)。 胰酶消化收集对数生长期的MSCs, 用冰的PBS 清洗2~3 次后收集于3 mL 分离缓冲液中,4 ℃1 000×g 离心 5 min 收集沉淀。 之后将沉淀转移至Dounce 匀浆器的匀浆缓冲液中,冰浴条件下反复研磨 20~30 次充分匀浆裂解细胞,4 ℃ 3 500×g离心 5 min,保留上清,去除沉淀于底层的细胞器等。 随后,上清液 4 ℃ 100 000×g 超速离心 1 h,收集侧壁沉淀获得间充质干细胞膜,将其分散于PBS中,-80 ℃短期保存。使用脂质体挤出器挤压干细胞膜, 依次选用 400、200 nm 的聚碳酸酯膜, 制备约200 nm 粒径的干细胞膜囊泡备用。
1.2.3 Cur-PLGA-NPs 的制备 通过乳化-溶剂挥发法制备负载Cur 的PLGA 纳米颗粒。 称取20 mg PLGA 及2 mg Cur 充分搅拌溶解于1 mL 二氯甲烷及丙酮的混合溶剂中。 将溶液逐滴加入高速搅拌的2%聚乙烯醇(polyvinyl alcohol, PVA)水溶液中,冰浴下超声15~20 min 形成初乳。 将初乳逐滴加入0.5%的PVA 溶液中,过夜挥发去除有机溶剂。 5 500 r/min离心10 min 去除大颗粒沉淀, 取上清于 4 ℃、20 000 r/min 高速离心,收集纳米粒。蒸馏水洗涤2~3 次后分散在少量蒸馏水中,冻干机过夜冻干,得到Cur-PLGA-NPs。 重复上述方法制备不含Cur 的空白纳米粒。
1.2.4 PM-NP-Cur 的合成 将过量的MSC-PMs 与Cur-PLGA-NPs 充分混合均匀,质量比约 1∶2,将混合物溶液装入脂质体挤出器中,反复挤压通过400、200 nm 孔径的聚碳酸酯膜。为使纳米粒子被干细胞膜充分包被,实验中反复挤压约20~25 个循环。 挤压完成后离心去除未包载的干细胞膜囊泡, 获得MSCs 膜包被的 PLGA 纳米颗粒(PM-NPs)。
1.2.5 PM-NP-Cur 的粒径及形貌表征 将10 μL适当浓度的样本滴于铜网静置, 用1%磷钨酸溶液负染后于透射电子显微镜下分析观察。 使用动态光散射仪(DLS)评估 Cur-PLGA-NPs 及 PM-NPs 的粒径分布、zeta 电势 (zeta potential) 和多分散指数(polydispersity index, PDI)。
1.2.6 MSC-PMs 表面蛋白的鉴定 BCA 试剂盒定量分析制备的MSC-PMs 和PM-NPs 的蛋白浓度。 取总蛋白含量相同的样品20 μL,使用Bio-Rad 凝胶电泳系统在10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE) 凝胶中进行凝胶电泳实验。待电泳条带分离后,将电泳好的凝胶取下,置于托盘内,加入蒸馏水摇床清洗。之后使用考马斯亮蓝超快速染色液进行染色2 h。 染色后倒入脱色液过夜脱色,反复脱色2~3 次待凝胶背景清晰透明后拍摄。
1.2.7 PM-NP-Cur 的包封率及载药率测定 取1 mg Cur 溶解于1 mL 丙酮中, 酶标仪测定425 nm 处紫外吸光度, 绘制Cur 的浓度-紫外吸光度标准曲线。取Cur-PLGA-NPs 及PM-NPs 分散于去离子水中,超声振荡破乳,收集上清液,加入丙酮定容,酶标仪测定425 nm 处吸光度值,计算游离药物含量。 按照如下公式计算包封率 (encapsulation efficiency,EE%)及载药量(loading content,LC%)。
EE%=纳米粒中装载的药物总量/初始投药量×100%
LC%=纳米粒中装载的药物总量/载药纳米粒总质量×100%
1.2.8 PM-NP-Cur 的体外释放曲线及稳定性分析 取1 mL PM-NP-Cur 溶液(10 mg/mL 的 PBS 溶液)置于透析袋内(相对分子质量7 000),将透析袋放入50 mL PBS 缓冲液中,37 ℃水平恒温振荡透析, 于不同的时间间隔取袋外1 mL 溶液测定吸光度, 计算析出药物浓度,再补入同样体积的PBS 缓冲液。 在每一个预设的时间点重复上一步骤。 绘制时间-药物累积释放量曲线。
1.2.9 PM-NP-Cur 对RAW264.7 巨噬细胞的细胞毒性测定 将生长良好的RAW264.7 巨噬细胞以5×103个/孔接种于96 孔板中。配置不同浓度的PMNP-Cur 纳米粒于完全培养基中,每孔加入完全培养基 100 μL。 将 96 孔板置于 37 ℃、5%CO2培养箱中培养24 h 后用CCK8 试剂盒测定吸光度值。
1.2.10 qPCR 分 析 PM-NP-Cur 对 RAW264.7 巨噬细胞极化相关mRNA 的表达 将RAW264.7巨噬细胞以 5×104个/孔接种于 6 孔板内,LPS(100 ng/mL)诱导 12 h 使其向 M1 型极化。 随后使用不同浓度的 PM-NP-Cur(有效药物浓度 0、5、10、15 μmol/L) 干预 12 h。 用 TRIzol 法提取细胞总RNA, 参照逆转录试剂盒说明书对获得的总RNA进行逆转录, 得到各组cDNA。 以GAPDH 作为内参基因,通过罗氏荧光定量检测仪进行实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,RT-qPCR)。 引物序列见表 1。

表1 qPCR 引物序列Table 1 qPCR primer sequences
1.3 统计学分析
各组数据使用SPSS 20.0 进行分析, 数据通过均数±标准差()表示。 应用 t 检验法比较组间差异,P<0.05 表示差异具有统计学意义。
2 结果
2.1 Cur-PLGA-NPs 的形貌表征及粒径分布
透射电镜(TEM)下Cur-PLGA-NPs 呈现分散均匀规则的球形(图1A)。 为获得最合适的包封效率,实验中考察了Cur 与PLGA 在不同投料比下纳米粒表征差异(表2、图1B)。 结果显示在其他条件恒定的情况下,随着Cur 的投药量增加,EE%减低,LC%在Cur 为3 mg 时达到峰值, 此时包封率不足40%,且聚合物分散性指数(PDI)>0.1。因此实验中综合考虑,选择投药比 Cur∶PLGA 为 2 mg∶20 mg,此条件下纳米粒平均粒径(183.2±0.8) nm。
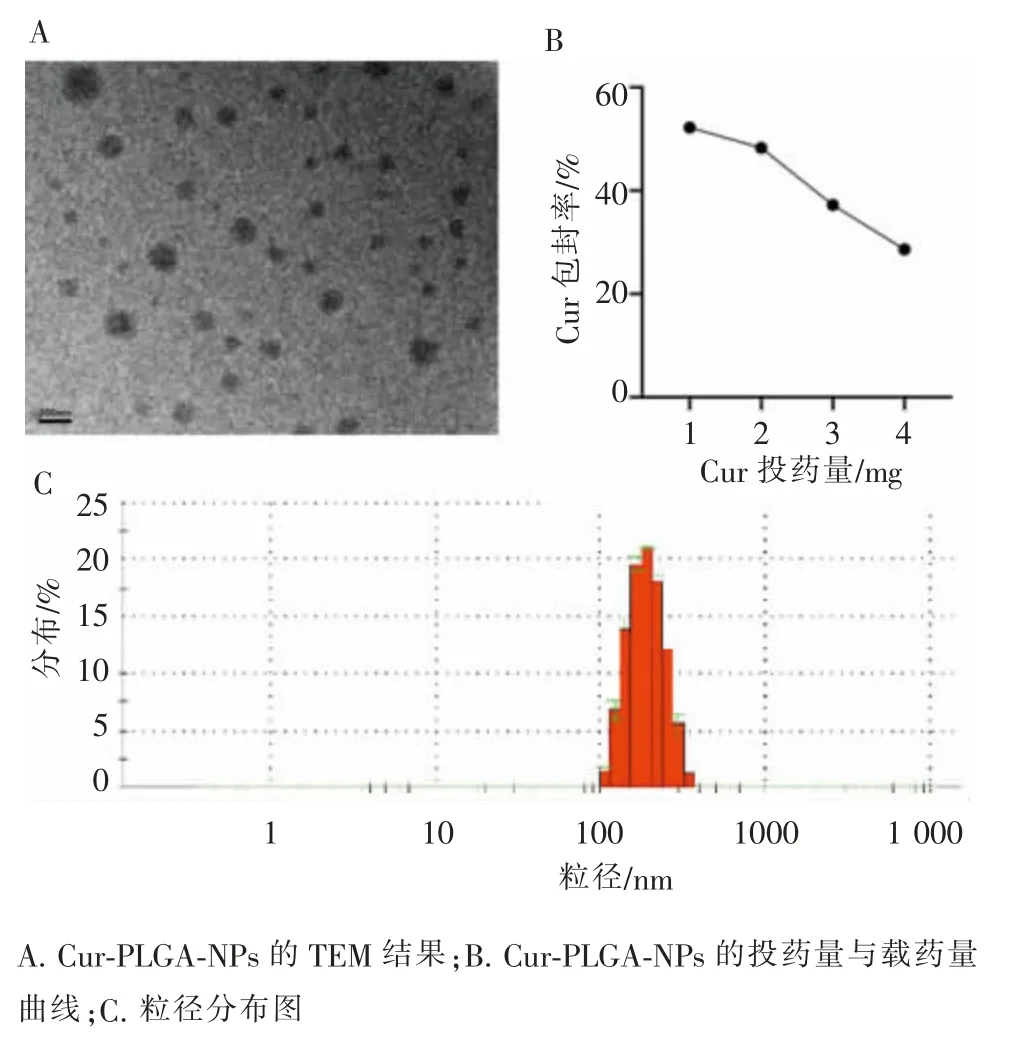
图1 Cur-PLGA-NPs 的表征Figure 1 Characterization of Cur-PLGA-NPs

表2 不同投药量对载药量和包封率的影响Table 2 The influence of different drug input on LC% and EE%
2.2 PM-NPs 的表征TEM
图像显示PM-NPs 呈现均匀、 规整的球形纳米形貌,且可见明显的核-壳结构,厚度均匀平行的脂质双分子层包裹在纳米核心的表面(图2A)。 动态光散射(DLS)测得Cur-PLGA-NPs 粒径由包裹前的(183.2±0.8) nm 增加为(204.2±3.7) nm,zeta 电势包裹前为-(8.94±0.42) mV, 经细胞膜囊泡包裹后为-(27.14±0.96) mV, 与 MSC-PMs 的 zeta 电势-(26.8±1.72) mV 相接近(图 2B)。 SDS-PAGE 凝胶电泳结果显示,PM-NPs 膜蛋白与细胞膜表面的膜蛋白基本一致,表明材料合成过程中细胞膜的完整性良好(图2D)。以上结果证明MSCs 已成功包覆在Cur-PLGA-NPs 纳米粒子的表面。

图2 PM-NPs 的表征Figure 2 Characterization of PM-NPs
2.3 PM-NP-Cur 的稳定性分析和药物释放
PM-NP-Cur 及 Cur-PLGA-NP 纳米粒在 PBS 中的粒径变化(图3A)显示纳米粒稳定性良好。 释放曲线(图3B)观察到前6 h 二者的释放行为未见明显差异, 存在前期突释情况,12~24 hPM-NP-Cur 的突释情况有所减轻。这表明PM-NP-Cur 能够更长期稳定地释放药物。

图3 PM-NP-Cur 及Cur-PLGA-NP 的稳定性分析和药物释放Figure 3 Stability and drug release profile of PM-NP-Cur and Cur-PLGA-NP
2.4 PM-NP-Cur 对 RAW264.7 巨噬细胞活性的影响
CCK8 实验结果显示PM-NP-Cur 与Cur-PLGANP 在相同浓度下对 RAW264.7 的细胞活性影响无明显差异(图 4)。 药物有效浓度在 15 μmol/L 以下时,对RAW264.7 的细胞活性无明显影响,因此选择低于15 μmol/L 用于后续实验。

图4 PM-NPs 的RAW264.7 巨噬细胞毒性实验Figure 4 RAW264.7 cell cytotoxicity test of PM-NPs
2.5 PM-NP-Cur 对RAW264.7 不同表型细胞相关基因表达的影响
脂多糖(lipopolysaccharide,LPS)刺激下,RAW264.7巨噬细胞M1 型相关炎症因子iNOS、IL-1β 表达升高。 与LPS 刺激组相比,应用PM-NP-Cur 的实验组iNOS、IL-1β 的表达降低。 而 M2 型相关基因 Arg-1、IL-10、CD206 表达均增高, 且随着 PM-NP-Cur 浓度的升高呈正向变化(图 5,P<0.05)
3 讨论
随着微纳米载体的迅速发展,其展现出良好的治疗牙周疾病的潜力。 一方面,其纳米级的尺寸与DNA 和蛋白质等生物大分子相近,通过设计特定的尺寸、形状、表面属性,纳米粒可以穿过牙周袋,甚至到达牙槽骨骨小梁,有选择性地、精确地被输送到作用部位[14]。 另一方面,虽然纳米颗粒载体的优点已经明确, 其仍需躲避机体内非特异性清除及调理素作用,以达到在牙周组织中药物的长期稳定释放[15]。
基于上述需求,运用天然细胞膜进行生物伪装的纳米仿生载体近年来已有诸多研究。 除原有的理化性能外,这些纳米颗粒还能够继承源细胞膜的生物学特性及相关抗原与标志物位点,在机体微环境中,充当诱饵,吸收并中和病理分子[1,16]。同时还可以有效避免免疫清除的过程,利用细胞膜的结构和功能特性, 靶向作用于源细胞相关的效应细胞或组织,有利于药物持久、有效、特异性地靶向释放。 相较于单一使用天然细胞或模拟天然细胞膜的脂质体,天然细胞膜包被的纳米颗粒还在避免免疫吞噬的同时稳定药物运输的过程, 有益于后期临床应用。 Yang 等[13]利用人脐带间充质干细胞膜包被聚合物纳米粒进行小鼠体内肿瘤的靶向治疗;Zhang 等[4]利用中性粒细胞的旁分泌作用, 即分泌胞外微囊泡,制备了中性粒细胞包膜纳米粒并与诱导关节炎症的股骨头外植体共培养,观察到该纳米粒能够穿入滑膜腔, 靶向炎症关节区发挥抑制滑膜炎症、减轻关节损伤、并促进软骨修复再生等作用。
材料的设计从牙周炎损伤的修复出发, 应用MSCs 细胞膜包裹载有Cur 的PLGA 纳米粒,希望利用MSCs 靶向牙周炎症中骨组织炎症部位, 促进组织修复,并通过纳米粒核心释放Cur,促进向M2 型巨噬细胞的极化。 MSCs 具有较低的免疫原性、较强的免疫抑制及调节、抗炎等作用[17],同时MSCs 的膜结构在组织再生和细胞交流中也具有重要作用[18]。通过直接或间接接触的方式使MSCs 和巨噬细胞共培养, 发现MSCs 可以促进巨噬细胞的极化[19];MSCs的膜外囊泡或外泌体能够定位CD206 阳性的M2型巨噬细胞,靶向炎症部位[12]。姜黄素亦被证实在活化PPAR、促进巨噬细胞极化中起到重要作用[10]。本实验就这一材料的构建及其体外诱导巨噬细胞极化的能力进行了研究。
实验中采用乳化-溶剂挥发法制备纳米核心,并筛选出最优投料比。 其中溶剂采用丙酮和二氯乙烷的混合溶剂, 有利于后续超声过程中乳剂的形成,并防止滴入PVA 时造成药物过量损失。 合成PMNP-Cur 的过程主要通过重复物理挤压法,从蛋白电泳结果中可以看出这一过程前后,细胞膜表面蛋白无明显损耗,这也为后续体内试验保留材料的生物活性奠定了基础。 从药物释放曲线中可以看出,在纳米粒稳定性基本一致的情况下,有干细胞膜包被的纳米粒子早期向溶液中释放的药物较无细胞膜的PLGA 纳米粒要少,表明其前期突释过程在细胞膜的包裹下有所减缓,这也有利于药物在体内长期稳定释放, 有利于维持局部组织中的有效药物浓度。
qPCR 结果显示,与经过LPS 刺激的RAW264.7巨噬细胞相比,PM-NP-Cur 在适宜的浓度下能够有效抑制M1 型巨噬细胞相关炎症基因的表达, 且随着PM-NP-Cur 中有效药物浓度的提升,呈现出剂量依赖性。 这一过程中实验探索的药物有效浓度小于15 μmol/L,而据文献报道,单一使用姜黄素时,这一浓度约在25~30 μmol/L。 这一结果的差异可能与纳米粒核心 PLGA 代谢产生的部分酸性产物有关。 这一结果表明,PM-NP-Cur 在不影响细胞活性的前提下,增加药物浓度能够促进向M2 型巨噬细胞极化。
综上所述,本实验成功构建了间充质干细胞膜包被的载有姜黄素的PLGA 纳米颗粒,其稳定性及生物相容性良好, 且能够有效地促进巨噬细胞向M2 型极化, 为之后用于牙周炎的体内治疗提供了实验基础。

