AEG-1在食管鳞癌组织中异常高表达的上皮间质转化调节机制及其临床意义*
卢军城 何基明 王翔锋 佘志廉 陈阳天 倪晨辉
福建中医药大学附属人民医院,福建省福州市 350000
星形细胞上调基因-1(Astrocyte elevated gene-1,AEG-1),也称转移黏附因子,是近年较为热门的原癌基因[1]。AEG-1基因最初是在人类免疫缺陷病毒感染的人胚胎初级星形细胞中发现的[2]。2002年,su等首先克隆AEG-1,现今,越发成为癌症发生发展中的研究热点[3]。AEG-1基因在正常组织中表达量较低,甚至不表达,而在恶性肿瘤细胞中多见高表达,且在肿瘤的发生、发展中起重要作用。AEG-1目前在食管鳞癌中的表达及临床意义研究尚少,且在上皮间质转化(Epithelial mesenchymal transition,EMT)中的具体作用机制尚不明确。
本研究主要通过半定量RT-PCR、Western blotting及免疫组化检测AEG-1和E-钙黏蛋白(E-cadherin)在食管鳞癌组织中不同水平的表达情况,并与肿瘤临床病理特征、相关性及预后进行分析,旨在为进一步研究其在食管癌中的功能及机制提供实验依据。
1 资料与方法
1.1 一般资料 收集2010年12月—2019年12月于我院行手术治疗的食管鳞癌患者临床资料,共收集病例532份。其中男385例,女147例,年龄35~79岁。临床分期Ⅰ期21例,Ⅱ期336例,Ⅲ期133例,Ⅳ期42例。剔除术前放化疗,且多为原发肿瘤。收集蜡块包括癌组织及癌旁组织,其中即刻收集5例手术切除的食管鳞癌组织及癌旁正常组织液氮保存。所有患者随访至2020年7月,中位随访时间5年,术后按照指南行规范的辅助治疗及复查。
1.2 试剂 AEG-1兔抗人多克隆抗体(北京博奥森公司)、E-cadherin检测试剂盒(福州迈新公司)、GAPDH兔抗人多克隆抗体(EPTOMIC公司),鼠抗兔二抗(北京中杉金桥公司),免疫组织化学试剂盒(福州迈新公司)。AEG-1引物:5’-AAATAGCCAGCCTATCAAGACTC-3’(forward);5’-TTCAGACTTGGTCTGTGAAGGAG-3’(reverse);GAPDH引物:5’-GACTCATGACCACAGTCCATGC-3’(forward);5’-AGAGGCAGGGATGATGTTCTG-3’(reverse)。
1.3 方法 常规液氮研磨肿瘤组织,使用Trizol试剂提取总RNA。-80℃保存采用逆转录酶获取的cDNA溶液。加入AEG-1引物行PCR,内参采用GAPDH。反应条件为94℃预变性30s,94℃10s、60℃30s,扩增40个循环后检测溶解曲线,每个样本设3个重复。以2-ΔΔCt来计算AEG-1mRNA的相对表达量。
按照说明书提取总蛋白,以BCA法测定蛋白浓度,中加入5×LoadingBuffer,95℃变性4min,冷却后等量上样,常规电泳分离蛋白样品,80V,待溴酚蓝进入分离胶后改120V电泳,AEG-1蛋白在分离胶中下1/3时停止。转膜,3%BSA液室温封闭1h,4℃一抗孵育过夜,二抗孵育1h,再次洗膜。滴ECL发光液孵育2min,暗室内凝胶成像显影。以GelPro分析软件测定条带灰度值,采用半定量分析。
采用免疫组化SP法,常规切片经脱蜡、脱水、水洗后,3%过氧化氢阻断内源性过氧化物酶,常规抗原修复,封闭非特异性抗原,抗AEG-1一抗工作浓度均为1∶300,抗E-cadherin工作浓度1∶250,癌旁组织做阴性对照。DAB显色,苏木素复染。采用文献所示阳性标准[4]。
1.4 统计学方法 应用SPSS22.0统计软件分析数据,对AEG-1和E-cadherin在不同临床病理特征中的表达差异行χ2检验。AEG-1表达与患者预后关系采用Kaplan-Meier生存曲线,并用Log rank检验。AEG-1与E-cadherin相关性采用Spearman秩相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 AEG-1表达结果与食管癌临床病理的相关性 运用半定量RT-PCR法检测所收集5例新鲜食管鳞癌及癌旁正常组织中AEG-1 mRNA的表达情况,食管鳞癌组织中AEG-1 mRNA表达量为癌旁正常组织的5.9~8.9倍(图1)。
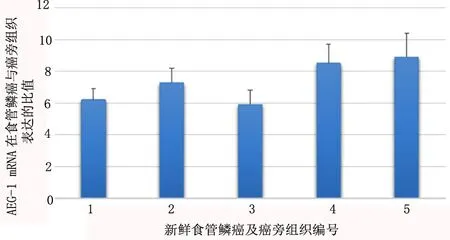
图1 AEG-1 mRNA在5例新鲜食管鳞癌与癌旁正常组织中表达比值
Western blotting法检测所收集5例新鲜食管鳞癌及癌旁组织中AEG-1蛋白表达情况,结果显示癌组织中AEG-1蛋白表达量为癌旁正常组织的4.5~11.2倍(图2)。
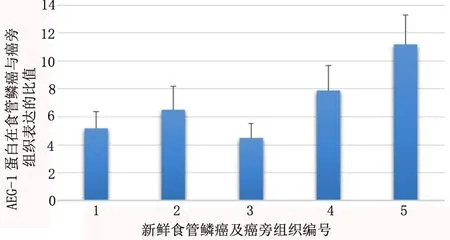
图2 Western blotting 法检测AEG-1蛋白在5例新鲜食管鳞癌与癌旁正常组织中表达比值
免疫组化检测所有517例食管癌标本,结果245例出现高表达,阳性率47.4%,AEG-1阳性表达主要定位于细胞质,呈棕色(图3)。AEG-1的表达与年龄、性别无关(均P>0.05),而与肿瘤浸润深度、淋巴结转移、分期及分化程度有关(P<0.05)。肿瘤分期越晚、分化程度越差,则阳性率越高,见表1。

图3 免疫组化检测AEG-1在食管癌中的表达(SP×200)
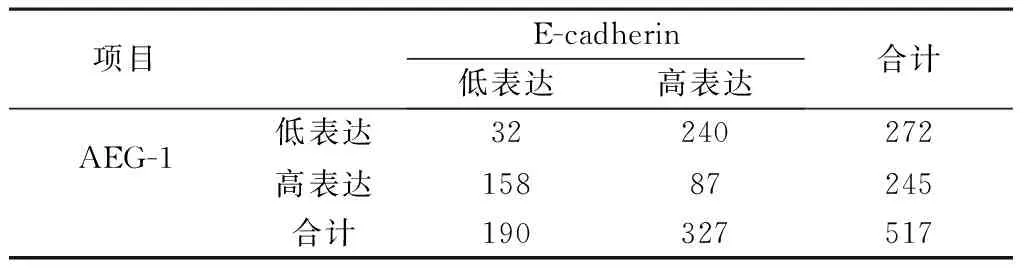
表1 AEG-1及E-cad的表达情况及与临床病理之间的关系
2.2 E-cadherin表达结果与食管癌临床病理的相关性 免疫组化检测结果显示190例出现低表达(36.7%),327例出现高表达(63.3%),其阳性主要定位于细胞膜和胞质(图4)。E-cadherin的表达与年龄、性别无统计学差异(均P>0.05),而与肿瘤浸润深度、淋巴结转移、肿瘤分期及分化程度有关(P<0.05),见表1。
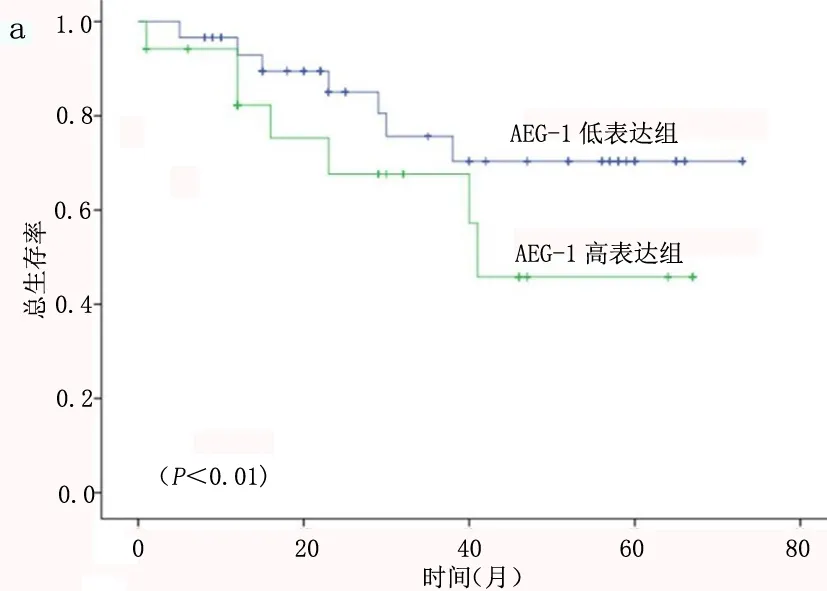
2.3 AEG-1和E-cadherin表达与食管鳞癌患者术后生存的关系 Kaplan-Meier生存分析结果显示:AEG-1高表达组和低表达组总生存率差异均有统计学意义(P<0.05),表明AEG-1表达越高患者生存率越差(图5a)。同时E-cadherin表达越高显示预后越好(图5b),差异均具有统计学意义(P<0.05)。
2.4 AEG-1与E-cadherin相关性 245例高表达AEG-1中,有87例高表达E-cadherin,158例低表达。采用Spearman相关分析,AEG-1与E-cadherin二者的表达呈负相关(r=-0.546,P<0.01),见表2。

表2 AEG-1与E-caherind表达的相关性
3 讨论
中国是世界上食管癌的发病率、病死率最高的国家,尤以河南、福建东南沿海为甚[4]。食管癌是原发于食管的恶性肿瘤,以鳞癌多见。具有发病隐匿、进展快、预后差等特点,尽管目前治疗方式多为手术、化疗、放疗,其治疗手段仍较少,由于缺乏有效的能用于早期检测食管癌的生物指标物,总体5年生存率低于30%[5-6]。AEG-1又称为异黏附蛋白,由Hu等在HIV感染细胞中发现[2]。近年来,许多实验表明,AEG-1其在常见的恶性肿瘤(如乳腺癌、肠癌等)呈过表达,且与肿瘤浸润、转移起关键作用,并与患者的生存呈负相关[7-10]。
本研究结果显示,AEG-1 mRNA在5例食管鳞癌组织中的表达明显高于癌旁组织。蛋白水平方面,应用Western blotting进一步验证AEG-1在食管鳞癌组织中表达明显高于癌旁组织。免疫组化显示,517例食管癌标本出现AEG-1阳性,而在癌旁组织无表达或弱表达。分析AEG-1与患者临床病理特征相关性发现,AEG-1的表达与食管鳞癌的浸润深度、淋巴结转移状态、病理分期显著相关(P<0.05)。生存分析探讨AEG-1与患者术后预后的关系,Kaplan-Meier分析表明低表达AEG-1的患者其总体生存率显著优于高表达AEG-1组的患者,提示AEG-1高表达与食管鳞癌不良预后密切相关,这与文献报道基本一致[11-12]。综上所述,本研究数据表明,AEG-1可能是食管鳞癌预后不良的一个标志性指标。
在食管癌的转移机制中, EMT是其中一个关键的生物行为进程。 EMT的过程中,其标志之一为E-cadherin减少。E-cadherin主要分布于胚胎和成熟组织的上皮细胞中,除具有调节组织的发育、形成外,在细胞间的黏附反应起关键机制[13]。EMT作用机制之一可能是减弱依赖E-cadherin的细胞黏附。从而增加细胞的运动性,致使癌细胞侵入周围组织并扩散。癌细胞摆脱细胞间黏附进而进入细胞质完成浸润,进一步突破基底膜屏障,EMT为这个破环过程的潜在机制提供了一种可能。
本研究提示了食管鳞癌中存在高表达AEG-1,且与患者生存情况呈负相关关系,这与张雪梅等的报道一致[11-12]。进一步发现,食管鳞癌组织中E-cadherin显著低表达(P<0.05),且与AEG-1的表达呈显性负相关(r=-0.546,P<0.05)。表明AEG-1高表达可能通过下调E-cadherin及上调Vimentin和N-cadherin的表达使食管鳞癌上皮细胞获得间质细胞的特性,进而推进EMT的发生。提示AEG-1阳性率较高的食管癌患者更易发生淋巴结转移和较差的组织学分化,黏附性下降,从形态学上表明AEG-1可能通过上皮间质转化途径参与食管癌的发生发展、浸润及转移。
综上所述,本研究通过RT-PCR、Western blotting及免疫组化证实AEG-1在食管鳞癌组织中呈高表达,其高表达与肿瘤的TNM分期、阳性淋巴结数及分化程度高度相关。AEG-1的高表达可能提示食管鳞癌患者预后不良的生物标志物。其机制可能是通过负性调节E-cadherin使组织发生上皮间质转化从而促进肿瘤的浸润和转移,具体机制有待进一步研究探索和验证。

