三种不同乳酸菌对凡纳滨对虾生长、抗病力及肠道菌群结构的影响❋
李佳徽,王明阳,田相利,2❋❋,刘龙镇,李海东,李 丽,2,董双林,2,薛 玲
(1.海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003; 2.青岛海洋科学与技术试点国家实验室,山东 青岛 266237;3.青岛瑞滋海珍品发展有限公司,山东 青岛 266408)
凡纳滨对虾(Litopenaeusvannamei)又称南美白对虾,原产于中、南美洲太平洋沿岸的温暖水域,20世纪70年代初厄瓜多尔正式养殖并获得成功。由于其具有生长速度快、适应性强、对饵料要求低、出肉率高且肉味鲜美[1]等特点而深受世界各国虾类养殖行业和水产品市场欢迎,甚至在世界范围掀起养殖该品种的热潮。凡纳滨对虾与斑节对虾(Penaeusmonodon)、中国明对虾(Fenneropenaeuschinensis)并称为世界三大对虾养殖品种,于1988年引进我国,在育种和养殖技术突破后,其养殖规模迅速扩大[2]。
近年来,由于高密度集约化养殖模式的迅速发展,对经济效益的过分追求,养殖水体内残饵、粪便大量积累并在微生物的作用下分解产生了大量氨氮、亚硝酸盐和硫化氢等对凡纳滨对虾产生胁迫或毒害作用的物质,造成虾体机能下降,种质退化,对环境和疾病的抵抗力严重降低,病害频发。在病害的防治过程中,抗生素和其他化学类药物被大量应用,长此以往,细菌对抗生素产生了耐药性,治疗效果大打折扣。此外,药物残留和养殖废水的大量排放对周围生态环境和人类健康也产生了巨大的危害,引发了生态环境和食品安全等其他方面的问题。因此,寻找抗生素的替代品刻不容缓,而以益生菌为代表的微生态制剂因天然、无污染、无残留等特点[3],在水产养殖的应用方面具有很好的前景。
益生菌是一类能够产生促进养殖动物生长、提高其免疫力、改善水质和其他有益作用的活性微生物的统称[4]。作为水质改良剂使用能够清除池底污泥中硫化氢、氨氮等大量对养殖动物产生毒害作用的有害物质,达到改善水质,修复水体,为养殖动物提供一个清洁、舒适、无胁迫的生长环境的目的。作为饲料添加剂使用,能够通过产生营养性物质、消化酶、有机酸、细菌素等参与到宿主的新陈代谢,定植于肠道粘膜上与其他菌群形成生物屏障等途径来改善肠道的生理功能,既可以促进和维持正常微生物菌群,又能够抑制或杀死病原菌,调节并维持宿主肠道微生态平衡,提高养殖动物的生长性能的同时增强其抗病能力[5-6]。其次,不会产生抗生素的耐药性和药物残留等问题,非常适于运用到水产养殖的生产实践当中。
本研究以凡纳滨对虾为养殖对象,对比研究了3种不同特性的乳酸菌对其幼虾生长、副溶血弧菌抗病力以及肠道菌群结构和多样性的影响,旨在为这3种乳酸菌在凡纳滨对虾的养殖生产活动中的实际应用提供科学依据。
1 材料与方法
1.1 实验菌株
本研究所用的3种乳酸菌菌株分别为粪肠球菌(Enterococcusfaecalis,编号:LYB1)、嗜酸乳杆菌(Lactobacillusacidophilu,编号:W2)和凝结芽孢杆菌(Bacilluscoagulans,编号:NJ17),三种菌株均来自中国海洋大学水产养殖生态研究室的菌种库。各菌株经发酵后将其菌液制成干粉制剂以备用。副溶血弧菌(Vibrioparahaemolyticus,编号:20160303005-1)由中国水产科学院黄海水产研究所提供。
1.2 饲料制备
本实验选用广东粤海有限公司(广东,湛江)凡纳滨对虾商品配合饲料(2号料)作为基础饲料[7],在此基础上按照一定比例添加3株不同种类的乳酸菌干粉(分别标记为FCQ、RSJ和NJ),饲料中益生菌的添加浓度均为1.0×1010cfu/kg,混合均匀后再用鱼油(8.4 mL/kg)和褐藻酸钠(6.3 g/kg)粘合。避光揉搓阴干后,4 ℃环境下低温保存备用。对照组饲料(标记为JC)由一定比例的凡纳滨对虾配合饲料表面直接用鱼油(8.4 mL/kg)和褐藻酸钠(6.3 g/kg)粘合制成。
1.3 对虾及其养殖管理
实验对虾购于青岛市宝荣水产科技发展有限公司对虾养殖场,购买后于30 cm×40 cm×50 cm的玻璃钢水族箱中暂养10 d,水族箱的水量为50 L。暂养期间,每天升高2个盐度,盐度由初始的21最终驯化至30。每天投喂凡纳滨对虾基础饲料,暂养结束后禁食24 h,选取健康活泼、个体均匀的凡纳滨对虾((3.72±0.06) g)随机分成4个实验组,每组5个重复,各10尾对虾。在42 d的养殖实验期间内,每日早晚投喂2次饲料,日投喂量约为对虾体重的4%~5%,在投喂前吸出残饵和粪便,并于60 ℃下烘干保存。每日换水1次,换水量约为33%~66%。养殖平均水温为25 ℃左右,pH=8.0±0.1,连续微量充气,溶氧保持在5 mg/L以上。
1.4 样品采集与处理
1.4.1 生长实验 实验开始前,统计4组实验对虾的放养数量与初始体重。养殖实验结束后,统计各组对虾成活尾数与末体重。在养殖过程中,记录4组实验的投饵量、残饵量与粪便量,各生长指标计算公式[7]如下:
成活率(%)=(实验后对虾数量/实验前放养数量)×100%;
特定生长率(SGR,%)=[(lnW末-lnW初)/t]×100%;
饲料效率(FER,%)=(W末-W初)/Wf×100%;
表观消化率(ADR,%)=(Cw-Fw)/Cw×100%。
式中:W初为初体重(g);W末为末体重(g);t为养殖天数(d);Wf为饲料量;Cw为以重量表示的对虾的摄食量;Fw为粪便质量。
1.4.2 对虾肠道样品的采集与处理 对虾养殖实验结束后,禁食24 h,每组随机选取30尾对虾称量并记录其体重,采集其肠道。首先以70%的酒精擦拭虾体,然后用灭菌的医用解剖剪在冰袋上解剖虾体,取出肠道,放入1.5 mL的离心管中,-80 ℃保存,全程无菌操作。
1.4.3 虾肠道样品总DNA的提取与PCR扩增 采用CTAB-SDS法[8]提取凡纳滨对虾肠道细菌基因组总DNA,并用琼脂糖凝胶电泳检测其纯度和浓度。将检测合格后的DNA样品送至天津诺禾致源生物信息科技有限公司进行PCR扩增,所选区域为V3~V4区,扩增引物为341F(CCTAYGGGRBGCASCAG)和806R(GGACTACNNGGGTATCTAAT)。用2%的琼脂糖凝胶电泳检测PCR产物,将扩增产物纯化后进行目标条带的切割,回收产物。借助Thermofisher公司的Ion Plus Fragment Library试剂盒[9]构建文库,经Qubit定量和文库检测,结果合格后,借助Thermofisher的Life Ion S5TM或Ion S5TMXL对目标序列进行上机测序,测序后优化有效序列,生成操作分类单元(OTU),聚类相似性定位97%。使用SILVA的SSUrRNA数据库进行OTU物种鉴定比对,可信度阈值设定为80%。
1.4.4 攻毒实验 养殖实验结束后,于第三天以副溶血弧菌对对虾进行攻毒实验。从4个实验组分别随机抽取15尾对虾,分别设置3个重复,每个重复5尾虾。菌株的培养与活化均在胰蛋白胨大豆肉汤培养基(TSB)中进行,28 ℃、180 r/min条件下振荡培养18~24 h,计算有效活菌数后,在10 000 r/min离心10 min收集菌体,用无菌生理盐水漂洗3次,再用无菌生理盐水制成梯度菌悬液。正式实验开始前通过预试验确定合适的注射浓度(1.0×106cfu/mL)和注射体积(25 μL),注射部位为对虾第二腹节与第三腹节之间肌肉,对照组注射同等剂量的无菌生理盐水。攻毒实验持续14 d,养殖条件不变,记录对虾的存活情况。
1.5 数据统计与分析方法
采用SPSS Statistics 17软件对数据进行单因素方差分析,以P<0.05作为差异显著水平。当P<0.05时用Duncan’s多重比较检验不同处理之间的差异显著性,最终统计结果表示为平均值±标准误(Mean±S.E.)[10]。
2 结果
2.1 对虾生长指标
饲料中添加不同乳酸菌投喂后,对虾的成活率与对照组差异不显著(P>0.05,见表1)。但对虾的末体重与特定生长率均显著高于对照组(P<0.05),其中凝结芽孢杆菌组对虾最高(P<0.05)。饲料中添加不同种类的乳酸菌不仅能够促进凡纳滨对虾生长,还可以提高其饲料效率和表观消化率(P<0.05),其中凝结芽孢杆菌组对虾表观消化率显著高于其他两组,饲料效率显著高于粪肠球菌组。
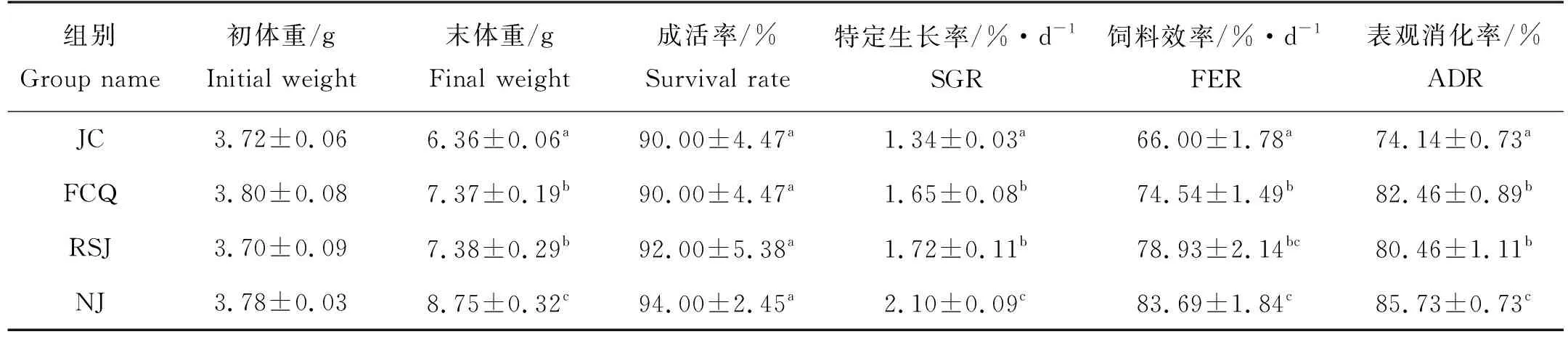
表1 凡纳滨对虾的成活率、生长率、饲料效率和表观消化率
2.2 对虾肠道细菌组成分析
表2为各实验组对虾肠道微生物组高通量测序结果,共获得约27 000条以上序列。以相似性水平为97%为阈值,将序列聚类成为OTUs。图1为基于OTUs(即物种数量)的韦恩图,显示了各实验组之间共有和特有的OTUs情况。4个组共有271个OTUs,其中,粪肠球菌组、嗜酸乳杆菌组和凝结芽孢杆菌组特有的OTUs分别为39、77和47个,对照组有32个特有OTUs。

表2 对虾肠道菌群样品的测序结果及OTU分类情况
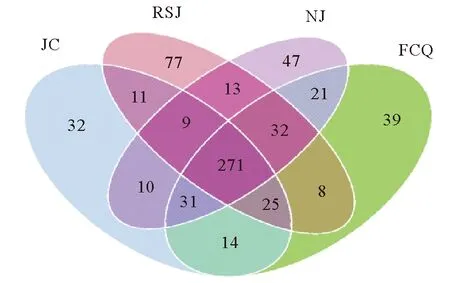
(FCQ、RSJ和NJ分别表示添加浓度为1.0×1010 cfu/kg的粪肠球菌、嗜酸乳杆菌和凝结芽孢杆菌实验组,JC为不添加任何益生菌的对照组。下图同。FCQ, RSJ and NJ are experimental groups fed with same doses of E. faecalis, L. acidophilus and B. coagulans, i.e., 1.0×1010 cfu/kg feed,and JC is the control group without any probiotics. The same as bellows.)
2.3 对虾肠道菌群多样性分析
表3为不同实验组对虾肠道菌群的α多样性指数。由表3可以看出,添加乳酸菌的实验组对虾肠道菌群Ace、Chao1与 Shannon指数尽管高于对照组,但统计上差异不显著(P>0.05)。基于Weighted Unifrac 距离的PCoA分析表明,4组菌群结构组成均明显分异。与对照组相比,粪肠菌组组内样品之间更加紧凑,嗜酸乳杆菌组和凝结芽孢杆菌组内的样品之间变得更加离散;实验组样品与对照组样品相对距离都较远,差别均较大,表明这3个实验组菌群结构组成与对照组相比都发生了明显变化(见图2)。
图3显示了实验组与对照对虾肠道菌群在门(Phylum)分类水平上的相对丰度。可以看出,各实验组对虾肠道菌群均以变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)为优势菌群。比较可见,3个实验组肠道中变形菌门较对照组均有所增加,以粪肠球菌组增加最为明显。而厚壁菌门相对丰度则较对照组有所减少,以粪肠球菌组减少最为明显。凝结芽孢杆菌组拟杆菌门相对丰度有所增加,其他两个实验组拟杆菌门相对丰度较对照组均有所减少。
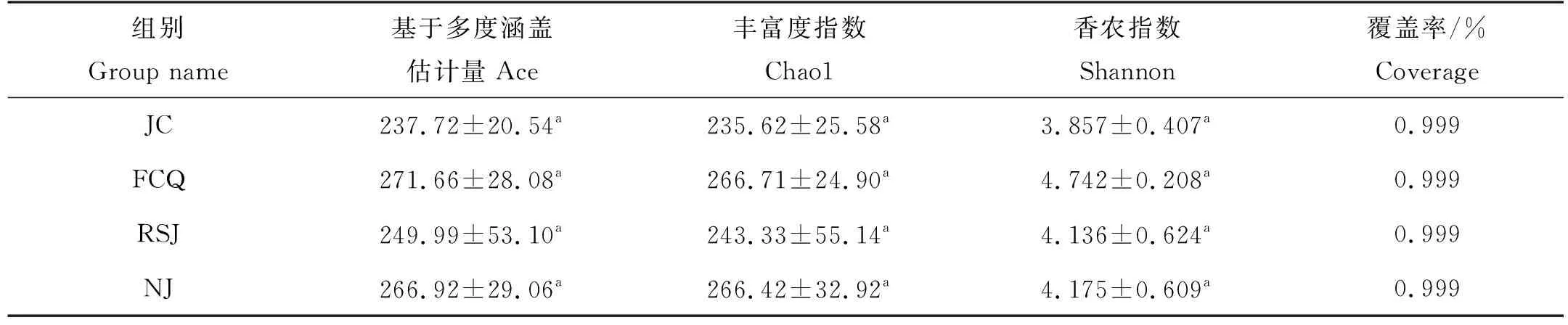
表3 凡纳滨对虾肠道菌群多样性比较
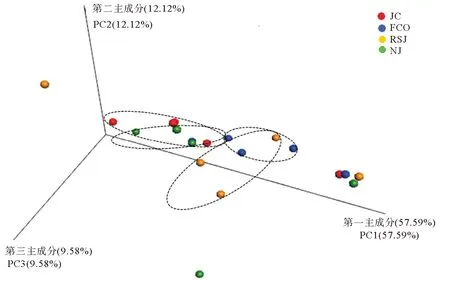
图2 基于Weighted Unifrac距离的凡纳滨对虾肠道菌群PCoA分析
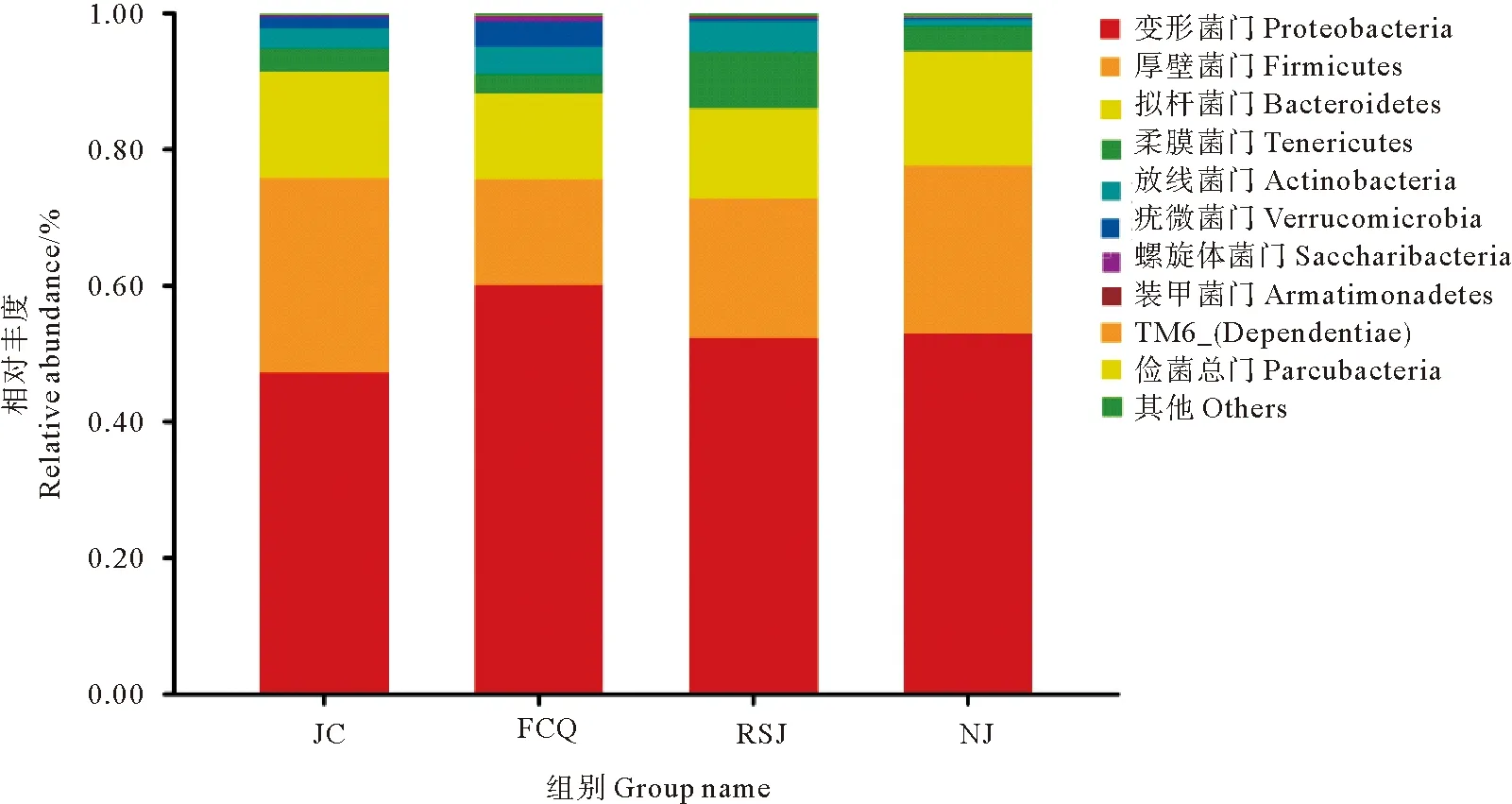
图3 凡纳滨对虾肠道菌群在门分类水平上的相对丰度
图4为各实验组对虾肠道菌群在纲(Class)分类水平上的相对丰度分析结果。可以看出,α-变形菌纲(Alphaproteobacteria)、丹毒丝菌纲(Erysipelotrichia)和黄杆菌纲(Flavobacteriia)为对虾肠道内优势菌群,其中,α-变形菌纲为第一优势菌群,丹毒丝菌纲为第二优势菌群。投喂乳酸菌后,各实验组对虾肠道菌群丰度变化明显。各实验组α-变形菌纲丰度与对照组相比均有所上升,而丹毒丝菌纲则均大幅下降。相对于对照组,粪肠球菌组、嗜酸乳杆菌组中黄杆菌纲丰度有所下降,凝结芽孢杆菌组则基本保持不变。此外,相对于对照组,粪肠球菌提高了对虾肠道内疣微菌纲、拟杆菌纲、噬纤维菌纲和芽孢杆菌纲细菌的丰度,嗜酸乳杆菌增加了柔膜菌纲、拟杆菌纲细菌和芽孢杆菌纲细菌的丰度,而凝结芽孢杆菌降低了对虾肠道酸微菌纲和酸微菌纲细菌丰度,提高了γ变形菌纲、梭菌纲和拟杆菌纲细菌的丰度。
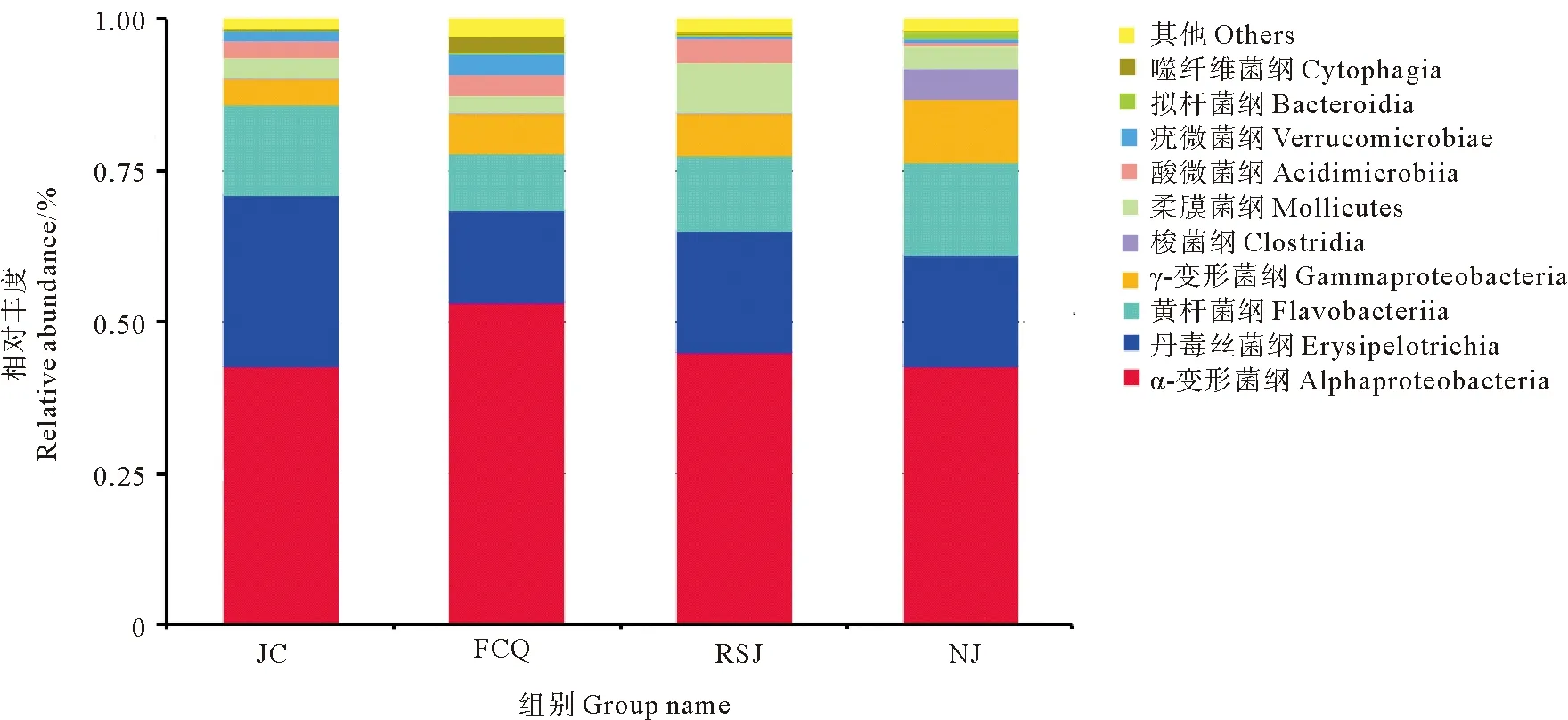
图4 凡纳滨对虾肠道菌群在纲分类水平上的相对丰度
图5为各实验组对虾肠道菌群在科(Family)分类水平上的相对丰度。可以看出,各实验组肠道菌群以红杆菌科(Rhodobacteraceae)、丹毒丝菌科(Erysipelotrichaceae)和黄杆菌科(Flavobacteriaceae)为优势菌群。各实验组比较,粪肠球菌组、嗜酸乳杆菌组和凝结芽孢杆菌组的红杆菌科所占比例分别为42.951%、51.408%和41.784%,对照组为41.258%,各实验组较对照组红杆菌科均有不同程度增加;3个实验组肠道菌群中丹毒丝菌科所占比例分别为20.074%、15.113%和18.447%,对照组为28.223%,各实验组较对照组丹毒丝菌科明显减少;粪肠球菌组、嗜酸乳杆菌组和凝结芽孢杆菌组的黄杆菌科含量分别为12.388%、9.658%和15.445%,对照组为15.088%,嗜酸乳杆菌组和粪肠球菌组较对照组黄杆菌科明显减少;相较于对照组的乳杆菌科(0.015%)和芽孢杆菌科(0.003%),嗜酸乳杆菌组的乳杆菌科(0.047%)和芽孢杆菌科(0.011%)及粪肠球菌组的芽孢杆菌科(0.008)比例明显升高。
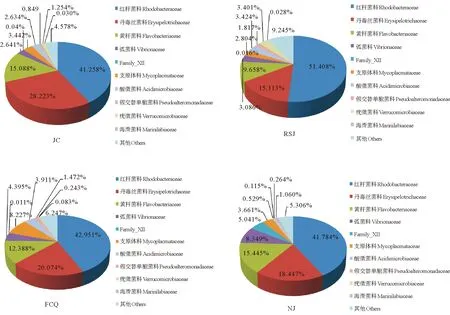
图5 凡纳滨对虾肠道菌群在科分类水平上的相对丰度
图6为对虾肠道菌群在属分类水平上的物种丰度聚类图。可以看出,在属分类水平上,主要优势类群为鲁杰氏菌属(Ruegeria)、海绵单胞菌属(Spongiimonas)、海命菌属(Marivita)、小纺锤状菌属(Fusibacter)等。与对照组相比,粪肠球菌组中发光杆菌属(Photobacterium)、噬冷菌属(Algoriphagus)以及蛭弧菌属(Bdellovibrio)显著升高(P<0.05),凝结芽孢杆菌组中Shimia显著升高(P<0.05)。
饲料中添加的3种乳酸菌所在的纲、科、属水平相对丰度如表4所示。可以看出,嗜酸乳杆菌组和粪肠球菌组对虾肠道中芽孢杆菌纲显著高于凝结芽孢杆菌组和对照组(P<0.05)。相较于对照组的乳杆菌科(0.015 1%)和芽孢杆菌科(0.003 1%),嗜酸乳杆菌组的乳杆菌科(0.047 7%)和芽孢杆菌科(0.011 3%)及粪肠球菌组的芽孢杆菌科(0.007 5%)丰度显著增加,嗜酸乳杆菌组中乳杆菌属显著高于实验组和对照组(P<0.05)。但肠球菌科和属在各实验组中均未检出。
2.4 副溶血弧菌攻毒
副溶血弧菌攻毒后各组对虾累计死亡率情况见图7。经副溶血弧菌攻毒后,对虾摄食量明显降低,活动缓慢或沿壁漫游,直至死亡。大部分死亡虾体附肢发红,解剖发现存在空胃、肝胰腺肿大现象。从图7可以看出,攻毒实验开始后各组对虾陆续出现死亡,在11~13 d时停止死亡。各实验组对虾累积死亡率比较,粪肠球菌组(40.0%)与嗜酸乳杆菌组(6.7%)对虾死亡率显著低于对照组(66.7%,P<0.05),以嗜酸乳杆菌组效果最佳,而凝结芽孢杆菌组(53.3%)与对照组差异不显著(P>0.05)。
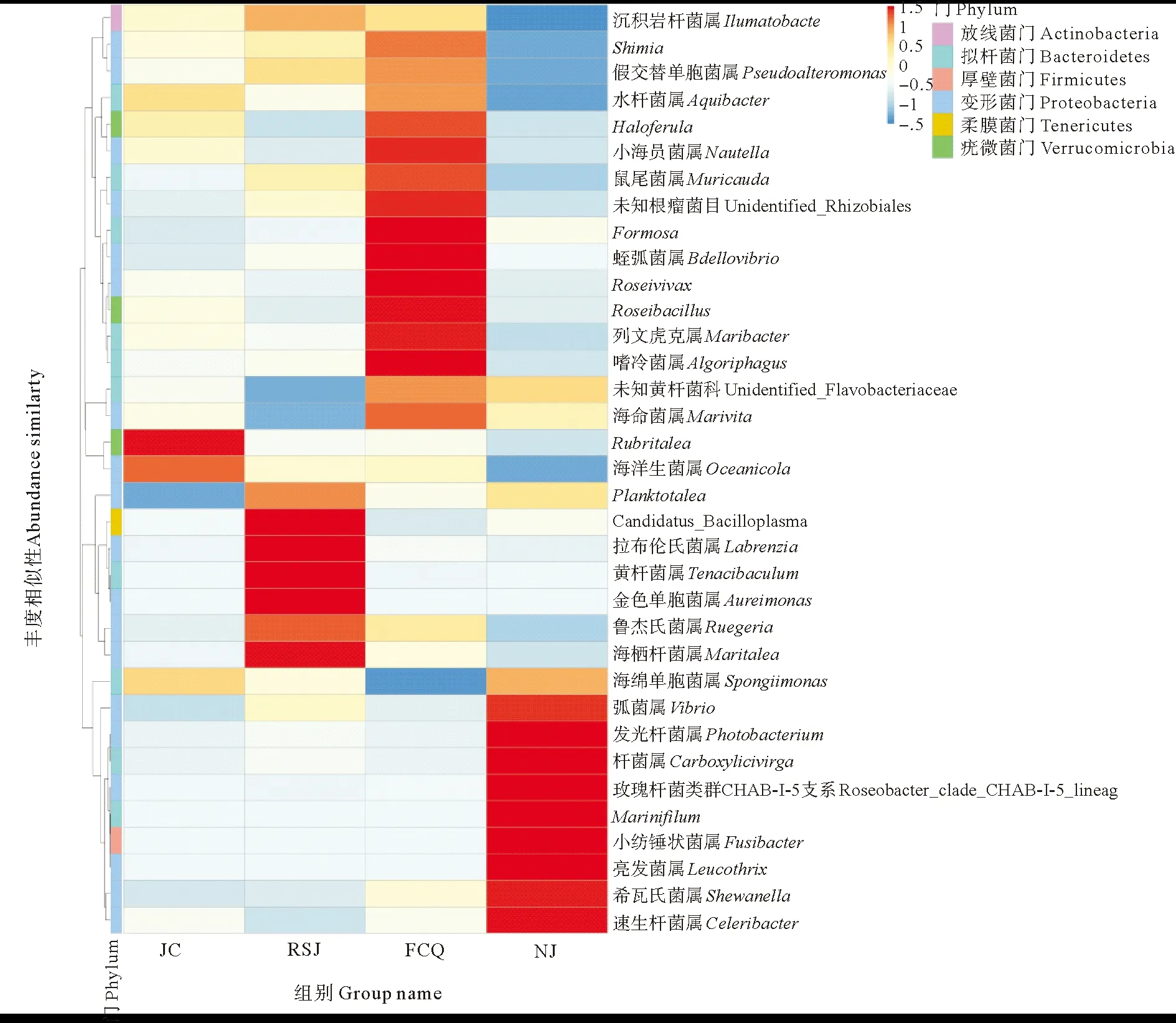
图6 凡纳滨对虾肠道菌群在属分类水平上的物种丰度聚类图

表4 饲料中添加的3种乳酸菌所在的纲、科、属分类水平上的相对丰度
3 讨论
3.1 饲料中添加乳酸菌对凡纳滨对虾生长和抗病力的影响
研究表明,乳酸菌作为饲料添加剂,可以有效促进养殖动物的生长、增强机体免疫力[7,11]。例如,刘迪等[12]发现,在凡纳滨对虾饲料中添加嗜酸乳杆菌组,对虾增重率显著提高,饲料系数明显降低。沙玉杰等[13]研究表明,与对照组相比,用含有1.0×107cfu/g粪肠球菌的饲料投喂凡纳滨对虾,可有效提高其特定生长率。同时,相关研究显示,在饲料中添加适宜浓度的凝结芽孢杆菌也对对虾生长具有明显促进作用,提高其特定生长率等指标[14-16]。不过,关于粪肠球菌、嗜酸乳杆菌和凝结芽孢杆菌对凡纳滨对虾生长等影响的效果的比较尚未见报道。本研究表明,在饲料中添加这3种不同种类的乳酸菌,均可显著提高凡纳滨对虾的体重、特定生长率、饲料效率等指标,与上述研究结果相似。但3种不同乳酸菌促长的效果有所差异,以凝结芽孢杆菌对凡纳滨对虾的生长性能改善的效果为最佳。而从副溶血弧菌攻毒后对虾累积死亡率来看,添加粪肠球菌和嗜酸乳杆菌可显著对虾的抗病力,但以嗜酸乳杆菌效果最为好。
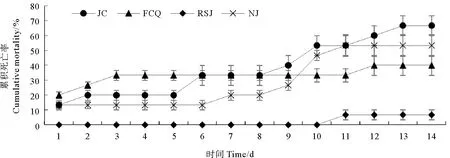
图7 副溶血弧菌攻毒后各实验组凡纳滨对虾累计死亡率
3.2 饲料中添加乳酸菌对凡纳滨对虾肠道菌群结构的影响
正常动物肠道中栖居着大量的微生物群系[17],受遗传、饮食和自然条件等多种因素的影响[18]。它们不仅与宿主之间保持着一种动态平衡关系,菌群与菌群间也存在一定比例的联系,即动物肠道的微生态平衡[19]。保持肠道微生态的平衡对维持机体物质代谢和免疫调节等生理功能以及动物的生长发育均具有重要的影响[20]。研究表明,变形菌门、厚壁菌门和拟杆菌门是多种水产动物的肠道中最主要的细菌类群[21-24]。例如,Gao等[21]的研究显示变形菌门细菌是养殖池塘刺参(Stichopusjaponicus)肠道内第一优势菌群。温崇庆等[25]发现,尽管凡纳滨对虾肠道菌群结构因不同DNA提取方法而呈现显著差异,但仍以变形菌门、厚壁菌门、拟杆菌门等为优势菌门。在本研究中,变形菌门、厚壁菌门和拟杆菌门类群也是凡纳滨对虾肠道中最为主要的类群。但添加乳酸菌后,对虾肠道变形菌门均有所增加,厚壁菌门则有所减少。而凝结芽孢杆菌组中拟杆菌门的物种丰度较其他实验组和对照有所增加。一般认为,拟杆菌门具有促进碳水化合物发酵的功能,是一类可参与糖类、胆汁酸和类固醇代谢等功能的菌群[24],这可能与凝结芽孢杆菌组对虾体现的最优生长性能有关。另外,值得注意的是,本研究发现丹毒丝菌纲为对虾肠道内第二优势类群,这在水产动物肠道中尚属首次发现。
乳酸菌能够有效调节水产动物肠道菌群,可通过营养竞争、分泌抑菌物质等方式改变动物肠道菌群结构[26]。例如,Venkat等[27]研究表明,添加1.4×108或2.4×108cfu/kg乳酸芽孢杆菌的能够显著提高罗氏沼虾(Macrobrachiumrosenbergii)肠道菌群中益生菌的数量。章蔚等[24]用分离的一株乳酸菌(Leuconostoclactis)投喂黑鲷(Sparusmacrocephlus),发现其肠道细菌的DGGE图谱的条带数显著增加。傅玲琳等[28]则发现饲料中添加乳酸菌显著降低了罗非鱼(Tilapia)肠道芽孢杆菌的数量,同时弧菌、假单胞菌(Pseudomonas)和气单胞菌(Aeromonas)的数量也有所下降。然而,关于不同种类乳酸菌对水产动物肠道菌群可能的差异性影响尚未见报道。本研究则发现,添加乳酸菌后,尽管菌群多样性指数未见显著差异,但实验组对虾肠道菌群结构与对照组产生了明显分异。在纲和科分类水平的优势类群中,α-变形菌纲丰度在各实验组均有所上升,丹毒丝菌纲和丹毒丝菌科则均显著下降,红杆菌科则在不同实验组中不同程度有所增加,黄杆菌纲和黄杆菌科在粪肠球菌组、嗜酸乳杆菌组中明显下降。同时,嗜酸乳杆菌组中乳杆菌科和芽孢杆菌科丰度则明显高于对照组,粪肠球菌组中的芽孢杆菌科丰度也明显升高。不过,值得注意的是,肠球菌科在本研究中各实验组中均未被检出,具体原因尚需进一步研究。
3.3 肠道菌群组成与对虾抗病力的关联
乳酸菌能够有效调节水产动物肠道菌群平衡,提高宿主免疫力,抑制病原微生物的生长,使宿主在遭受病害侵袭时,增强抗病能力,进而提高存活率。例如,Gildberg等[29]使用添加的乳酸菌饲料投喂鳕鱼(Gadusmorhua)苗后,在处于强致病弧菌的养殖环境时,鳕鱼抗病率显著提高。李军亮等[30]研究了饲料中添加嗜酸乳杆菌对凡纳滨对虾抗哈维弧菌(V.harveyi)的效果,发现对虾存活率随添加量的增加显著升高。本研究则表明,不同乳酸菌种类影响对虾对副溶血弧菌的抵抗力,尽管均可不同程度提高对虾抗病力,但以嗜酸乳杆菌效果最佳。一般认为,益生菌可以作为非特异性免疫因子,在宿主免疫系统内通过鞭毛蛋白、脂多糖、肽聚糖和细胞因子分泌被肠粘膜细胞表面受体识别,进而提高对病原菌的抵抗力[31]。然而,关于肠道菌群组成的变化与宿主抗病力关系则比较复杂,尚缺乏一致的结论,但部分种类的确可反映出肠道和机体的健康状态。从本研究结果看,一方面,在嗜酸乳杆菌组对虾肠道菌群中,优势类群的丹毒丝菌科和黄杆菌科丰度的下降以及红杆菌科丰度的增加最为显著;另一方面,添加的3种乳酸菌中,乳酸杆菌和粪肠球菌都属乳酸杆菌目,它们与凝结芽孢杆菌都属芽孢杆菌纲。从纲、科和属三个分类水平上分别比较,嗜酸乳杆菌组对虾肠道芽孢杆菌纲显著高于凝结芽孢杆菌组和对照组,乳杆菌科、芽孢杆菌科及乳杆菌属也显著高于其他实验组和对照组。但肠球菌科和属在各实验组中均未检出。这些肠道菌群组成的变化可能都与对虾的生长与抗病力等方面存在的差异有关。一般认为,乳杆菌科和芽孢杆菌科细菌种类是肠道中潜在的益生菌。例如,研究证明,芽孢杆菌属、乳杆菌属和乳球菌属可以抑制炎性细胞因子的产生和病原体诱导的肠功能紊乱[32-34]。同时,也有研究表明红杆菌科的丰度与对虾的生长和存活成正相关关系[35]。不过,丹毒丝菌科目前在水产动物中尚未见报道,其在人的肠道菌群中的角色也尚不明确,但其部分种类可能会增加肠道的炎症反应[36],因此,其丰度的降低可能反映肠道的健康度较好。但遗憾的是,关于肠道菌群对机体影响的机制比较复杂,尚需结合代谢组学等研究手段进一步深入研究与解析。
4 结语
饲料中添加1.0×1010cfu/kg的嗜酸乳杆菌W2、粪肠球菌LYB1和凝结芽孢杆菌NJ17均可有效促进凡纳滨对虾的生长速率,并不同程度提高虾体对副溶血弧菌的抗病力。若以对虾特定生长率为评价指标,添加凝结芽孢杆菌效果最佳;若以对虾抗弧菌能力为评价指标,添加嗜酸乳杆菌最佳。3种乳酸菌均明显改变了对虾肠道微生物群落的组成和丰度,但对对虾肠道菌群多样性影响不大。

