过表达MyBPC1对牛骨骼肌卫星细胞增殖分化的影响
洪倩倩,郭 宏,高树新*,郭益文*
(1.内蒙古民族大学动物科学技术学院,通辽 028000;2.天津农学院动物科学与动物医学学院,天津 300384)
骨骼肌是动物体的重要组成部分,其重量达到动物自身体重的40%。目前关于基因MyBPC1的研究多数为肌肉疾病及癌症方面。而关于MyBPC1调控牛肌肉分化的相关研究知之甚少。本试验在前期研究的基础上,通过上调牛骨骼肌卫星细胞中MyBPC1的表达,分析其对细胞增殖分化的影响,进而探究基因MyBPC1调控牛骨骼肌卫星细胞分化的作用机制,为牛骨骼肌发育调控机制研究提供理论依据,研究结果对动物肉用性状的改良有着重要的科学意义。
动物机体及体内脏器的活动完全依赖肌肉的收缩和舒张功能,其中骨骼肌发挥着不可替代的作用。同时还可作为分泌器官分泌多种肌肉因子,与其他器官协同完成机体的各种活动[1]。骨骼肌的调节机制是一个高度协调的过程,能够参与多种细胞因子的激活和生命活动的调节[2]。骨骼肌干细胞为动物机体提供了大量的肌源性细胞,这些细胞经增殖、分化、融合发挥各自的功能[3]。成肌细胞融合对于肌纤维的形成是必不可少的。这些细胞在1961年首次被发现,许多科研人员探究了它们的胚胎起源以及在肌肉再生和修复中所起的确切作用[4]。肌球蛋白结合蛋白C1(myosin binding protein C1,MyBPC1)是一种丰富的骨骼肌蛋白,主要在慢收缩肌纤维中表达。肌球蛋白结合蛋白C(MyBP-C)家族是一组对横纹肌结构和功能有重要影响的肌球蛋白结合蛋白,约占肌丝质量的2%,在肌肉收缩和松弛过程中起着重要的作用,因此,动物骨骼肌的分子调控机制备受关注。有研究表明,在胚胎骨骼肌中检测到基因MyBPC1的表达[5]。根据表达的序列标签提供有关转录组信息进行差异表达基因筛选,证实了MyBPC1等基因与肌发生有关系,且这些基因表现为产前高表达[6]。曾有学者研究表明,黑肉牛骨骼肌中基因MyBPC1的SNP位点与生长性状[7]和大理石花纹[8]有关。有研究发现,肌肉收缩需要的高能量是由肌型肌酸激酶(MM-CK)提供,且MM-CK与慢MyBPC1相互作用[9]。还有研究提示,MyBPC1作为连接ATP消费者(肌球蛋白)和再生器(MM-CK)的适配器,具有有效的能量代谢和同质平衡作用[10]。同时,MyBPC1介导肌球蛋白型肌酸激酶(CK)的合成[10],这些研究结果证明了MyBPC1在骨骼肌的定位、肌肉病变和能量转换中的重要作用。
近几年来,越来越多的研究发现MyBPC1在动物病变肌肉中差异表达,但在肌肉生长发育中的作用还未可知,本研究就过表达MyBPC1对牛骨骼肌卫星细胞增殖分化的影响进行了试验。分别在mRNA和蛋白水平上对牛骨骼肌卫星细胞增殖分化标志因子进行了检测。有研究表明,Pax7[11-12]和Ki67[13-15]基因在临床上可被广泛用作一种增殖标志因子。同时Pax7在肌肉产生过程中起着重要的重叠作用[16-17]。电刺激肌卫星细胞会使基因Pax7 的mRNA 水平和MyoD、Myogenin、MyHC[18-20]的蛋白水平增加,这些标志因子表达量的增加促进了肌卫星细胞的分化[21]。MyHC和MyOG基因的表达变化可监测肌卫星细胞的分化状态[22]。MyOD基因是肌细胞融合的关键因子,同时也可以诱导肌肉细胞多核表达[23]。肌球蛋白重链胚胎(MyHC)是一种在肌肉发育过程中表达的骨骼肌特异性收缩蛋白[24]。上述研究证明,MyBPC1可能对牛骨骼肌卫星细胞的增殖分化有潜在的调控作用,但过表达MyBPC1对牛骨骼肌卫星细胞增殖分化的影响尚不清楚。本研究利用成功构建的MyBPC1过表达模型,通过在RNA和蛋白水平同时上调MyBPC1的表达分析MyBPC1对牛骨骼肌卫星细胞增殖和成肌分化的影响。
1 材料与方法
1.1 主要仪器
LightCycle96荧光定量PCR仪(Roche公司,瑞士);低温高速离心机 centrifuge 5810R(Eppendorf,德国);细胞恒温培养箱(三洋电机公司,日本);倒置显微镜(Leica,德国);PowerPac Basic 电泳仪、转膜仪、Nano-Drop ND 2000c Spectrophotometer(Thermo scientific,德国);垂直电泳槽、超敏电泳凝胶成像分析系统(Bio-Rad,美国)等。
1.2 主要试剂
DMEM、FBS (Fetal Bovine Serum)、HS (HorseSerum)、Opti-MEM;0.25%胰蛋白酶购自美国 Gibco公司;si-RNA购自广州锐博公司;BCA试剂盒购自北京康为公司;Lipofectamine 3000 Rea-gent 购自赛默飞公司;Pax7 和MyHC 一抗购自DSHB 公司;GAPDH一抗、羊抗鼠二抗和羊抗兔二抗购自北京中杉金桥公司;MyBPC1一抗购自上海生工生物工程股份有限公司;RNA快速提取试剂盒购自艾德莱生物科技有限公司;反转录试剂盒购自TaKaRa biotechnology Corporation;All-in-One’M qPCR Mix购自GeneCopoeia;引物由北京擎科生物科技有限公司合成;过表达载体(pcDNA3.1)由苏州鸿讯生物技术股份有限公司提供。
1.3 试验时间和地点
试验时间是2020年5月到2021年1月,地点在天津农学院天津市农业动物繁育及健康养殖重点实验室。
1.4 牛骨骼肌卫星细胞培养前处理
牛骨骼肌卫星细胞由天津农业动物繁育与健康养殖重点实验室分离并冻存,该技术已获批国家专利,具体方法参考王轶敏等[25]的研究。
进入细胞培养程序前,需要确保培养细胞过程中所用到的试验器材、试剂、环境均保持无菌状态,以防细胞污染,增殖培养基为20%FBS+80%DNEM。分化培养基为2% HS+98% DMEM。细胞培养包括细胞复苏和细胞传代两部分。
细胞复苏:将冻存的原代牛骨骼肌卫星细胞从液氮罐中取出,并迅速将其置于37 ℃恒温水浴锅中,并充分摇晃使之在1~2 min内尽快解冻,防止缓慢融化使细胞重吸收水分而导致细胞内产生再结晶,对细胞有损并可能会降低细胞活力。在不能让冻存的细胞完全融化的条件下,立即加入相等体积的提前预热好增殖培养基进行中和,并立即吹吸混匀,可防止原冻存液中的成分损伤细胞。将含有细胞的液体转移至离心管中,1 000 r·min-1离心10 min。离心后小心弃掉上清液,用增殖培养基轻轻吹吸细胞,使细胞重悬,将细胞根据分离冻存时的细胞量均匀的接种于直径为60 mm的增养皿中,置于37 ℃、5% CO2的培养箱中进行培养。在细胞培养过程中,需要及时用显微镜观察细胞的生长状态。
细胞传代:细胞在进入对数生长期并且达到汇合状态时会发生接触性抑制,细胞浓度的快速升高将导致细胞代谢速度加快,同时细胞增殖也可能会导致培养基的消耗速度加快。因此,为使细胞更好地进一步增殖,需要将其进行传代。当细胞密度达80%左右时进行传代,传代时首先将原细胞培养基吸弃,沿培养皿内壁缓慢滴加无菌 PBS清洗掉原代细胞分离后的一些杂质或死细胞。然后再加入足以覆盖培养皿中细胞的0.25%胰酶,放回培养箱培养2 min,用来消化贴壁生长的牛骨骼肌卫星细胞。立即置于倒置显微镜下观察细胞消化情况,待细胞消化好后,立即加入等体积提前预热的增殖培养基终止消化,以防细胞消化过度受到伤害。再将其收集到全新无菌的离心管中离心,收集细胞沉淀。再重复细胞沉淀重悬步骤,根据后续试验所需细胞量,提前设计好所需细胞的接种面积,按30%密度接种至不同细胞孔板中进行继续增殖培养。
1.5 试验设计
利用qRT-PCR检测牛骨骼肌卫星细胞正常分化进程中MyBPC1的mRNA表达水平变化,利用 Western blot法检测MyBPC1在牛骨骼肌卫星细胞正常分化进程中蛋白表达水平的变化。
合成pcDNA3.1-MyBPC1质粒,将其转染进牛骨骼肌卫星细胞内,以空载体(pcDNA3.1)转染细胞作为对照。转染处理后24 h为增殖期(GM),qRT-PCR及Western blot法检测更换分化培养基24(DM1)、48(DM2)、72 h(DM3)的干扰效果。
利用光学显微镜观察牛骨骼肌卫星细胞诱导分化后各个时期肌管形成状态,qRT-PCR检测增殖期标志因子Pax7和Ki67以及分化期标志因子MyOG和MyHC的表达情况,Western blot检测增殖期标志因子Pax7和分化标志因子MyHC的蛋白表达水平。结合以上结果综合分析过表达MyBPC1对牛骨骼肌卫星细胞成肌分化的影响。
1.6 牛骨骼肌卫星细胞的培养
将液氮内冻存的细胞在37 ℃水浴中复苏,用1 mL 增殖培养基(20%FBS+80%DNEM)室温中和,1 000 r·min-1离心10 min,移除上清液,重新加入适量的增殖培养基重悬,置于直径60 mm的培养皿中复苏。待细胞铺满培养皿80%时传代,用37 ℃ 预热的PBS清洗细胞1次,加入1 mL 0.25%胰酶放培养箱消化1 min,加入1 mL增殖培养基中和胰酶,室温1 000 r·min-1离心10 min,移除上清液,加入适量的增殖培养基重悬,传代到细胞培养板中。待细胞密度度达到80%,加入分化培养基(2% HS+98% DMEM)进行体外诱导分化。整个培养过程为无菌操作。
1.7 实时荧光定量PCR检测基因表达
利用HiFiScript cDNA Synthesis Kit 进行cDNA第一链的合成,利用All-in-OneTMqPCR Mix进行实时荧光定量PCR(qRT-PCR)。mRNA反转录cDNA合成反应程序为:42 ℃ 15 min;85 ℃ 5 min。反转录产物可直接用于下游试验,将反转录模板稀释3倍用于定量试验。qRT-PCR反应程序为:95 ℃预变性10 min;95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸15 s,40个循环。反应体系中所涉及引物见表1。

表1 qRT-PCR检测所用引物Table 1 Primers for qRT-PCR detection
1.8 Western blot检测蛋白表达
使用BCA试剂盒测定裂解细胞的蛋白浓度,主要分为:BSA标准品稀释、待测蛋白的稀释、BCA工作液的配置、微孔板检测。绘制出标准曲线并计算目的蛋白浓度。分别检测牛骨骼肌卫星细胞分化进程中MyBPC1的表达、增殖期Pax7的表达和分化期MyHC的表达情况。
1.9 统计分析
每组试验均设置3个生物学重复,所有数据均以“平均数±标准差”表示。qRT-PCR结果按2AC法计算,采用t检验进行差异显著性分析,以GAPDH作为内参基因对检测的目的基因的表达量进行归一化。*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。
2 结 果
2.1 牛骨骼肌卫星细胞正常分化进程中MyBPC1的表达
将牛骨骼肌卫星细胞复苏,分别传代到24孔板和6孔板上,待细胞贴壁生长后,增殖24 h。随后更换分化培养基诱导细胞分化24、48、72 h为分化DM1、DM2、DM3,采用qRT-PCR和Western blot检测MyBPC1在牛骨骼肌卫星细胞增殖分化过程中的表达差异,如图1显示,MyBPC1在分化第3天的表达极显著高于增殖期,且表达量最高(P<0.01),说明MyBPC1可能对牛骨骼肌卫星细胞增殖分化有一定的调控作用。
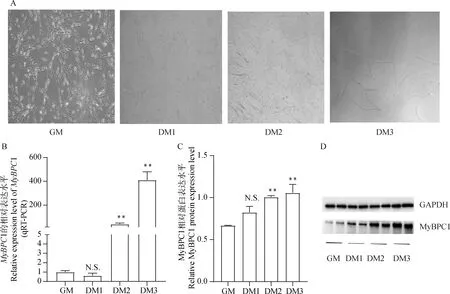
A.牛骨骼肌卫星细胞分化进程镜像图(GM,100×;DM1、DM2、DM3,4×);B.牛骨骼肌卫星细胞分化进程中MyBPC1 mRNA水平;C、D.牛骨骼肌卫星细胞分化进程中MyBPC1的蛋白水平及其量化图A.Mirror image of the differentiation process of bovine skeletal muscle satellite cells(GM,100×;DM1,DM2,DM3,4×);B.MyBPC1 mRNA level during the differentiation of bovine skeletal muscle satellite cells;C,D.MyBPC1 protein level and its quantification map during the differentiation of bovine skeletal muscle satellite cells图1 牛骨骼肌卫星细胞在分化进程中MyBPC1的表达Fig.1 The expression of MyBPC1 during differentiation of bovine skeletal muscle satellite cells
2.2 过表达MyBPC1模型的建立
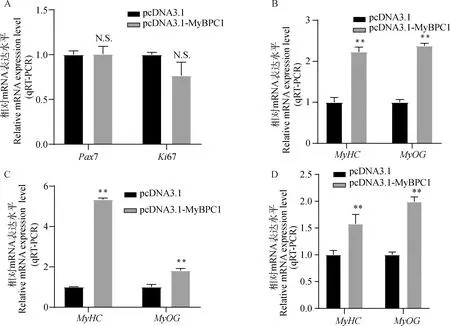
为了探究MyBPC1对牛骨骼肌卫星细胞增殖分化的影响,本研究体外培养了牛骨骼肌卫星细胞。根据NCBI数据库中MyBPC1基因序列,构建pcDNA3.1-MyBPC1过表达质粒(由生物公司合成)。分别转染进细胞中,收集增殖期细胞,提取RNA,利用qRT-PCR检测MyBPC1的mRNA水平的表达效率,结果如图2A所示。检测分化期的过表达效率,如图2B所示,各时期均有明显的过表达效果(P<0.01)。

A.增殖期MyBPC1的过表达效率;B.分化期的MyBPC1的过表达效率A.Overexpression efficiency of MyBPC1 in the proliferation phase;B.Overexpression efficiency of MyBPC1 in the differentiation phase图2 在牛骨骼肌卫星细胞中MyBPC1过表达模型的构建Fig.2 Construction of the overexpression model of MyBPC1 in bovine skeletal muscle satellite cells
2.3 过表达MyBPC1对牛骨骼肌卫星细胞增殖分化的影响
在成功构建MyBPC1过表达模型的基础上,进一步研究过表达MyBPC1对牛骨骼肌卫星细胞的影响。利用定量PCR和Western blot技术检测肌细胞增殖和分化标志基因表达情况,确定MyBPC1对牛骨骼肌卫星细胞的影响。结果显示,过表达MyBPC1后,增殖标志因子Pax7和Ki67 mRNA均无显著变化(P>0.05,图3A),与蛋白水平Pax7的表达一致(图3E、F)。根据细胞总体增殖状态来看,过表达MyBPC1对牛骨骼肌卫星细胞增殖无显著影响。在分化期,分化标志因子MyHC和MyOGmRNA表达量极显著上升(P<0.01,图3B、C、D);MyHC蛋白表达量极显著上升(P<0.01),同时明显提升肌管的生成数目(图3G、H)。根据细胞镜像图总体分化状态来看(图3I),过表达MyBPC1对牛骨骼肌卫星细胞分化有促进作用。


A.细胞增殖标志因子mRNA的水平;B、C、D.DM1、DM2、DM3分化标志因子mRNA的水平;E、F.细胞增殖标志因子蛋白水平及其量化图;G、H.细胞分化标志因子蛋白水平及其量化图;I.过表达MyBPC1牛骨骼肌卫星细胞镜像图(4×)A.The level of mRNA of cell proliferation marker factors;B,C,D.The mRNA levels of DM1,DM2 and DM3 differentiation marker factors,respectively;E,F.Cell proliferation marker factor protein level and its quantification diagram;G,H.Cell differentiation marker factor protein level and its quantification diagram;I.Mirror image of bovine skeletal muscle satellite cells after overexpressing MyBPC1(4×)图3 过表达MyBPC1对牛骨骼肌卫星细胞增殖分化的影响Fig.3 Effects of overexpression of MyBPC1 on the proliferation and differentiation of bovine skeletal muscle satellite cells
3 讨 论
骨骼肌生长发育是一个复杂的生理过程,每个细微的过程都有不同基因和不同的调控机制,以及各种信号通路的参与。基因调控网络的精细调控贯穿于动物肌肉的整个生长发育过程,它能够调节肌纤维的数目、类型以及生长速度。肌纤维是骨骼肌的功能单位。本实验室前期鉴定出了一条lncRNA,命名为lnc23,证实其对牛骨骼肌卫星细胞有明确的调控作用,下调lnc23可抑制牛骨骼肌卫星细胞的分化,同时转录组学筛选到了MyBPC1表达量的显著变化,因此本研究构建了MyBPC1的过表达细胞模型,探究上调MyBPC1对牛骨骼肌卫星细胞分化的影响。本试验结果显示,过表达MyBPC1后各个时期的标志因子mRNA与蛋白水平表达相一致。越来越多的证据表明,转录后调控是决定细胞因子mRNA水平的决定因素,转录后调控通过核糖体调节mRNA的稳定性和翻译效率[26-27]。
MyBPC1有很多异构体,结构错综复杂,MyBP-C是个家族蛋白,哺乳动物肌肉中存在3种不同的MyBP-C亚型:慢骨骼(MyBPC1)、快速骨骼(MyBP-C2,含多种变异体)和心肌(cMyBP-C3)。研究发现,心肌肌球蛋白结合蛋白C(cMyBP-C3)是一种与收缩器中厚、薄、Titin纤维系统相联系的完整蛋白,其功能受本身翻译后修饰的严格调控[28]。MyBPC1大小为128 ku,且是3个异构体的类似物,由不同的基因编码,在横纹肌中有不同的表达谱[29],包括多种辅助性蛋白,且具有相同的结构和序列同源性[30]。研究表明,人体内MyBPC3基因频繁突变导致心肌细胞过度分化,在家族性肥厚型心肌病的确诊病例中高达30%~35%。有报道称,干扰慢肌纤维MyBPC1表达会抑制肉鸡乳腺肌卫星细胞的增殖分化[31]。在黄肉仔鸡发育期肌肉生长和肌内脂肪代谢差异表达基因的鉴定中MyBPC1基因的上调表达被认为与肌纤维肥大密切相关[32]。有研究发现,MyBPC1基因与乳腺癌细胞扩增显著相关[33]。还有学者研究发现,MyBPC1基因是 TMPRSS 2-ERG前列腺癌分子的一个亚型[34]。综上所述,MyBPC1高表达能促进细胞的分化,与本研究结果一致。
相对于MyBPC1在其他生物学过程中(如肌肉疾病)作用机制的研究,如MyBPC1基因是肌源性震颤[35]、患有阴囊疝猪的腹股沟区肌肉生理失衡[36]、儿童胰胆合并症[37]和绝经后骨质疏松症[38]等疾病的潜在生物标志物,本研究为此类肌肉疾病的诊断和治疗提供了研究基础。但MyBPC1对骨骼肌卫星细胞增殖分化的研究仍有较少的报道,所以本研究针对上调MyBPC1对牛骨骼肌卫星细胞的影响进行了一系列试验,结果显示,上调MyBPC1可促进骨骼肌卫星细胞的分化。
根据最新研究报道,下调MyBPC1对鸡胸肌RBCH卫星细胞增殖无显著影响,而对Ross 708卫星细胞的增殖具有明显的抑制作用。因此,MyBPC1表达对卫星细胞增殖的影响是根据卫星细胞种类的不同而有所不同[39],与本研究中过表达MyBPC1对西门塔尔牛骨骼肌卫星细胞增殖无显著影响有共同之处。MyBPC1是分化期后期的下游靶蛋白,对牛骨骼肌卫星细胞前期增殖期的影响很小。
4 结 论
本研究发现,MyBPC1对牛骨骼肌卫星细胞的分化具有明显的调控作用。过表达MyBPC1可以促进牛骨骼肌卫星细胞的分化,本研究探明了过表达MyBPC1在牛骨骼肌卫星细胞分化中的作用,为进一步开展MyBPC1调控牛骨骼肌分化机制研究提供了参考。

